特定聚合度区间壳寡糖的膜分离制备技术
2019-11-28,2,2,2,2,*
,2,2,2,2,*
(1.华东理工大学生物工程学院,发酵工业分离提取技术研发中心,生物反应器工程国家重点实验室,上海 200237;2.上海生物制造技术协同创新中心,上海 200237)
壳寡糖(Chitooligosaccharides,COS)是由D-氨基葡萄糖(或少量N-乙酰-D-氨基葡萄糖)之间通过β-1,4-糖苷键连接而成的聚合度(Degree of polymerization,DP)在2~10之间的低聚糖(及其盐),结构式见图1[1-2]。壳寡糖具有溶解度高、吸收能力强和生物相容性好等优点,被广泛应用于医药、食品、农业等领域[3]。聚合度是壳寡糖产品的重要参数,不同聚合度壳寡糖表现出不同的生理活性,如抗菌、抗肿瘤、抗氧化等[2,4-5]。Li等[2]通过对DP 3~7壳寡糖活性的研究,发现壳寡糖清除羟基自由基能力随着聚合度增加而降低。Chen等[4]研究发现口服壳二糖和壳三糖可以保护由于四氯化碳中毒导致的脂质过氧化反应小鼠。壳寡糖是壳聚糖的降解产物,一般通过化学法、物理法和生物法制备,然而直接制备得到的壳寡糖聚合度分布很宽。因此,壳寡糖混合物的分离纯化技术对壳寡糖的研究和应用具有重要意义。
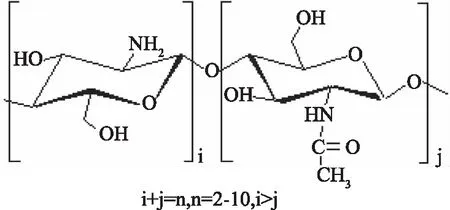
图1 壳寡糖分子式[2]Fig.1 Chitooligosaccharides structure[2]
膜分离是指借助膜的选择透过性,在外界能量或化学位差的推动下,对混合物中溶质和溶剂进行分离、分级、提纯和富集的方法[6]。膜分离技术具有操作简单、无污染、经济性好等优点,广泛应用于食品、发酵、医药等领域[7]。基于纳滤(nanofiltration,NF)的等体积渗滤(constant volume diafiltration,CVD)模式可以用于寡糖分离纯化过程[8-9]。膜分离技术在壳寡糖制备中常被应用于壳聚糖酶解液的处理过程,以制备高品质的壳寡糖产品。韩永萍等[10]对壳寡糖溶液进行纳滤纯化,成功去除了单糖、二糖和盐离子。Dong等[11]利用酶膜耦合分离制备得到了以DP 6~8为主的壳寡糖,收率及纯度分别为73.9%和82.2%。Qin等[12]通过酶膜耦合技术获得了纯度为56.17%的DP 5~10的窄分布壳寡糖。李允等[13]利用酶膜耦合技术制备得到了DP 4~8为主的壳寡糖产品。在膜分离过程中,由于浓差极化等阻力的存在,操作条件会对膜分离过程产生影响,因此通过调节物料浓度、温度和跨膜压差(transmembrane pressure,TMP)等条件,可以有效提高产品的收率和纯度[14-16]。
本研究利用膜分离技术处理壳寡糖混合物原料,分离制备DP 2~5窄分布的壳寡糖产品。首先,探索了物料浓度、温度和跨膜压差等条件对1000 Da纳滤膜分离壳寡糖效果的影响,并获得最佳的分离制备条件;之后,通过对连续渗滤过程中传质过程的研究,建立了壳寡糖产物纯度和收率的预测模型,并利用500 Da纳滤膜对渗滤透过液进行浓缩,制备得到DP 2~5的窄分布壳寡糖,本研究建立了一种基于纳滤膜分离的聚合度2~5壳寡糖的制备方法,为壳寡糖的功能研究和应用开发提供了基础。
1 材料与方法
1.1 材料与仪器
壳寡糖混合物(脱乙酰度98.6%,重均分子量1705 Da)、标准品壳二糖((GlcN)2)、壳三糖((GlcN)3)、壳四糖((GlcN)4)、壳五糖((GlcN)5) 惠州长龙生物技术有限公司;惠州长龙生物技术有限公司;乙腈 HPLC级,德国默克公司;其他试剂 均为分析纯或化学纯。
RNM-1812G型卷式膜设备 杭州瑞纳膜工程有限公司;卷式膜(NF4) 北京中科瑞阳膜技术有限公司;卷式膜(GE) 美国通用电气公司;LGJ-18C型冷冻干燥机 北京四环科学仪器厂有限公司;HHS-21-4型电热恒温水浴锅 上海医疗机械五厂;CP214C型电子分析天平 奥豪斯仪器(上海)仪器有限公司;Shimadzu LC-20AT型高效液相色谱仪、ELSD-LT-Ⅱ型检测器 日本岛津有限公司;Shodex NH2P-50 4E型色谱柱(4.6 mm ID×250 mm L,5 μm) 日本昭和朝日有限公司;本文使用的两种卷式膜的详细信息见表1。
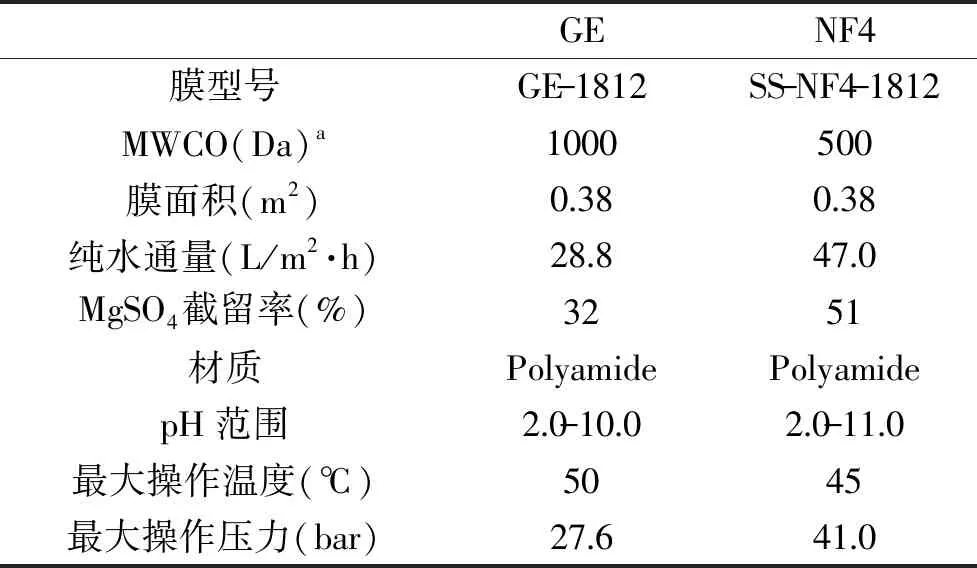
表1 膜材料和信息Table 1 Membrane materials and properties
1.2 实验方法
1.2.1 纳滤分离条件对分离过程的影响
1.2.1.1 物料浓度 分别配制3 L物料浓度为30、50、70、90和110 g/L的壳寡糖混合物溶液,经过抽滤后,在跨膜压差15 bar、温度45 ℃、全循环模式下(透过液和截留液均流入原料罐),运行30 min后,分别取截留液和透过液,并测定一定时间内透过液的体积,计算膜通量。通过重量法测定截留液和透过液中壳寡糖混合物的浓度,计算纳滤膜对壳寡糖混合物总的表观截留率。通过HPLC法测定透过液和截留液中不同聚合度壳寡糖的浓度,计算纳滤膜对不同聚合度壳寡糖(DP2~7)的表观截留率。
膜通量Jv为单位时间内通过单位膜面积的透过液的体积(L·m-2·h-1),计算如公式(1)所示:
式(1)
其中,Jv表示膜通量,L·m-2·h-1;Vp表示测定时间内透过液的体积,L;A表示有效膜面积,m2;t表示测定时间,h。
采用冷冻干燥法测定样品中壳寡糖混合物的质量,通过公式(2)计算浓度:
式(2)
其中,c表示壳寡糖的浓度,g/L;m表示试样中壳寡糖质量,g;V表示样品体积,L。
表观截留率计算如公式(3)所示:
式(3)
其中,Robs表示表观截留率,%;CP和CF分别为透过侧和截留侧溶质浓度,g/L。
1.2.1.2 温度 分别配制3 L物料浓度为70 g/L的壳寡糖混合物溶液,经过抽滤后,在跨膜压差15 bar、温度分别为25、30、35、40、45和50 ℃,在全循环模式下,运行30 min后,分别取截留液和透过液,并测定一定时间内透过液的体积,计算膜通量。通过重量法测定截留液和透过液中壳寡糖混合物的浓度,计算纳滤膜对壳寡糖混合物总的表观截留率。通过HPLC法测定透过液和截留液中不同聚合度壳寡糖的浓度,计算纳滤膜对不同聚合度壳寡糖(DP2~7)的表观截留率。
1.2.1.3 跨膜压差 分别配制3 L物料浓度为70 g/L的壳寡糖混合物溶液,经过抽滤后,在温度为45 ℃,跨膜压差分别为6、9、12、15和18 bar,在全循环模式下,运行30 min后,分别取截留液和透过液,并测定一定时间内透过液的体积,计算膜通量。通过重量法测定截留液和透过液中壳寡糖混合物的浓度,计算纳滤膜对壳寡糖总的表观截留率。通过HPLC法测定透过液和截留液中不同聚合度壳寡糖的浓度,计算纳滤膜对不同聚合度壳寡糖(DP2~7)的表观截留率。
1.2.2 数学模型分析及连续渗滤 配制3 L物料浓度为70 g/L的壳寡糖混合物溶液,经过抽滤后,在温度45 ℃、跨膜压差15 bar、全循环模式下,运行30 min后,进行渗滤实验。实验过程中,每次收集透过液达到1.5 L时,向物料罐中补充1.5 L去离子水。每当透过液达到3 L时,分别取截留液和透过液,并测定一定时间内透过液的体积,计算膜通量。分别测定透过液和截留液样品中壳寡糖混合物的浓度,用HPLC分析透过液样品的组分,计算透过液中累积得到的壳寡糖总量。
在渗滤过程中,透过液中每个成分的实际收率计算如公式(4)所示。
式(4)
其中:y表示各组分的收率;CP和CF,i分别为该组分在透过液和初始原料溶液中的浓度,g/L;VF和Vd分别为初始原料溶液体积和渗滤过程中透过液总体积,L。
在渗滤实验的研究过程中,使用了一种多溶质系统的分析方法,将所有的溶质分为两类:小分子溶质A(DP 2~5的壳寡糖)和大分子溶质B(DP≥6的壳寡糖),利用数学模型对实验结果进行分析,并通过数学模型预测DP 2~5壳寡糖的收率和纯度与渗滤倍数的关系。本研究是为了在透过液中获得小分子溶质A,尽量将大分子溶质B截留,因此主要分析透过液中小分子物质A的收率和纯度。透过液中小分子物质A的收率YP和纯度PuP计算分别见公式(5)和(6)。
式(5)
式(6)

在忽略浓差极化效应影响的条件下,假设溶质的渗透因子PC(PC=1-R)不受物料罐中溶质浓度变化的影响,且整个实验过程始终为恒体积渗滤过程,可以用数学模型对渗滤过程中的传质过程进行预测[19-21]。物料罐中料液浓度和渗滤倍数关系式见公式(7)。
式(7)
其中,Vd/VF被定义为渗滤倍数。
依据公式(5~7),透过液中小分子物质A的预测收率和纯度计算公式分别见(8)和(9)。
式(8)
式(9)
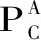
最后,扩大渗滤倍数至15倍,对数学模型进行验证,并将透过液作为下一步浓缩制备DP 2~5壳寡糖的原料。
1.2.3 DP 2~5壳寡糖的制备 经过上一步连续渗滤处理之后,高聚合度壳寡糖和DP 2~5的壳寡糖分别被富集在截留液和透过液中。在40 ℃,9 bar的条件下,使用500 Da纳滤膜(NF4)对透过液进行浓缩,取浓缩液分析组分并计算DP 2~5壳寡糖的收率和纯度。
1.2.4 膜的清洗 在膜组件使用前用去离子水测定膜初始水通量,当通量衰减低于10%时,表示膜可以继续使用。使用后,加入去离子水循环冲洗3遍后,加入配置好的2 L 0.4 g/L NaOH和0.5 g/L EDTA-2Na混合液,全循环40 min后,加入去离子水清洗至电导率接近去离子水的电导率且膜通量恢复初始通量时,表明膜及膜设备清洗干净,将拆下的膜组件泡入0.5%(w/v)NaHSO3保护液,封口并避光保存。
1.2.5 HPLC法定量测定壳寡糖 将待测样品配制成10 mg/mL的溶液,通过0.45 μm过滤膜过滤后,进行HPLC分析,测定样品中DP 2~7壳寡糖的含量。分析条件如下:色谱柱Shodex NH2P-50 4E;柱温30 ℃;流速V=1.0 mL/min;进样量10 μL;检测器为蒸发光散射检测器(ELSD-LT-Ⅱ);以乙腈和水作为流动相梯度洗脱(0~15 min,75%乙腈;15~40 min,75%~50%乙腈;40~45 min,50%~75%乙腈;45~55 min,75%乙腈)[17]。以壳寡糖标准品浓度(mg/mL)为横坐标,峰面积(×104)为纵坐标得到的标准曲线方程如下:壳二糖(y=126.43x-31.86,R2=0.999);壳三糖(y=105.07x-44.91,R2=0.998);壳四糖(y=93.08x-67.36,R2=0.998);壳五糖(y=34.73x-8.98,R2=0.997)。通过标准曲线计算可得样品中各组分的分布。由于缺少壳六糖((GlcN)6)和壳七糖((GlcN)7)标准品,采用壳五糖的标准曲线计算壳六糖和壳七糖的浓度[18]。
1.3 数据处理
实验重复三次,单因素实验数据以平均值±标准差表示,数学模型数据以平均值表示,采用SigmaPlot 10.0软件作图,采用Excel 2013对数据进行方差分析及模型分析。
2 结果与分析
2.1 物料浓度对纳滤分离效果的影响
如图2(A)所示,壳寡糖膜分离过程中,随着物料浓度的增加,膜通量逐渐降低,壳寡糖总的表观截留率略有降低。随着物料浓度的增加,物料黏度增加,由于渗透压增加且跨膜压差不变导致驱动力降低,从而导致膜通量的降低[8]。物料浓度对不同聚合度壳寡糖的表观截留率的影响见图2(B),随着物料浓度的增加,壳二糖和壳三糖表观截留率逐渐降低,壳四糖到壳七糖表观截留率变化不明显。随着物料浓度增加,浓差极化加剧,不可逆膜孔堵塞污染加剧,导致表观截留率降低。壳六糖和壳七糖的分子量较高,表观截留率较高(大于95%)且基本不受物料浓度影响。随着物料浓度的增加,不同聚合度壳寡糖组分之间的表观截留率差异逐渐增大,更有利于不同组分的分离。但是,物料浓度的增加会导致膜通量降低。根据目标物质,宜选用拥有较低表观截留率和较高膜通量的物料浓度,因此,综合考虑选择物料浓度70 g/L作为最佳条件。
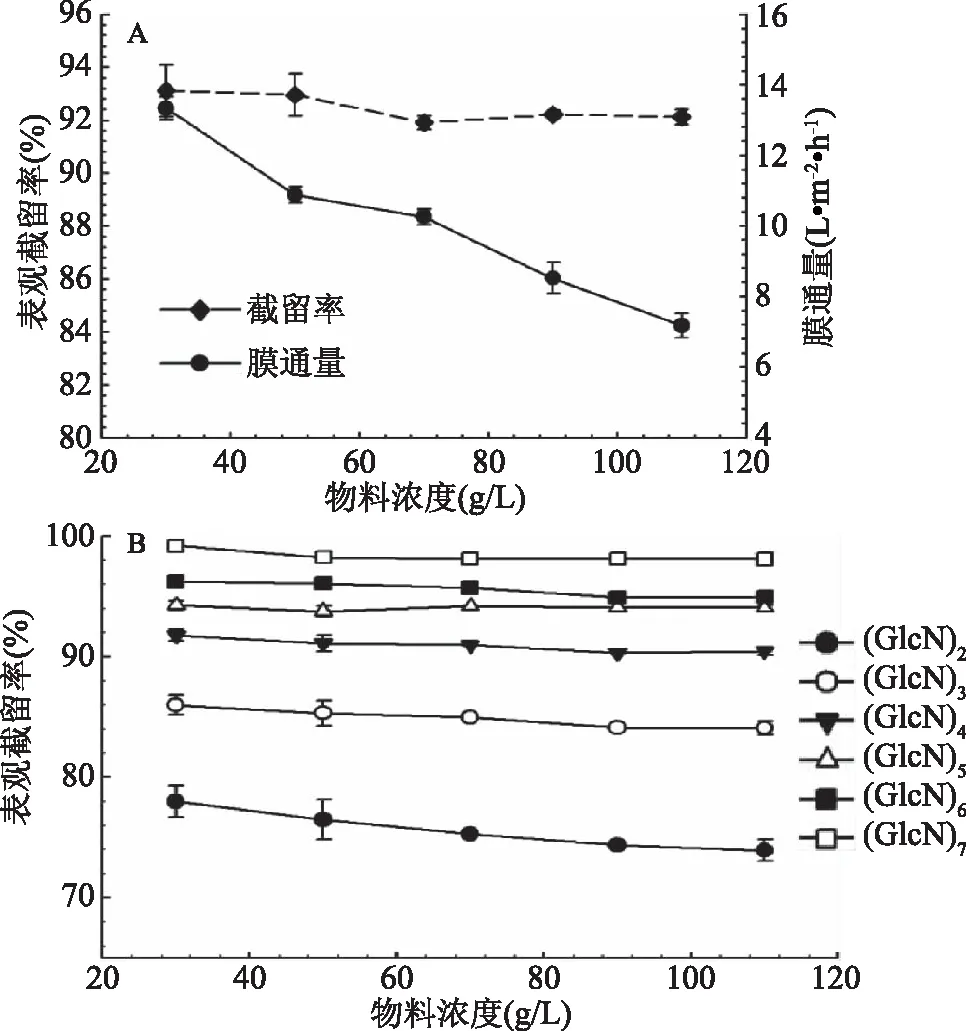
图2 物料浓度对膜通量和表观截留率的影响Fig.2 Effects of feed concentrationon permeate flux and observed rejection 注:A:物料浓度对膜通量和壳寡糖总的表观截留率的影响;B:物料浓度对不同聚合度壳寡糖表观截留率的影响。
2.2 温度对纳滤分离效果的影响
温度对膜通量和壳寡糖总的表观截留率的影响见图3(A),随着温度的增加,膜通量不断增加,壳寡糖总的表观截留率逐渐降低。膜通量增加的原因是由于随着温度上升,纯水透过系数增加且物料黏度下降[22]。由图3(B)可知,随着温度的增加,不同聚合度壳寡糖表观截留率均逐渐降低,表观截留率下降是由于随着温度升高壳寡糖的透过系数和有效膜孔径变大[20,23]。随着温度的增加,膜通量增加,不同聚合度壳寡糖组分之间的表观截留率差异逐渐增大,有利于壳寡糖的分离。但是,考虑到膜的最大操作温度为50 ℃,选择45 ℃作为最佳操作温度。
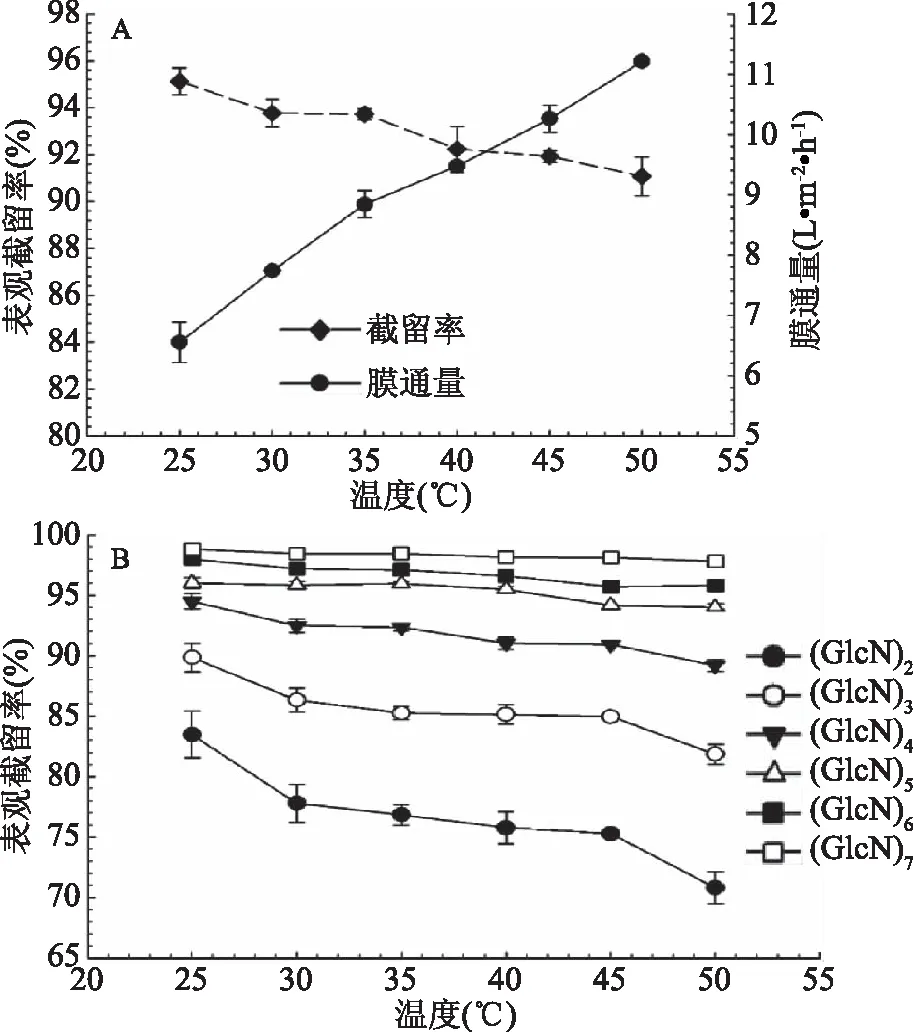
图3 温度对膜通量和表观截留率的影响Fig.3 Effects of temperature on permeateflux and observed rejection 注:A:表示温度对膜通量和壳寡糖总的表观截留率的影响;B:表示温度对不同聚合度壳寡糖表观截留率的影响。
2.3 跨膜压差对纳滤分离效果的影响
跨膜压差对膜通量和壳寡糖总的表观截留率的影响见图4(A),随着跨膜压差的增加,膜通量呈线性不断增加,壳寡糖总的表观截留率逐渐降低。由于膜分离过程主要由压力驱动,同时受到浓差极化效应的影响,因此压力的增加会直接导致膜通量的增加。由图4(B)可知,随着跨膜压差的增加,不同聚合度壳寡糖组分的表观截留率均逐渐升高,不同聚合度壳寡糖组分之间的表观截留率差异逐渐减少,不利于壳寡糖的分离过程。最终选择15 bar作为最佳跨膜压差条件。
2.4 数学模型分析及连续渗滤过程
随着连续渗滤过程的进行,壳寡糖在透过液中不断累积,渗滤体积对膜通量和透过液中壳寡糖总质量的影响见图5(A)。膜通量在渗滤实验进行的过程中呈现先下降后逐渐上升的趋势,这是由于第一次补充水前物料罐中壳寡糖混合物溶液被浓缩,浓度增加,而后续实验过程中,随着透过液中的壳寡糖不断移出,壳寡糖浓度下降。由公式(7)可知,ln(CF/CF,i)和Vd/VF之间存在一定的线性关系。由实验数据作图可得图5(B),由图中可知,ln(CF/CF,i)和Vd/VF之间存在良好的的线性关系(R2>0.97),各组分平均渗透因子Pc的计算结果见表2。

表2 各组分的平均渗透因子Table 2 Average permeation factors of various COS
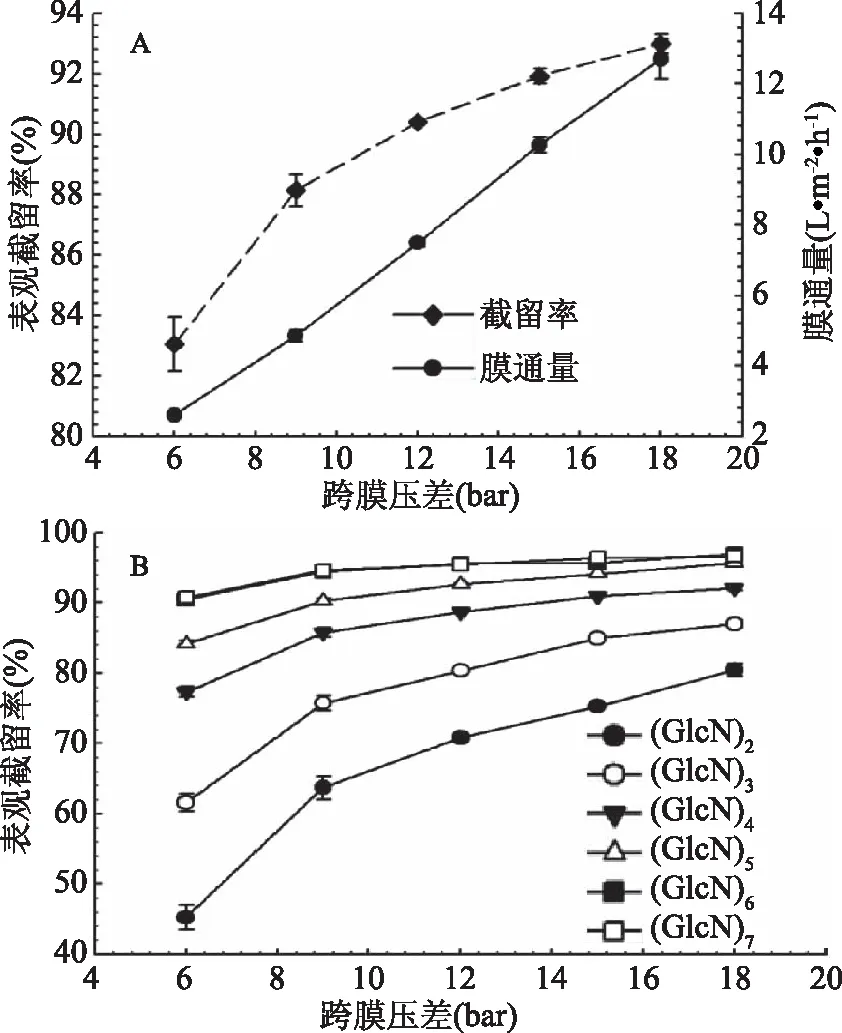
图4 跨膜压差对膜通量和表观截留率的影响Fig.4 Effects of TMP on permeateflux and observed rejection注:A:跨膜压差对膜通量和壳寡糖总的表观截留率的影响;B:跨膜压差对不同聚合度壳寡糖表观截留率的影响。
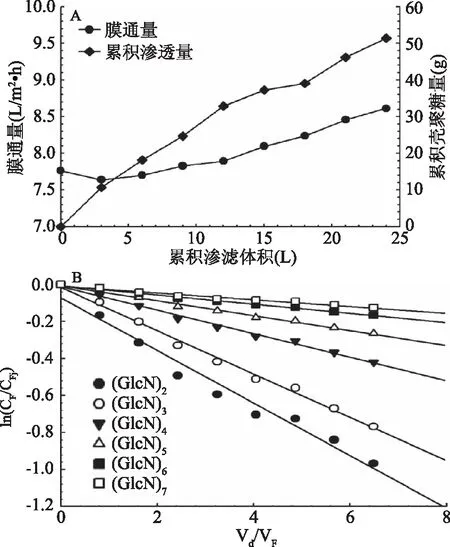
图5 连续渗滤对膜通量和透过液中壳寡糖总质量及截留液中各组分的影响Fig.5 Effects of continue diafiltration on permeate flux,cumulative permeate quantity of COS and relativeconcentration of each component in retentate注:A:渗滤体积对膜通量和透过液中壳寡糖总质量的影响;B:渗滤倍数对料液中壳寡糖各组分浓度的影响。
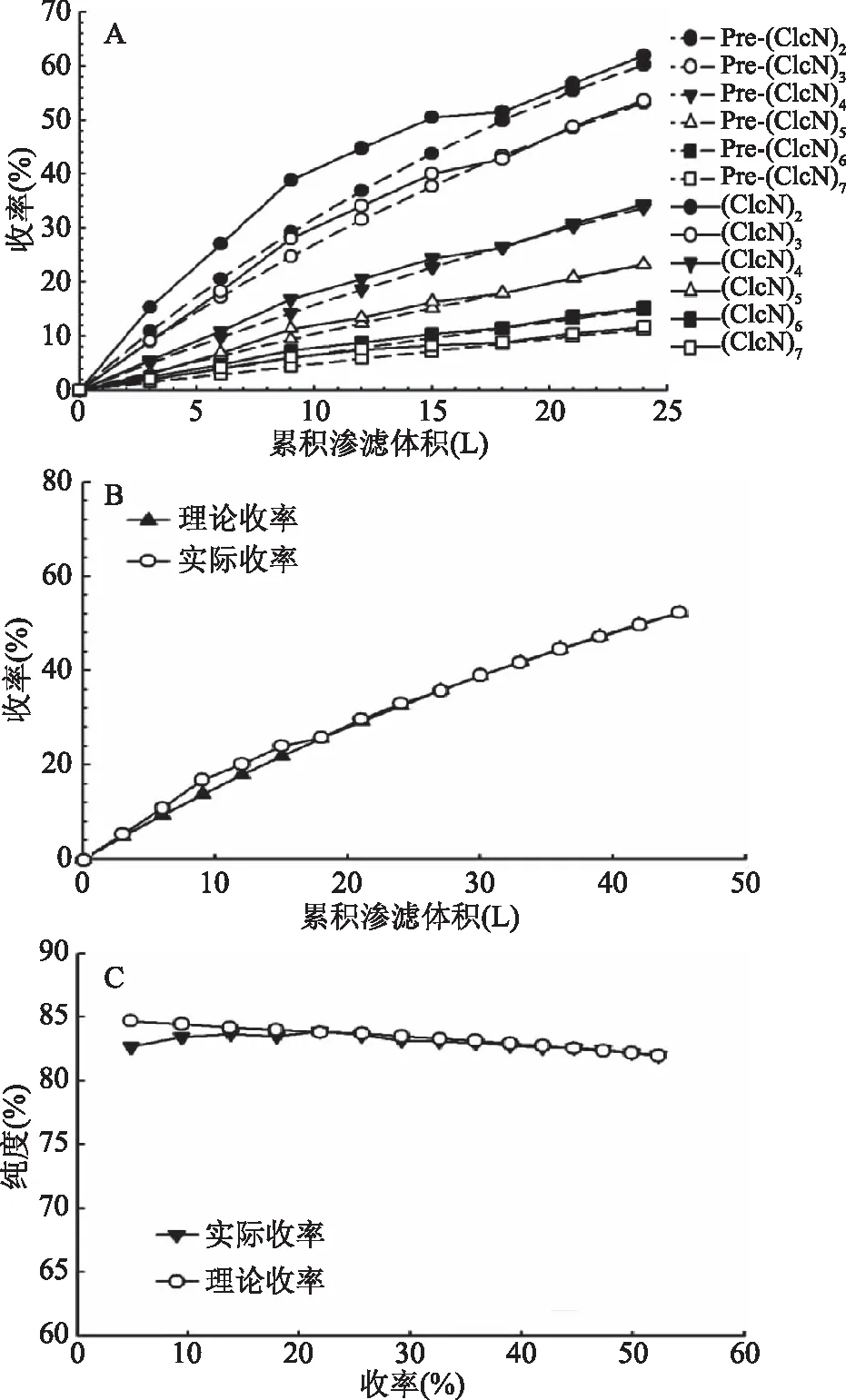
图6 累积渗滤体积与纯度和收率的关系Fig.6 Relationship between cumulativepermeate volume,purity and yield注:A:渗滤体积对透过液中不同聚合度壳寡糖(DP 2~7)实际收率和预测收率的影响;B:渗滤体积对DP 2~5壳寡糖理论收率和实际收率的影响;C:收率对透过液中窄分布壳寡糖(DP 2~5)理论纯度和实际纯度的影响。
通过公式(8)计算得到的各组分预测收率和实际收率与渗滤体积的关系见图6(A),预测收率与实际收率基本一致,壳三糖到壳七糖偏差值在10%以内。因此该模型可以用于预测渗滤过程中壳寡糖各组分的收率。
由图5(A)可知,在渗滤倍数为8倍时,渗滤并未达到平衡,可以通过扩大渗滤倍数提高收率。根据该模型计算DP 2~5壳寡糖混合物纯度和收率的理论值,扩大渗滤倍数测定实际收率及纯度进行实验验证,结果如图6(B)和6(C)。随着累积渗滤体积的增加,DP 2~5壳寡糖的实际收率与理论收率保持一致;随着收率的增加,透过液中DP 2~5壳寡糖的纯度略有降低,且实验数据与理论数据误差范围在4%之内。当渗滤倍数达到15时(渗滤体积达到45 L),DP 2~5壳寡糖的收率为52.3%,纯度为82.0%,与预测值相吻合。
2.5 浓缩制备DP 2~5窄分布壳寡糖
经1000 Da膜分离得到的透过液,再经过500 Da纳滤膜浓缩后,壳寡糖混合物原料和最终产品的HPLC分析结果如图7所示。窄分布壳寡糖组成为壳二糖5.4%(w/w),壳三糖18.6%(w/w),壳四糖25.5%(w/w),壳五糖32.6%(w/w),壳六糖12.7%(w/w),壳七糖5.0%(w/w)和少量高聚合度壳寡糖。而原料中壳寡糖组成为:壳二糖3.3%(w/w),壳三糖10.3%(w/w),壳四糖19.6%(w/w),壳五糖34.3%(w/w),壳六糖21.4%(w/w),壳七糖5.0%(w/w)和高聚合度壳寡糖(DP>7)。通过膜分离技术在产品中富集了DP 2~5的壳寡糖,提高了DP 2~5壳寡糖的纯度,最终得到的产品中DP 2~5的壳寡糖的纯度为82.1%,总收率为42.1%。
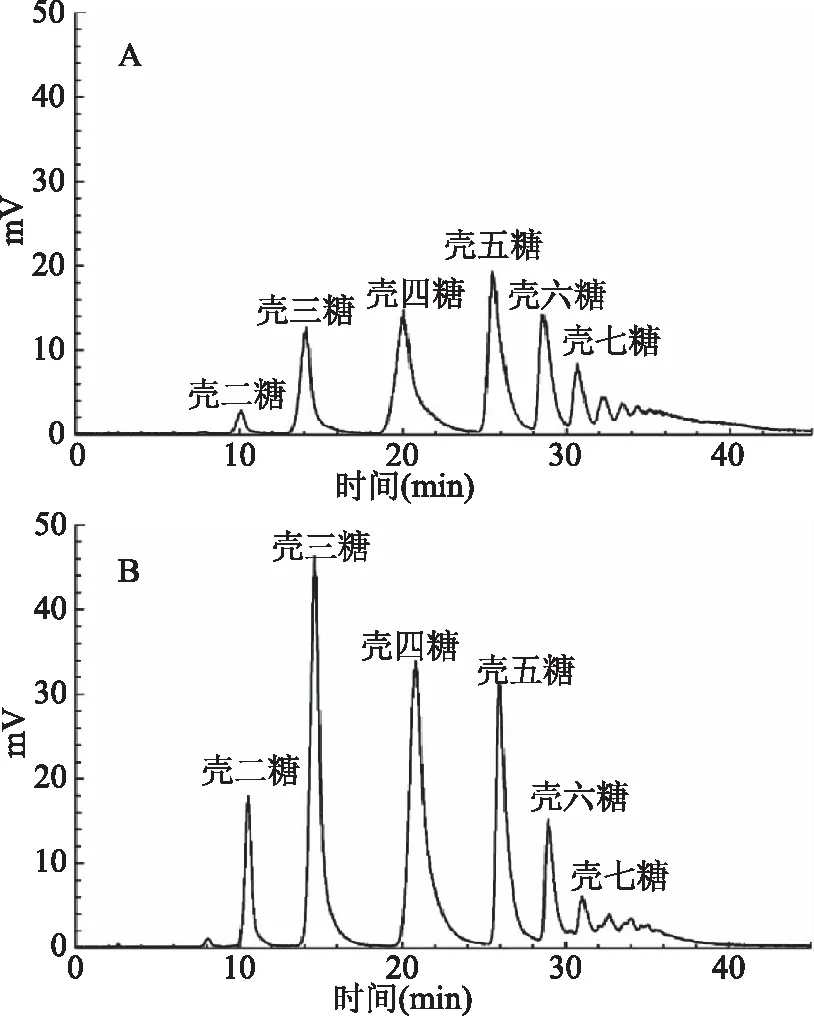
图7 壳寡糖原料和膜分离所得窄分布壳寡糖产物的HPLC分析图Fig.7 HPLC analysis of raw materialsand membrane separation product注:A:壳寡糖原料;B:膜分离所得窄分布壳寡糖产物。
3 结论
本文研究了不同条件对壳寡糖膜分离过程的影响,获得了1000 Da纳滤膜分离壳寡糖的最佳条件,即物料浓度70 g/L、温度45 ℃和跨膜压差15 bar。利用数学模型成功预测了渗滤过程中目标聚合度壳寡糖收率和纯度与渗滤倍数的关系,最后采用两步膜分离即渗滤和浓缩的方法制备得到了DP 2~5的窄分布壳寡糖,纯度和收率分别为82.1%和42.1%。本研究建立了特定聚合度区间壳寡糖膜分离制备工艺,为壳寡糖的功能研究和应用提供了技术支持。
