猪圆环病毒2 型片状载体悬浮培养生产工艺研究
2019-11-28虞慎义冯育宁
许 冬,曹 锋,魏 磊,张 路,虞慎义,冯育宁,商 俊
(安徽东方帝维生物制品股份有限公司,安徽 亳州 236800)
猪圆环病毒2 型(PCV2)属于圆环病毒科,感染PCV2 后导致母猪繁殖障碍、猪增生性和坏死性肺炎、猪皮炎、肾病综合征(PDNS)、断奶仔猪多系统衰竭综合征(PMWS)以及猪的先天性震颤等疾病。该病毒在全国各地区广泛流行,给世界养猪业带来了巨大的影响和严重的经济损失,现在对于猪圆环病毒2 型主要以疫苗预防为主[1]。目前疫苗生产中,常用PK-15 细胞增殖PCV2,但由于PCV2 体外增殖能力弱,致使PCV2 抗原含量较低,因此,PCV2 的抗原含量高低已成为制约现有疫苗质量的关键瓶颈之一,大规模细胞培养核心技术是提升单位体积内PK-15 细胞的数量,其中微载体悬浮培养[2-3]、片状载体悬浮培养、全悬浮培养是当前较为成熟的一项大规模细胞培养技术,在国内外已成功应用于兽用疫苗抗原制备,这三种培养技术具有自动化控制程度高、不易污染、易于大规模生产、抗原产量和含量高等优点[4]。片状载体悬浮培养在单位体积内细胞的数量要大于微载体悬浮培养,因此本研究选择了片状载体悬浮培养生产PCV2 抗原的工艺流程,克服了现有PCV2 灭活疫苗病毒含量低的技术瓶颈,为大规模生产疫苗抗原提供了依据。
1 材料与方法
1.1 毒种和细胞 PK-15 细胞和猪圆环病毒2 型毒种(病毒含量106.0TCID50/mL)由安徽东方帝维生物制品股份有限公司自繁、保存。
1.2 主要试验材料 片状载体(ESCO BioNOC IITM);DMEM 干粉(Gibco 公司);D-氨基葡萄糖(Sigma公司);胰酶(Gibco 公司);新生牛血清(金源康实业有限公司);PCV2 单克隆抗体(北京博益通达科技有限公司);羊抗鼠荧光二抗(东莞寮步毕质生物试剂有限公司)。原辅材料经检验均符合要求。
1.3 主要仪器设备 生物反应器,购自南京比瑞生物科技有限公司;血糖仪及试纸(罗氏血糖仪);0.22 μm 滤芯、滤壳,购自美国Pall 公司;pH 计,购自德国赛多利斯公司;荧光倒置显微镜、倒置显微镜,购自德国徕卡公司;转瓶机、细胞观测台,购自兰州澜飞公司;移液器,购自德国艾本德公司。所有仪器设备经过验证,符合要求。
1.4 培养基生长液 DMEM 溶液加10%新生牛血清,用7.5% 碳酸氢钠调pH 值至7.0;维持液:DMEM 溶液加2%新生牛血清,用7.5%碳酸氢钠调pH 值至7.0。
1.5 方法
1.5.1 接毒量及最佳带毒传代次数的确定 按0.5%、1%、3%、5%接毒量,同步接种到PK-15 细胞悬液中,至15 L 转瓶,37 ℃培养24 h 后加入终浓度为1 mmoL/L 的D-氨基葡萄糖溶液,当细胞长至致密单层后,按照1∶3的比例进行带毒传代,按此方法进行4 次带毒传代,观察细胞的生长情况,每次带毒传代前取样进行病毒含量测定。每个接毒量带毒传代后留2 瓶,病毒含量为2 瓶的混合样。
1.5.2 片状载体浓度的确定 选取浓度分别为15 g/L、20 g/L、25 g/L、30 g/L 的片状载体,接种浓度为0.5×106的PK-15 细胞进行悬浮培养,24 h 开始第1 次取样,其后每4 h 取样1 次,测定葡萄糖的含量,根据糖耗情况更换生长液,直到糖耗稳定,观察不同片状载体浓度到糖耗稳定时的时间,然后换维持液,继续培养,48 h 取样测病毒含量,继续观察能维持细胞的最长时间。其他培养条件:pH 值为7.2、DO 为60%、培养温度为37 ℃、转速50 r/min。
1.5.3 片状载体悬浮培养接种细胞浓度确定 设定0.25×106、0.5×106、0.75×106、1×106个细胞/mL 4 个初始接种密度(含毒),分别接种于生物反应器中进行培养,24 h 开始取样,其后每4 h 取样1次,检测葡糖糖含量,当葡萄糖含量小于5 mmoL/L时更换生长液,直到糖耗稳定,换维持液继续培养48 h 取样做TCID50检测,并继续培养观察细胞维持最长时间。其他培养条件:pH 值为7.2、DO 为60%、培养温度为37 ℃、转速50 r/min。
1.5.4 最佳收获时间确定 将含PCV2 的细胞悬液接种到片状载体上悬浮培养,24 h 开始每4 h 检测1 次葡糖糖含量,根据葡糖糖含量更换生长液,直到糖耗稳定,换维持液继续培养,在24 h、36 h、48 h、60 h、72 h 取样做TCID50测定,连续做3 批。其他培养条件:pH 值为7.2、DO 为60%、培养温度为37 ℃、转速50 r/min。
1.5.5 最佳连续收获时间的确定 将含毒的细胞悬液接种到片状载体上悬浮培养,24 h 开始每4 h检测一次葡糖糖含量,根据葡糖糖含量更换生长液,直到糖耗稳定,换维持液继续培养48 h 进行一收,加入新的维持液继续培养,在24 h、36 h、48 h 取样做TCID50测定并收获后换维持液,按此方法连续收获,直到细胞脱落,连续3 批试验。其他培养条件:pH 值为7.2、DO 为60%、培养温度为37 ℃、转速50 r/min。
2 结果
2.1 接毒量及最佳带毒传代次数 试验结果见表1,0.5%和1%接毒量在3 次带毒传代后细胞状态良好,第4 次带毒传代出现细胞脱落,3%和5%接毒量在第3 次带毒传代后细胞出现脱落,1%接毒量3 次带毒传代后的抗原病毒含量明显大于0.5%的接毒量,为了上生物反应器的细胞既能生长良好又能产出高病毒含量,根据本试验结果,最佳的接毒量为1%,最佳带毒传代次数为2 次。
2.2 片状载体浓度 试验结果见表2,片状载体浓度在15 g/L 和20 g/L 时细胞维持时间比25 g/L 和30 g/L 要长,20 g/L 的片状载体浓度生产出的抗原病毒含量要高于15 g/L,而20 g/L 的片状载体浓度生产出的抗原病毒含量比25 g/L 和30 g/L 的略低。综合考虑,最佳的片状载体浓度为20 g/L。
2.3 片状载体接种细胞浓度 试验结果见表3,接种每毫升细胞浓度25 万个和50 万个的细胞维持时间最长,每毫升50 万个细胞浓度的抗原病毒含量明显比每毫升25 万个细胞浓度的高,而每毫升50 万个细胞浓度的抗原病毒含量和每毫升75 万个、100 万个细胞浓度相当。综合考虑,最佳的片状载体细胞接种浓度为0.5×106个细胞/mL。
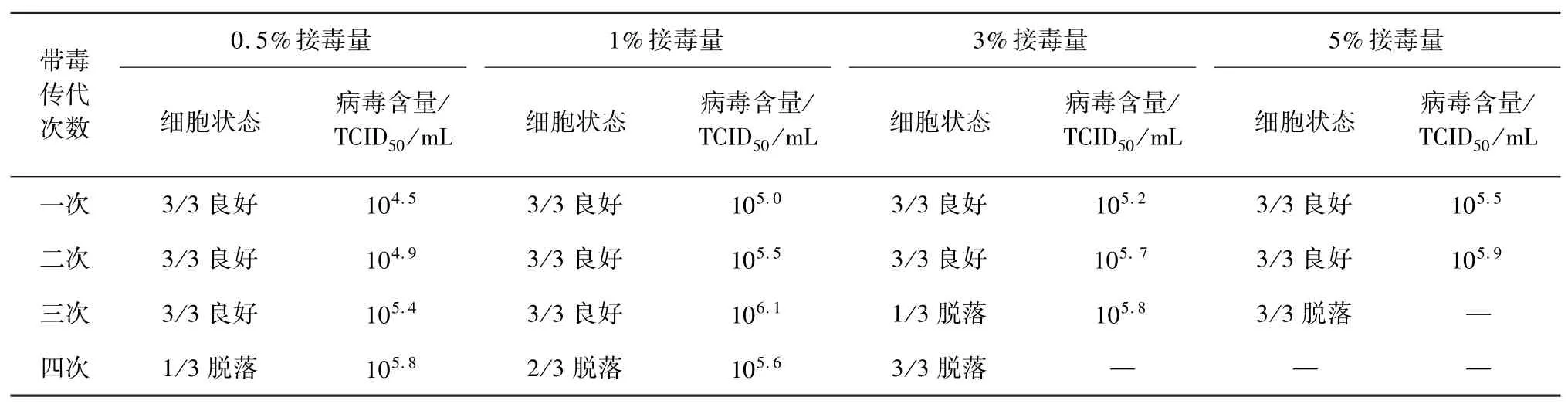
表1 接毒量及最佳带毒传代次数试验结果
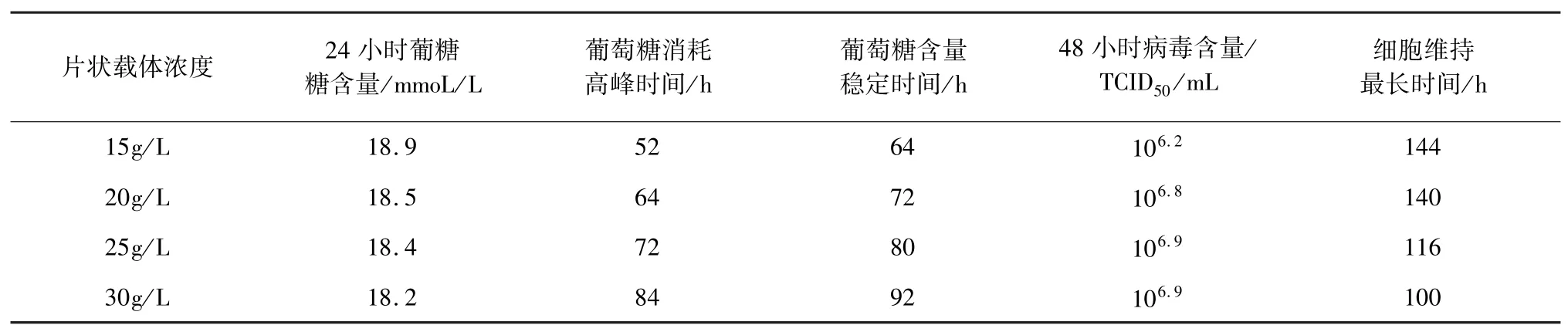
表2 片状载体浓度试验结果
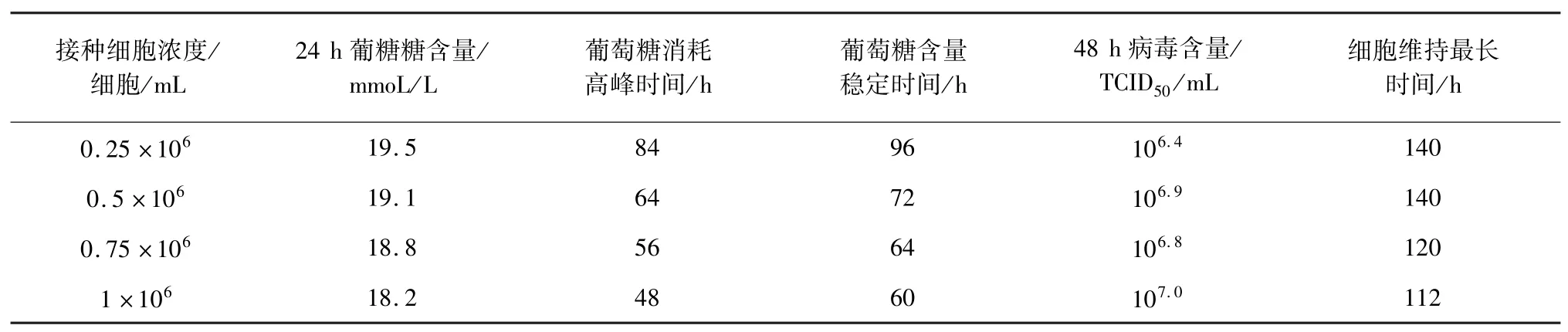
表3 片状载体接种细胞浓度试验结果
2.4 最佳收获时间试验 结果见表4,综合3 批的结果可知,48 h 的抗原病毒含量明显高于24 h 和36 h,而48 h 的抗原病毒含量只比60 h 和72 h 的略低。综合考虑,最佳的收毒时间为换维持液后48 h。
2.5 最佳连续收获时间 试验结果见表5,综合3批6 个收次的检验结果,24 h、36 h、48 h 的抗原病毒含量呈梯度上升且48 h 的抗原病毒含量最高。本次3 批的试验,从第5 收开始细胞有少量的脱落,第6 收细胞脱落明显,考虑抗原的纯净性,没有继续培养收获,从抗原病毒含量的检验结果看,第6 收的抗原病毒含量明显下降,综合考虑,最佳的连续换液收获时间为48 h,最少可连续收获5 次。
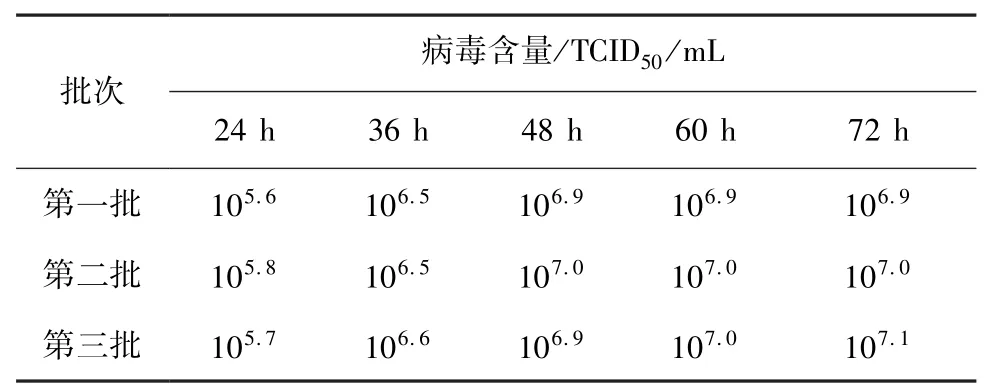
表4 最佳收获时间试验结果

表5 最佳连续收获时间试验结果
2.6 试验结论 利用片状载体悬浮培养生产PCV2抗原的最佳生产工艺为:按1%接毒量将PCV2 毒种接种到PK-15 细胞悬液中,在转瓶上培养,并带毒传代2 次后,将含毒的细胞悬液接种到片状载体上悬浮培养,最佳的片状载体浓度为20 g/L,最佳细胞接种浓度为0.5×106个细胞/mL,培养过程中通过糖的消耗情况,进行换液,培养72 h 换维持液,每48 h 收获1 次,可连续收获5 次以上,且抗原的病毒含量均大于106.5TCID50/mL,前5 次收获稳定在107.0TCID50/mL。
3 讨论
3.1 目前大部分企业生产PCV2 疫苗都采用转瓶培养,抗原病毒含量较低、产量小,难以达到制备全病毒灭活疫苗的要求[5];采用微载体悬浮培养PCV2 抗原很难克服搅拌剪切力导致细胞脱落的问题;全悬浮培养PCV2 抗原的生产工艺,目前只能做到1 次收获。本研究利用PCV2 在PK-15 细胞内繁殖不产生细胞病变,且细胞长满后维持时间长的特性,制定了本研究的方案,在抗原病毒含量和收获方式上取得了重大突破,病毒含量比传统转瓶生产的抗原病毒含量高5~10 倍,且采用连续收获法,打破了传统的一次收获法,提高了抗原产量,收获上清液,降低了抗原纯化的难度。
3.2 目前全病毒的PCV2 灭活疫苗品质还有很大的提升空间,比如抗原的精细纯化以及纯化的方法、减少副反应等等问题的研究。近年来,对PCV2的研究在分子生物学方面取得了显著的进展,部分企业研发的猪圆环基因工程疫苗在市场上得到了很好的应用,比如:勃林格等为昆虫杆状病毒表达的基因工程亚单位疫苗,用PCV2 的ORF2 基因(Cap 蛋白)插入到昆虫杆状病毒[6],用昆虫细胞培养,获得重组的PCV2 Cap 蛋白[7],制备亚单位疫苗。而易邦采用PCV2 的ORF2 基因(Cap 蛋白)插入大肠杆菌原核载体中去,利用大肠杆菌表达PCV2 Cap 蛋白[8],制备亚单位疫苗。普莱柯利用大肠杆菌表达的Cap 蛋白,然后将5 个Cap 蛋白组装成一个五聚体,再将12 个五聚体组装一个VLP(病毒样颗粒)[9],比单纯的Cap 蛋白免疫原性好。采用基因工程的方法生产出的PCV2 疫苗,纯度高,副反应很小,成为今后疫苗研究的热点。
