高压均质处理对不同浓度肌原纤维蛋白水悬液理化特性及蛋白结构的影响
2019-11-27,*
,*
(1.南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏南京 210095;2.江苏省肉类生产与加工质量安全控制协同创新中心,江苏南京 210095;3.山东省烟台市东方海洋科技股份有限公司,山东烟台 246003)
肉类蛋白营养丰富,包含人类所需的所有必需和非必需氨基酸,其消化率远高于大豆蛋白等植物蛋白,属于优质的人体蛋白质补充剂[1-2]。肌原纤维蛋白(Myofibrillar proteins,MP)是肌肉蛋白中最主要的蛋白质,大约占肌肉蛋白的50%左右[3]。一般认为,MP属于盐溶性蛋白,仅在高盐浓度下有较高的溶解性,在水溶液中溶解性差[4]。在肉品加工中,MP溶解性直接影响产品加工特性,如粘结性、乳化性和凝胶型等[5-6]。因此,MP溶解性是开发新的配方和肉类产品一个重要的功能特性。由于肉类蛋白在水或者低离子强度溶液条件下中微溶或不溶解,因此相比于牛奶和植物蛋白等而言,肉类蛋白在食品加工中利用程度相对较低,产品形式单一,提高肉类蛋白在水或者低离子强度溶液中的溶解度很有必要。
为了提高肉类蛋白的利用程度,开发其加工潜力,许多研究人员尝试利用不同的方法,如超声波[7]、蛋白糖基化[8-9]和低盐洗脱[10]等新技术来改善MP的溶解性,但是由于这些方法步骤繁琐,并且容易引起加工特性劣变,故在工业生产中受限。高压均质(High pressure homogenization,HPH)是一种新型的食品加工技术,此项技术已经被研究应用于生物、医药、食品、化工等行业。在高压作用下,流体物料通过具有特殊内部构造的均质腔,同时受到高速剪切,高频震荡、空穴作用和对流碰撞等物理作用,从而起到很好的超微化、微乳化、均一化和杀菌的效果[11-13]。理论上,通过HPH的物理作用能够打破MP高度交联的复杂结构,对MP进行物化改性,能够实现MP的水溶性。已有研究表明,不同次数和压力的HPH处理可以对植物蛋白的蛋白结构[14-17]、理化特性产生不同的影响,从而提高植物蛋白在食品加工中的利用程度[18-20]。在前期研究中[13],发现对5 mg/mL的MP悬浊液进行103 MPa、2次HPH处理,能够打破MP高度有序的复杂结构,改变MP的理化特性,从而改善MP的水溶性。蛋白质是一种人体营养的重要补充来源,而蛋白浓度是食品加工中的一项重要理化指标,蛋白浓度的不同会影响体系中的凝胶特性、溶解性和乳液稳定性等加工特性。5 mg/mL浓度的MP水悬液并不能满足食品加工的需要,同时,当MP在水中的浓度提高时,HPH处理对不同浓度的MP在水中的溶解性的影响以及其调控规律还尚不清楚,开展HPH对不同浓度MP水悬液溶解性的调控规律研究很有必要。
在前期研究的基础上,为了使MP达到较好的HPH处理效果,本实验通过103 MPa压力下,4次HPH循环分别对5、10、15 mg/mL的MP水悬液进行处理,对处理后的MP水悬液溶解性、稳定性、粒径、流变特性、二级结构和三级结构的变化进行测定,探究HPH处理对不同浓度MP理化性质及结构的影响和规律,以期为肉蛋白的在食品中的进一步开发利用提供一定的参考依据。
1 材料与方法
1.1 材料与仪器
冷冻鸡胸肉 江苏省南京市苏果超市;羟甲基氨基甲烷(Tris base)、盐酸、牛血清蛋白(BSA)、聚乙二醇辛基苯基醚(Triton X-100)、氢氧化钠、5,5′-二硫代双(2-硝基苯甲酸)(DTNB)、8-苯胺基-1-萘磺酸(ANS)等(均为分析纯) 国药集团化学试剂有限公司。
GM 200粉碎仪 德国Retsch仪器有限公司;T25匀浆机 德国IKA仪器有限公司;Mini Debee超高压均质机 美国Bee仪器有限公司;Z5(130 μm)金刚石喷嘴 美国Genizer仪器有限公司;J26SXP落地式离心机 美国Beckman仪器有限公司;Nano ZS 90纳米激光粒度仪 英国马尔文仪器有限公司;MCR 301流变仪 澳大利亚Anton Paar有限公司;Dimension Icon原子力显微镜 美国Bruker有限公司;Imager Scanner III EU-88 扫描仪 日本Epson公司。
1.2 实验方法
1.2.1 肌原纤维蛋白(MP)的提取 根据Stefansson等[10]的方法稍作修改,采用水洗法提取肌原纤维蛋白。取冷冻鸡胸肉在4 ℃下放置12 h解冻,随后去除其结缔组织和脂质。将鸡胸肉放入粉碎仪,以3000 r/min的速度处理10 s,用去离子水将肉糜(100 g)混合,洗涤四次,每次洗涤前用匀浆机均质2 min。将每次洗涤后的肉糜与水(1∶100,W/V)混合,静置10 min,以18000×g转速离心20 min,收集沉淀物,在第三次洗涤后,将离心前的悬浊液用三层纱布过滤,以去除多余的结缔组织和脂质。最后一次洗涤、离心后,沉淀物即为肌原纤维蛋白(MP)。所有操作均在4 ℃条件下进行。
1.2.2 高压均质(HPH)处理 用双缩脲法测定提取后的MP浓度为60 mg/mL,用去离子水将MP浓度稀释至5、10、15 mg/mL备用,用匀浆机在8000 r/min转速下处理6次,每次处理20 s,每次间隔10 s。用配备有Z5型号喷嘴的超高压均质机将样品在4 ℃、103 MPa压力下进行循环4次HPH处理,以未经过HPH处理的样品为对照组。处理后将所有样品装入无菌袋保存,为了防止微生物污染对实验结果产生影响,添加0.02%的叠氮化钠(NaN3)作为防腐措施[21],所有样品于4 ℃冰箱存储备用。
1.2.3 溶解度的测定 参考Chen等[13]的方法,并作修改。将经过处理后的样品在4 ℃条件下,在20000×g转速下离心20 min,离心后收集上清液,用双缩脲法测定离心后的上清液蛋白浓度和离心前MP悬浊液蛋白浓度。溶解度以离心后的上清液蛋白质浓度相对于离心前MP悬浊液蛋白浓度的百分比表示,溶解度计算公式为:

1.2.4 稳定性的测定 将经过HPH处理后的MP水悬液在4 ℃条件下放置9 d,在第0、3、6、9 d分别测定其溶解度并进行记录,每个样品平行测定3次。
1.2.5 粒径分布的测定 根据Chen等的方法[13],并作修改。使用Nano ZS 90纳米激光粒度仪对MP在水中的粒径进行测定。将5、10、15 mg/mL的MP水悬液浓度同时稀释至0.5 mg/mL,置于1 cm光程石英比色杯中,在25 ℃条件下进行测量,从而得到平均粒度(Z-average)和粒径分布。
1.2.6 流变特性的测定 使用MCR30流变仪对经过HPH处理后的MP水悬液的流动特性进行测定[25]。测量间距0.5 mm,测量前将样品在流变仪上平衡30 s,以获得25 ℃的理想温度,记录随着剪切速率从1 s-1升高到1000 s-1的范围内时粘度的变化曲线。
1.2.7 表面疏水性的测定 根据Zhong等[26]、Cao等[27]的方法并作修改,对经过HPH处理后的MP在水中表面疏水性的进行测定,使用8-苯胺基-1-萘磺酸(ANS)测试表面疏水性。向2 mL样品(去离子水稀释至1 mg/mL)中加入10 μL 15 mmol/L ANS溶液(0.1 mol/L磷酸盐缓冲液,pH7.0)。在避光条件下,孵育20 min;使用380 nm的激发波长和410~570 nm的发射波长在5 nm/s扫描下测定其荧光强度。表面疏水性表示为荧光强度(任意单位,a.u.)。
1.2.8 活性巯基含量的测定 根据Chen等[28]的方法并进行修改,测定MP在水中的活性巯基(SH)含量。将经过HPH处理后的MP水悬液用去离子水稀释至1 mg/mL,将50 μL DTNB溶液(20 mmol/L磷酸盐缓冲液,pH8.0)中加入4 mL样品(1 mg/mL),并在25 ℃条件下孵育20 min,通过Microplate Reader分光光度计在412 nm测定混合物的吸光度。使用13600 M-1·cm-1的摩尔消光系数计算巯基的含量,每个压力水平重复试验三次。巯基浓度(μmol/100 mg)的计算公式为:
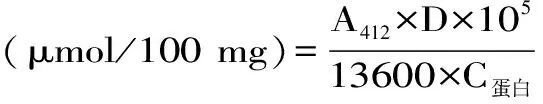
式中:A412为吸光度;D为稀释倍数;C蛋白为肌原纤维蛋白浓度。
1.2.9 圆二色谱(CD)分析 使用Jasco J-715分光偏振计进行圆二色谱(CD)测定。将经过HPH处理后的MP水悬液稀释至0.3 mg/mL,随后转移至0.1 cm光径的石英皿中。在调节温度下以20 nm/min的扫描速率在200~240 nm的范围内测量分子椭圆率。使用Jasco J-715旋光偏振计提供的蛋白质二级结构计算程序测定样品二级结构的百分比。
1.3 数据分析
所有数据均重复实验3次,数据统计使用SAS软件,单因素方差分析分析组间差异性,P<0.05为显著差异。采用Origin 2017软件进行绘图。
2 结果与分析
2.1 HPH处理对不同浓度MP水悬液溶解性的影响
由图1可知,未经过HPH处理的样品,溶解度较低(23.49~31.77%),MP在水中的溶解性较差[26],并且不同浓度MP水悬液的溶解度之间没有显著性差异(P<0.05),说明浓度的不同对未经HPH处理的MP在水中的溶解性没有明显影响。经过HPH处理后,不同浓度MP水悬液的溶解度均显著提高(P<0.05),其中浓度为5 mg/mL的MP水悬液溶解性最好,达到88.39%,这与Chen等[13]的研究结果相符。物料在经过HPH时,会受到高速剪切、空穴作用、对流撞击等机械作用,MP蛋白分子结构展开,疏水基团更多地暴露出来,导致表面电荷增加,从而提高其溶解性。随着MP水悬液浓度的增加,观察到MP水悬液的溶解度显著降低(P<0.05),说明MP水悬液的浓度越高,经过HPH处理后,MP在水中溶解的效果越差,造成这种现象的原因可能是由于当高浓度的MP悬浊液通过HPH作用腔时,由于蛋白质密度较大,蛋白质在均质腔中直接碰撞概率大大提高,容易形成蛋白质聚集,影响其溶解性。
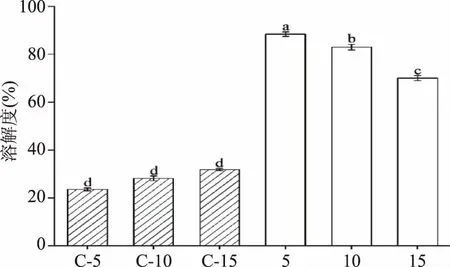
图1 HPH处理对不同浓度水悬液中MP溶解性的影响Fig.1 Effect of HPH treatment on MP solubilityin water suspensions with different concentrations注:不同上标字母表示同一指标存在显著性差异(P<0.05);C-5:Control,5 mg/mL;C-10:Control,10 mg/mL;C-15:Control,15 mg/mL;5:HPH处理,5 mg/mL;10:HPH处理,10 mg/mL;15:HPH处理,15 mg/mL。图3、图7同。
2.2 HPH处理对不同浓度MP水悬液稳定性的影响
将经过HPH处理后的MP水悬液进行为期9 d的储藏,每隔3 d测定样品溶解度,得到不同浓度MP水悬液溶解度的变化如图2所示。由图2可知,未经过HPH处理的MP水悬液在贮藏期间一直保持着较低的溶解度,随着贮藏时间的延长,没有显著性变化(P>0.05)。经过HPH处理后,不同浓度MP水悬液的溶解度均显著提高(P<0.05)。处理浓度为5 mg/mL的MP水悬液溶解度显著高于其他处理浓度(P<0.05),在0~6 d时溶解度无显著性变化(P>0.05),在6~9 d时显著降低(P<0.05),在第9 d时,5 mg/mL的溶解度为79.08%;处理浓度为10 mg/mL的MP水悬液溶解度在第0~9 d时显著下降(P<0.05),处理浓度为15 mg/mL的MP水悬液在第3 d时的溶解度与0 d时相比显著下降(P<0.05),3~6 d无显著性变化(P>0.05),在第9 d时显著低于第3 d(P<0.05)。研究表明,处理浓度为5 mg/mL的MP水悬液经过103 MPa、2次HPH的处理后溶液的均一性得到显著改善,同时在14 d的贮藏过程中几乎不会产生蛋白质沉淀现象[13,27-28],与本研究结果一致,这是由于当蛋白浓度较低时,水悬液的流动性更强,可以用更快的速度通过HPH均质阀,破碎更为完全,颗粒分布更加均匀,从而提高其稳定性。但是,当MP的浓度增加时,MP水悬液中的蛋白质密度也随之增加,物料通过HPH均质腔时,剪切、碰碰撞等机械作用对蛋白质分子的破坏不完全,导致蛋白质分子在水悬液中分散不均匀,从而在贮藏过程中聚集、沉淀,使MP水悬液稳定性下降[14,29-30]。
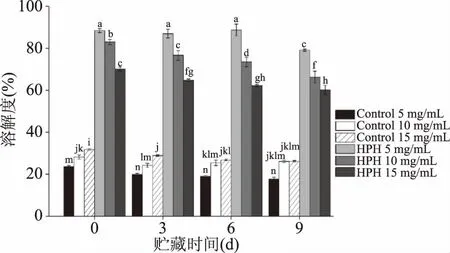
图2 HPH处理对不同浓度MP水悬液稳定性的影响Fig.2 Effect of HPH treatment on stability ofMP water suspension with different concentrations注:不同上标字母表示同一指标存在显著性差异(P<0.05)。
2.3 HPH处理对不同浓度MP水悬液粒径的影响
HPH处理对不同浓度MP水悬液粒径的影响如图3和图4所示。由图3可知,与经过HPH处理的样品相比,未经处理的样品具有更大的粒径[16]。MP水悬液浓度越高,粒径越大,说明溶液中蛋白的粒径大小随着MP水悬液浓度的提高而显著增加(P<0.05)。经过HPH处理后,各处理组MP水悬液的粒径显著降低(P<0.05),其中5 mg/mL的MP水悬液粒径最低(263.4 nm)。与之相比,经过处理后的10、15 mg/mL MP水悬液具有较大的粒径(P<0.05),分别达到366.3、400.7 nm,并且两者之间没有显著性差异(P>0.05)。由图4可知,随着MP水悬液浓度的提高,粒径分布峰有向大粒径分布的趋势,10、15 mg/mL的MP水悬液之间没有明显的区别。未经过HPH处理时,MP悬浊液中可能还存在一些高度有序状态的肌原纤维蛋白,导致粒径较大。MP悬浊液通过HPH均质腔,受到一系列剪切力、空穴作用、碰撞作用等机械力,蛋白质结构被破坏成更小的片段,导致粒径减小。随着MP浓度的增加,蛋白质在HPH均质腔中的相互作用加强,可能导致均质腔内部压力上升,同时据研究报道,当压力增加时,HPH处理比较容易使蛋白质产生聚集[19,31-32]。故高浓度的蛋白可能会影响HPH均质腔中压力的作用效果,从而影响其粒度特性。
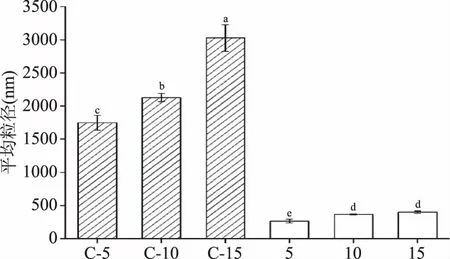
图3 HPH处理对不同浓度水悬液中MP的Z-平均粒径的影响Fig.3 Effect of HPH treatment on Z-average particle size ofMP in water suspensions with different concentrations

图4 HPH处理对不同浓度MP水悬液粒径分布的影响Fig.4 Effect of the HPH treatment on particle size distributionof MP water suspension with different concentrations
2.4 HPH处理对不同浓度MP水悬液流变特性的影响
MP水悬液的表观粘度如图5所示。结果表明,随着剪切速率的增加,所有处理组的表观粘度下降,呈现假塑性流体特征。经过HPH处理后,不同浓度样品的粘度都较未处理之前有所下降,这与Chen等[13]和钟俊桢等[20]的研究结果相符。5 mg/mL的处理组具有最低的粘度,与未处理之前相比,表观粘度下降最为明显;而15 mg/mL的处理组经过HPH处理后粘度变化幅度不大,同时随着剪切速率的增加,表观粘度逐渐与未处理的样品接近。研究表明,蛋白分散体的流动行为可以受颗粒尺寸和尺寸分布以及颗粒形状和颗粒变形性的影响[33-35],在未处理的样品中具有高粘度、完整的肌原纤维蛋白片段,其中大的蛋白颗粒与大分子相互纠缠,增加了溶液流动的阻力[13]。在本研究中,5 mg/mL的MP水悬液经过HPH处理后粒径最小,说明大部分蛋白结构都被破坏,具有较小的蛋白颗粒,所以表观粘度较低,流动性较好。然而,在较高浓度(10、15 mg/mL)的MP水悬液中还存在着许多较大的、未被破坏的完整的肌原纤维蛋白片段以及蛋白质聚集体,这会导致粒径的增加以及颗粒尺寸的分布不均,从而影响其流动能力。

图5 HPH处理对不同浓度MP水悬液流变特性的影响Fig.5 Effect of HPH treatment on rheological properties ofMP water suspension with different concentrations
2.5 HPH处理对不同浓度MP水悬液表面疏水性的影响
MP水悬液表面疏水性的变化如图6所示。未经HPH处理的样品之间的表面疏水性没有明显区别,疏水基团含量较少。经过HPH处理后,不同浓度的MP水悬液的表面疏水基团明显增加,其中处理后的15 mg/mL样品表面疏水基团明显少于5、10 mg/mL的样品,并且5、10 mg/mL样品之间差别不明显。在HPH处理之前,疏水基团大多数紧密包埋在球状区域内,与荧光探针的接触受到抑制[32,36],导致疏水含量较低。在HPH处理的过程中,MP受到高静压、剪切力、碰撞等机械力作用,蛋白质发生去折叠现象,部分二硫键的产生被抑制,促进了蛋白质结构的展开,疏水基团暴露并且相互作用,从而导致表面疏水性的提高[29,31,37]。随着浓度增加到15 mg/mL时,可能由于HPH处理过程中高浓度蛋白溶液中蛋白质更易发生聚集[37],使粒径增大,同时这种聚集阻止了疏水基团的暴露,导致与5、10 mg/mL的样品相比,疏水性较低。但是由图3的结果发现,10、15 mg/mL的平均粒径没有显著差异,这可能是因为浓度提高时,大部分疏水基团都包埋在了蛋白质分子之间,使疏水性较低。而5 mg/mL的样品由于其粒径较小,水悬液内部的颗粒分散更加均匀,HPH处理的强剪切力对蛋白质内部隐藏的疏水基团进行切割,更多的疏水基团暴露出来,导致疏水性增加明显[32,41],蛋白质表面电荷发生改变,使水化作用增强,从而提高其溶解性[18,39]。

图6 HPH处理对不同浓度MP水悬液表面疏水性的影响Fig.6 Effect of HPH treatment on surface hydrophobicity ofMP water suspension with different concentrations
2.6 HPH处理对不同浓度MP水悬液活性巯基含量的影响
巯基是MP中重要的功能基团,其含量变化反映了MP蛋白结构的改变[18]。MP水悬液的活性巯基含量变化如图7所示。经过HPH处理后,不同浓度MP水悬液的活性巯基含量均显著性增加(P<0.05),其中,5 mg/mL处理组的活性巯基含量(11.73 μmol/100 mg)显著低于其他处理组(P<0.05),并且处理组的巯基含量随着MP浓度的增加而增加。有研究表明,HPH处理时产生的剧烈机械作用会造成蛋白质结构的改变以及蛋白质的变性[40],同时,蛋白质分子展开后可能会诱导巯基以及疏水基团从蛋白质分子内部暴露出来,使活性巯基含量增加。当MP水悬液浓度较低时,蛋白质展开变得松散,蛋白质的表面积与体积之比增加,表面电荷分布增强,水化作用增强,因此增加了蛋白质的溶解性[41];同时,由于蛋白颗粒新形成的界面在热力学上不稳定,导致巯基基团发生重折叠,使其包埋在蛋白质分子内部,随后二硫键的断裂和巯基的氧化、包埋形成对立面,使巯基的氧化和包埋占主导[22],所以MP浓度较低时,活性巯基含量较少。

图7 HPH处理对不同浓度MP水悬液活性巯基含量的影响Fig.7 Effect of HPH treatment on active sulfhydryl content ofMP water suspension with different concentrations
2.7 圆二色谱(CD)分析
HPH处理对不同浓度MP水悬液的二级结构影响如表1所示。由表1可知,经过HPH处理后,所有处理组均呈现α-螺旋降低,β-折叠、β-转角和无规卷曲结构增加的现象,5 mg/mL样品的α-螺旋降低最为明显。据文献报道,HPH处理会诱导蛋白质部分结构的展开,且对结构改变起主导作用[17]。肌原纤维蛋白中α-螺旋的缺失可能导致分子间相互作用的变化,从而破坏蛋白组装过程,导致MP在水中的溶解度增加[25]。在本研究中,当蛋白浓度为5 mg/mL时,蛋白质之间的作用力较小,从而导致其结构更易于展开,使溶解度增加。随着浓度的提升,蛋白在HPH处理过程中受到的压力可能也会随之提高,而据研究表明[38],均质压力提升会导致蛋白质之间相互作用加强,同时在疏水作用下,一部分蛋白质重新聚集、组装,α-螺旋也会随之增加。同时β-转角被认为是蛋白分子排列有序的产物[38],说明经过HPH处理后,MP在水中的均匀性以及蛋白构象稳定性有所提升,而本研究中,经过HPH处理后所有样品的β-转角都有明显提升,与相关研究结果一致。

表1 圆二色谱分析MP水悬液的二级结构组成Fig.1 Analysis of the secondary structural compositions ofMP water suspension by circular dichroism
3 结论
本文通过HPH处理不同浓度MP水悬液,并对其理化特性以及蛋白结构进行测定,发现在一定的浓度范围内(5~15 mg/mL),HPH处理可以显著提高不同浓度MP在水中的溶解性(最高达到88.39%),并且随着浓度的增加,溶解效果呈现下降趋势;处理后的样品在4 ℃条件下放置9 d后仍然能保持最高79.08%的溶解度,具有较好的稳定性。同时,经过HPH处理的MP水悬液的分散性、流动能力等理化特性得到显著提升,蛋白二、三级结构被破坏,处理效果随着MP浓度的升高而下降。5 mg/mL的MP水悬液经过HPH处理后具有更好的水溶性,当浓度提高时,与5 mg/mL相比,10、15 mg/mL的MP水悬液的粒径有增大的趋势,造成样品流动能力下降,同时疏水性下降,活性巯基含量上升,α-螺旋结构增加,这可能与高浓度MP在HPH处理时容易产生蛋白质的聚集有关。因此,HPH处理对MP在水中溶解性的改善效果随着MP浓度的提高而降低,为新型低盐肉制品的开发提供了新的思路,但是要实现较高浓度的MP在水中的溶解,还仍需进一步研究。
