土茯苓黄酮与鲣鱼蛋白肽的交互作用研究
2019-11-12任娇艳李宇娟史传超李溢佳袁尔东
任娇艳 李宇娟 史传超 张 婷 李溢佳 袁尔东* 梁 明*
(1 华南理工大学食品科学与工程学院 广州 510640
2 无限极(中国)有限公司 广州 510665)
土茯苓,是百合科光叶菝葜(Smilax glabra Roxb.)的干燥根茎,其黄酮类成分具有明显的抗炎、镇痛和抗疲劳效果。研究表明,土茯苓提取物对XOD具有明显的抑制作用,可降低尿酸的生成,是临床上用于替代别嘌呤醇治疗高尿酸血症和痛风的潜在药物[1]。土茯苓抑制XOD活性的物质基础是表儿茶素、落新妇苷、槲皮素及柚皮素等。目前国内外对天然产物抗痛风药的研究发现,黄酮类可通过促进尿酸排泄,抑制XOD活性等多途径多靶点防治高尿酸血症[2]。
鲣鱼,属鲈形总目,鲣属,是一种海洋洄游鱼类,研究发现鲣鱼的胃蛋白水解物抗氧化活性高[3]。从鲣鱼中鉴定合成的多肽DLDLRKDLYAN具很强的ABTS自由基和单线态氧清除能力[4]。日本著名海洋生物科技公司YSK从鲣鱼肌肉中提取鹅肌肽和肌肽两种天然深海鱼低聚肽,发现其具有显著的降尿酸功效。鲣鱼小分子低聚肽与蛋白相比更容易被人体吸收利用[5]。报道发现,小分子肽与天然产物交互作用后,可提高其生物活性,如血清白蛋白可与某些药物分子通过相互作用将药物分子更有效地运输到靶器官[6-8]。因此,研究小分子多肽与中草药活性成分的交互作用具有重要的科学和实际应用意义。
本试验以土茯苓和鲣鱼为原料,制备土茯苓黄酮和鲣鱼蛋白肽,比较水提土茯苓和醇提土茯苓中活性成分的含量、DPPH·清除活性及XOD抑制活性,并以蛋白质回收率、DPPH·清除活性和XOD抑制活性为指标筛选鲣鱼酶解的水解酶。在此基础上,探讨土茯苓黄酮与鲣鱼蛋白肽交互作用产物的XOD抑制活性、DPPH·清除活性及其稳定性。最后,利用荧光光谱法研究土茯苓黄酮与鲣鱼蛋白肽交互作用的猝灭机理。研究对中草药活性成分与小分子活性肽的相互作用机理及降尿酸复合产品的研发,具有理论和实践指导意义。
1 材料与方法
1.1 材料与试剂
土茯苓,广州南北行中药饮片有限公司;鲣鱼,山东。
2,2-联苯基-1-苦基肼基(2,2-Diphenyl-1-picrylhydrazyl,DPPH)、黄嘌呤、黄嘌呤氧化酶、辣根过氧化物酶,美国Sigma公司;胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶,南宁庞博生物工程有限公司。
1.2 主要仪器及设备
UV754N紫外-可见光分光光度计,INESA上海仪电分析仪器有限公司;HYP-1020消化炉,上海书培实验设备有限公司;KDN-1型自动凯氏定氮仪,上海科晓科学仪器有限公司;日立荧光光谱仪,天美(中国)科学仪器有限公司广州分公司。
1.3 试验方法
1.3.1 土茯苓提取物的提取 将土茯苓干燥根茎用高速粉碎机粉碎,过60目筛后备用。采用两种溶剂制备土茯苓提取液。
(1)土茯苓水提:称取一定量土茯苓粉末,按料液比1∶20加入蒸馏水,浸泡6 h,80℃下超声30 min,4℃,8 000 r/min离心 20 min,提取 3次,合并滤液后蒸发浓缩至一定体积,冷冻干燥,保存。
(2)土茯苓醇提:称取一定量土茯苓粉末,按料液比1∶20加入60%乙醇溶液,浸泡6 h,80℃下超声提取 30 min,4℃,8 000 r/min离心 20 min,提取3次,合并滤液后蒸发浓缩至一定体积,冷冻干燥,保存。
1.3.2 土茯苓提取物活性成分测定 参照文献[9-10]亚硝酸钠-氯化铝比色法和苯酚-硫酸法,稍作修改。分别测定提取物中总黄酮和总多糖含量。将提取物溶液与3倍体积的无水乙醇混合均匀,于4℃冰箱过夜醇沉,再经4℃,8 000 r/min离心20 min,收集滤液,旋转蒸发后,冷冻干燥得到土茯苓黄酮。
1.3.3 鲣鱼蛋白肽水解酶筛选 将完整的鲣鱼搅碎成鱼糜,称取一定质量的鲣鱼鱼糜,按照料液比1∶3加入蒸馏水,沸水浴5 min预处理灭酶,按加酶量(E/S)1%分别加入4种水解酶(中性蛋白酶、碱性蛋白酶、木瓜蛋白酶和胰酶),酶解温度为55℃,酶解pH 7.0,酶解4 h后,沸水浴10 min灭酶,在4℃,8 000 r/min离心20 min后过滤,蒸发浓缩后冷冻干燥,得到鲣鱼蛋白肽。
1.3.4 蛋白质回收率的测定 采用凯氏定氮法(GB/T 5009.5-2003)测定总氮含量,按照公式(1)计算其蛋白质回收率(Nitrogen recovery,NR)。

1.3.5 XOD抑制活性测定 抑制XOD活性是降低尿酸生成的有效途径,常用于评价药物的体外降尿酸活性[11-13]。黄嘌呤氧化酶(XOD)将黄嘌呤催化氧化成尿酸和H2O2,H2O2再经过辣根氧化物酶(HRP)作用分解,可使4-氨基安替比林与苯酚形成亚醌类红色化合物,其反应原理式(2)、(3)。

参照双酶偶联法[14],并稍作修改。分别取100 μL pH 8.0 Tris-HCl缓冲液和待测样品于10 mL离心管,加入 50 μL 0.52 U/mL的XOD,37℃保温10 min,加入 2.9 mL显色液和400 μL 2 mmol/L黄嘌呤溶液,37℃保温20 min。反应结束后,加入50 μL 1 mol/L NaOH溶液灭酶,同时做3个平行试验,508 nm波长处测定相应的吸光值(As)。以不加XOD反应体系作为参比,Tris-HCl缓冲液为空白对照(A0)。 按照公式(4)计算XOD抑制率。

1.3.6 DPPH·清除活性测定 参照文献 [15-16],用DPPH·清除率的IC50值来表征提取物的抗氧化活性。取2 mL样品与2 mL DPPH·溶液混合均匀,室温下避光反应30 min后,于517 nm波长下测相应的吸光值,记为A样。以2 mL蒸馏水与2 mL DPPH·溶液做空白对照,记为A0,2 mL蒸馏水与95%乙醇混合溶液做参比。按照公式(5)计算DPPH·清除率。
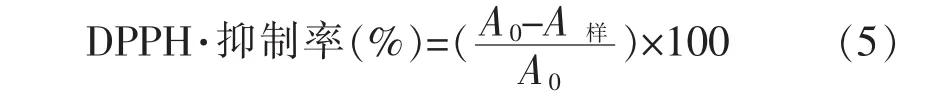
1.3.7 交互作用体系建立及活性评价 根据土茯苓黄酮和鲣鱼蛋白肽的XOD抑制活性,将17 μg/mL土茯苓黄酮和11 mg/mL鲣鱼蛋白肽进行复配,比较交互作用后与两者分别测得XOD抑制活性之间的差异。
同时依据土茯苓黄酮和鲣鱼蛋白肽的DPPH·清除活性,将2 mg/mL鲣鱼蛋白肽与不同质量浓度土茯苓黄酮(5,7,9,11 μg/mL)进行复配,并测定相应的DPPH·清除活性。筛选DPPH·清除活性最好的复合物,进一步研究其抗氧化活性的稳定性:
(1)温度的影响:根据工艺生产杀菌技术,研究了3个温度条件(常温:25℃,1 h;巴士杀菌:62~65℃,30 min;高温长时灭菌:121℃,20 min)下DPPH·清除活性的变化。
(2)pH值的影响:根据多肽和中草药液体产品的酸度值,研究了 3 个 pH 值(5.5,6.0,6.5)条件下产物的DPPH·清除活性。
1.3.8 荧光光谱分析法 参照文献[17-19]方法检测样品的荧光吸收光谱,并稍作修改。用pH 7.40 Tris-HCl缓冲溶液将样品配制成不同质量浓度的溶液,在25℃反应1 h后,在280 nm波长处激发,测定溶液在295~500 nm波长处的荧光吸收光谱。
(1)质量浓度对鲣鱼蛋白肽荧光吸收光谱的影响:用Tris-HCl缓冲溶液将鲣鱼蛋白肽配制成蛋白质量浓度分别为10,15,20,25,30 μg/mL的溶液,并测定相应的荧光吸收强度。
(2)土茯苓黄酮对鲣鱼蛋白肽荧光吸收光谱的影响:用Tris-HCl缓冲溶液将土茯苓黄酮配制成质量浓度为10,20,40,80,160 μg/mL的溶液,分别与25 μg/mL鲣鱼蛋白肽复配,测定相应的荧光吸收强度。
(3)温度对交互作用产物荧光吸收强度的影响将复合物置于不同温度(25,37℃)下反应1 h后,测定其荧光吸收强度。
1.3.9 数据分析 所有数据均采用SPSS 19.0软件分析,以P<0.05为显著性评定指标,数据用±SD表示,试验数据采用Graph prism和Origin 2017制图。
2 结果与分析
2.1 土茯苓黄酮提取物的筛选及活性评价
由图1a可知,提取物的多糖提取率间无显著性差异,而醇提物的黄酮提取率显著高于水提物(P<0.01)。由图1b和1c可知,醇提物的DPPH·清除率IC50值显著低于水提物,且随质量浓度增加其XOD抑制活性升高,而水提物几乎无XOD抑制活性。其原因可能是水提与醇提所得黄酮类物质种类组成不同,且醇提物中含有部分醇溶性黄酮,表现出更好的DPPH·清除活性和XOD抑制活性。因此,用醇提土茯苓黄酮做进一步交互作用研究。
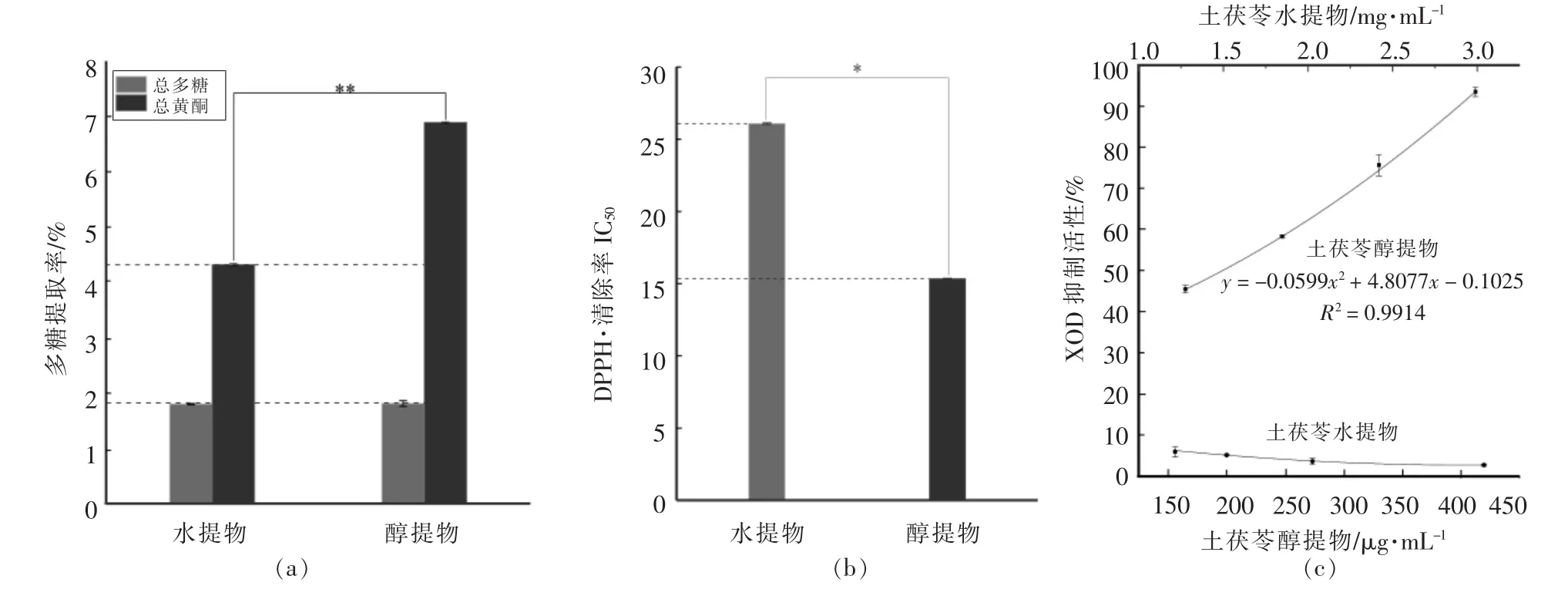
图1 不同提取物的多糖和黄酮提取率(a)、DPPH·清除率IC50值(b)和XOD抑制活性(c)Fig.1 The extract rate of polysaccharide and flavonoids from different extracts(a),DPPH· scanvenging rate IC50values(b)and XOD inhibition activities(c)
2.2 鲣鱼蛋白肽的筛选及活性评价
由图2a可知,木瓜蛋白酶酶解液的蛋白回收率显著高于其它水解酶酶解液(P<0.05),且其XOD抑制活性最高为33.54%。由图2b可知,木瓜蛋白酶的DPPH·清除率IC50值最小,活性显著高于其它各水解酶(P<0.01)。木瓜蛋白酶属巯基蛋白酶,其酶切位点为精氨酸和赖氨酸的羧基端,N-端具有2个羧基的氨基酸和芳香L-氨基酸的肽键。
由图2c木瓜蛋白酶酶解液的氨基酸含量分布可知,其中具有2个羧基的天冬氨酸、谷氨酸的百分含量最高,精氨酸和赖氨酸的含量也相对较高,且木瓜蛋白酶蛋白质回收率最高,说明其酶解液中多肽的种类和数量较其它酶解液多。同时,酶解液中含有9.33%的脯氨酸,不仅疏水性强,可形成疏水相互作用,其吡咯烷结构可通过氢键与酚羟基结合[19],因此木瓜蛋白酶酶解所得鲣鱼蛋白肽活性最高。
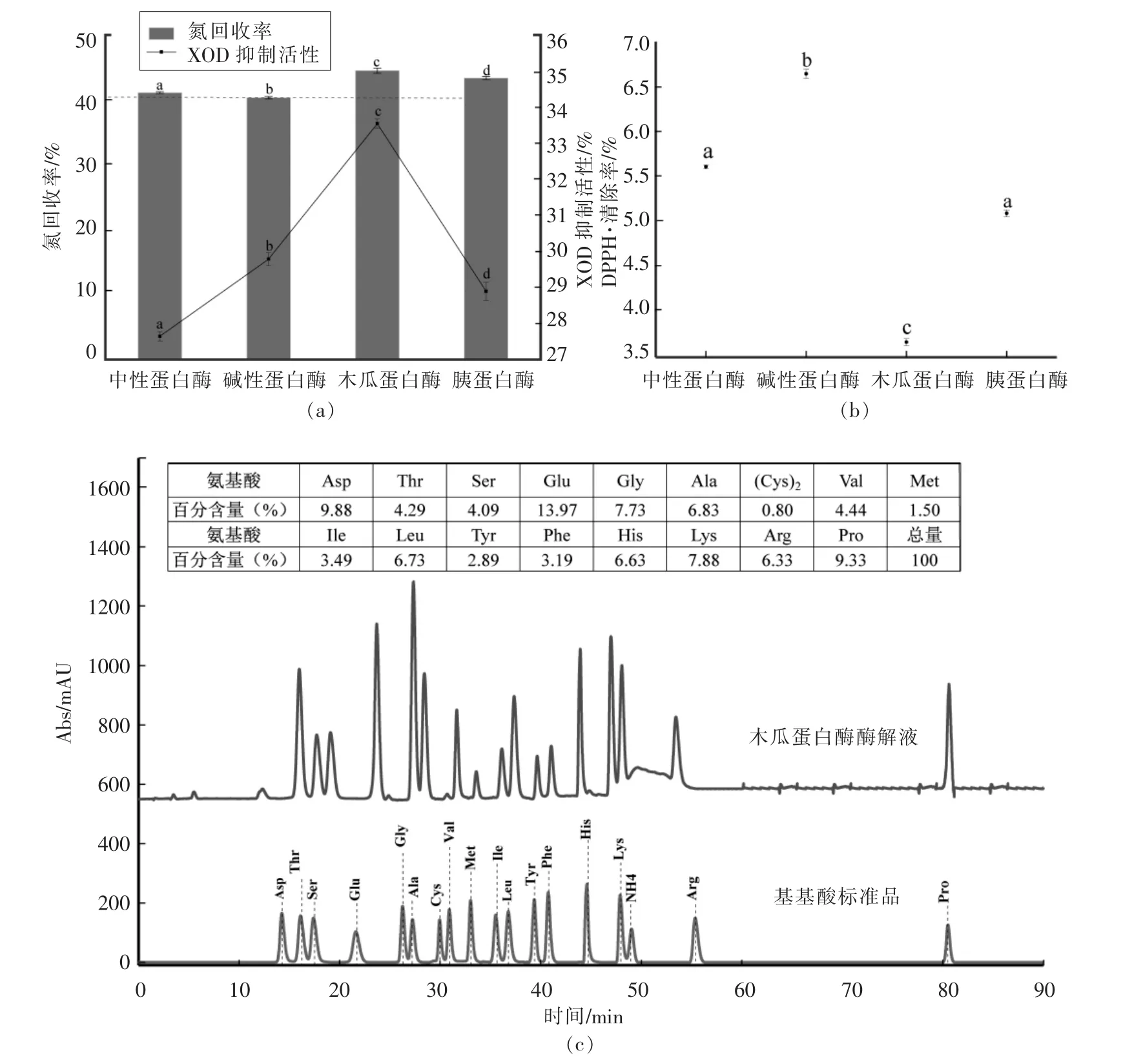
图2 不同水解酶酶解液的蛋白回收率与蛋白质质量浓度为30 mg/mL时XOD抑制活性(a)、DPPH·清除率IC50值(b)和木瓜蛋白酶酶解液总氨基酸图谱(c)Fig.2 Protein recovery rates and XOD inhibition activities at 30 mg/mL(a),DPPH· scavenging rate IC50 values(b)and amino acid analysis of papain protease solution(c)
2.3 交互作用产物活性评价
2.3.1 交互作用产物XOD抑制活性 从图3可知,17 μg/mL土茯苓黄酮和11 mg/mL鲣鱼蛋白肽XOD抑制率相当,说明土茯苓黄酮的XOD抑制活性高于鲣鱼蛋白肽,交互作用后XOD抑制率(47.35%)比黄酮和多肽分别测得XOD活性显著升高(P<0.05),说明交互作用有助于提升XOD抑制活性。由于低质量浓度下,土茯苓黄酮和鲣鱼蛋白肽具有很高的DPPH·清除活性,且双酶偶联法所用XOD质量浓度高。因此,以DPPH·清除活性做进一步交互作用的研究。
2.3.2 交互作用产物DPPH·清除活性 由图4可知,5 μg/mL土茯苓黄酮与2 mg/mL鲣鱼蛋白肽的活性相当,说明黄酮的DPPH·清除活性明显优于多肽;在土茯苓黄酮质量浓度小于9 μg/mL时,质量浓度增加其与鲣鱼蛋白肽交互作用后所得产物的活性显著高于两者所测得活性的数值总和(P<0.05),说明交互作用有助于提高DPPH·清除活性。当土茯苓黄酮质量浓度达到11 μg/mL时,交互作用后产物的活性与两者所测得活性的数值总和之间无显著性差异,原因是酚羟基在高质量浓度下与肽链间的结合方式发生改变[20],从而引起活性的变化。
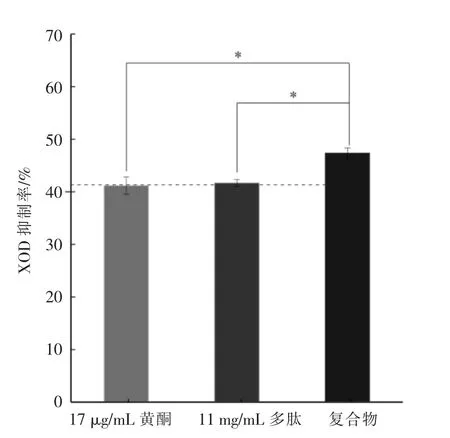
图3 交互作用后XOD抑制活性Fig.3 XOD inhibition activities of flavonoids-peptide complexes
2.3.3 交互作用产物抗氧化稳定性 由图5a可知,两者交互作用后活性显著升高(P<0.01),多肽、黄酮及交互作用产物在巴氏杀菌条件下相对稳定,然而对高温敏感,121℃加热有助于提高多肽活性,而黄酮和交互作用产物高温处理后活性显著降低(P<0.05),这是因为高温使多肽链受热延展,内部疏水基团暴露,活性增强,而黄酮中酚羟基可能被氧化,导致活性降低。
因此,普通巴氏杀菌不会影响产品的抗氧化活性,高温长时灭菌虽会影响产品抗氧化活性,但其活性仍处于较高水平。工业生产时,建议采用巴氏杀菌保持产品活性最高,为延长产品货架期也可采用高温长时灭菌。
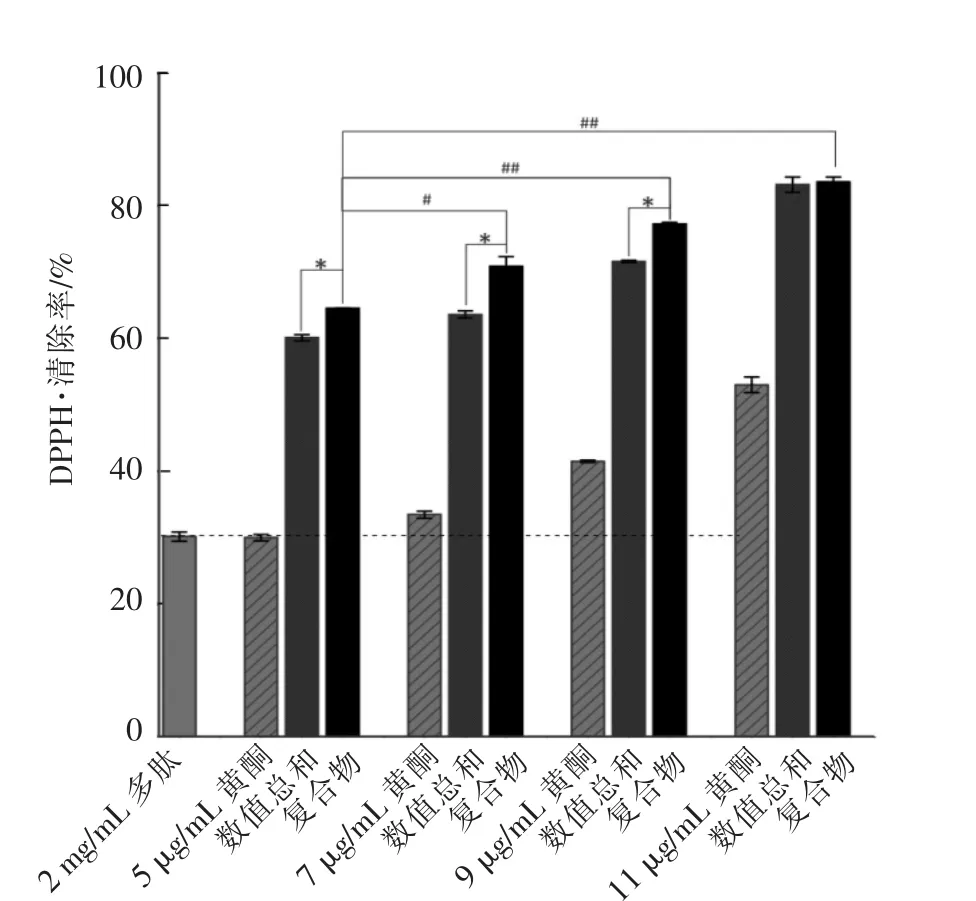
图4 交互作用后DPPH·清除活性Fig.4 DPPH·scanvenging activities of flavonoids-peptide complexes
由图5b可知,交互作用后活性显著升高(P<0.01),多肽对pH敏感,pH升高活性降低,在pH 6.5时活性显著下降(P<0.05);与此不同的是,黄酮和交互作用产物随温度变化活性先升后降,pH 6.0时活性最高,因此通过控制产品pH值为6.0使其抗氧化活性达到最高。
2.4 土茯苓黄酮提取物与鲣鱼蛋白肽交互作用
按照1.3.8节方法分别测定了298 K和310 K条件下,土茯苓黄酮提取物(Flavonoids)对鲣鱼蛋白肽(BPH)的荧光猝灭光谱如图6所示。
由图6b可知,鲣鱼蛋白肽在350 nm波长处荧光吸收光谱,且作为荧光供能体使图6a中Tris-HCl吸收峰值增大,然而未改变其出峰位置和峰形。
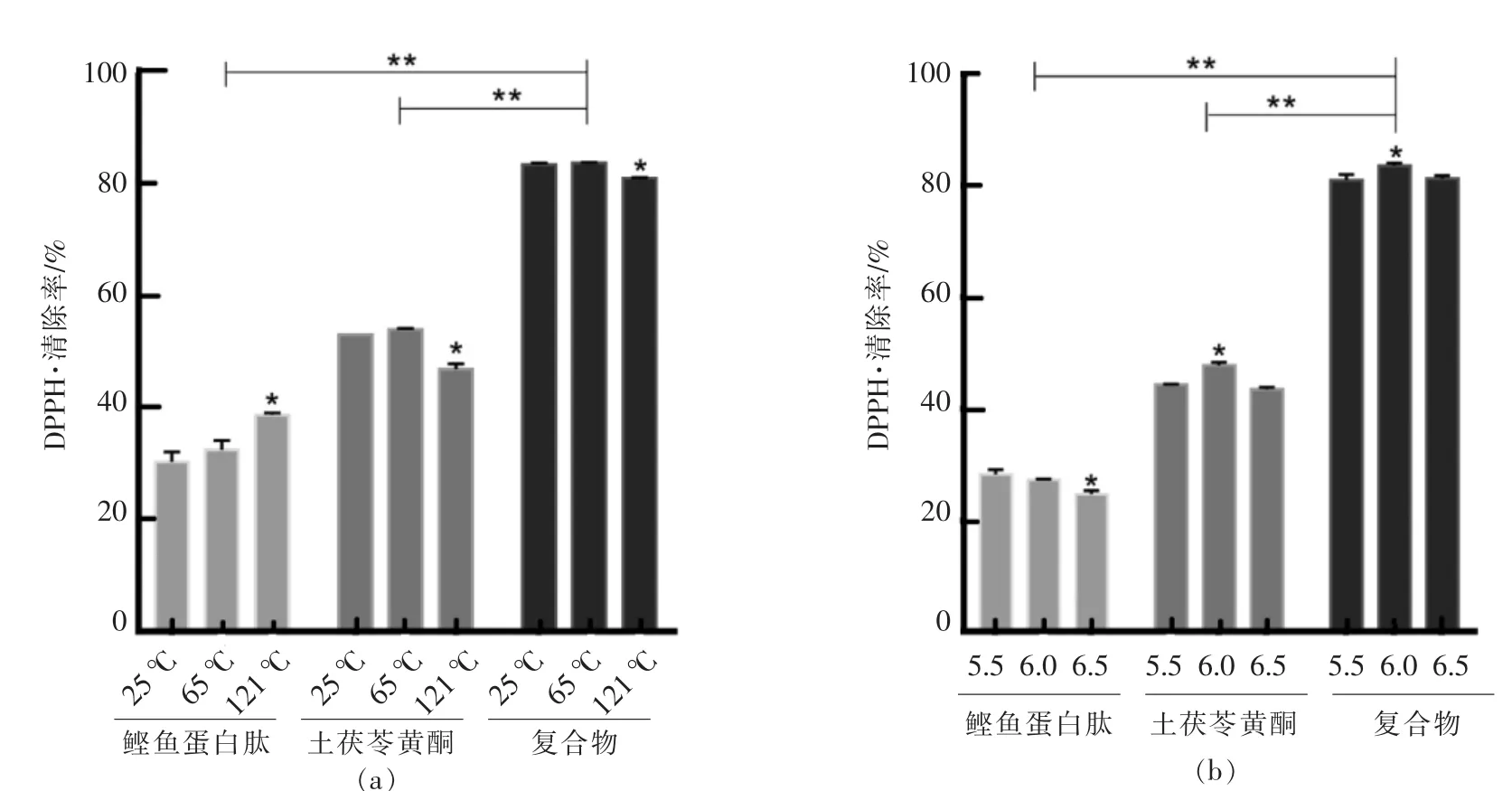
图5 温度(a)和pH(b)对DPPH·清除活性的影响Fig.5 The influence of temperature(a)and pH(b)on DPPH· scavenging activity
由图6c和6d可知,土茯苓黄酮在350 nm波长处具有荧光吸收,说明黄酮中含有少量蛋白,且在460 nm波长处本身具有吸收峰;质量浓度低于160 μg/mL时,荧光吸收强度与质量浓度之间成剂量依赖关系,而质量浓度为160 μg/mL时,350 nm波长处的荧光吸收峰红移且强度增大,原因可能是浓度升高,蛋白质聚集或与黄酮类物质形成聚合物,苯环上取代基发生变化导致吸收峰红移。
由图6e可知,在质量浓度低于20 μg/mL时,黄酮对多肽的光猝灭效果不明显;与此不同的是,质量浓度高于40 μg/mL时猝灭效果显著,且吸收峰红移。蛋白质和多肽在350 nm波长处的荧光发射基团主要是色氨酸[21],低质量浓度的黄酮能与多肽结合的分子数目少,当其猝灭强度与提取物中蛋白质荧光吸收强度相当时,导致无荧光猝灭;高质量浓度黄酮分子数目多,使其猝灭强度超过自身蛋白荧光吸收强度,且与多肽链的结合方式也有所不同,色氨酸中苯环的取代基基团和位置变化,吸收峰红移。

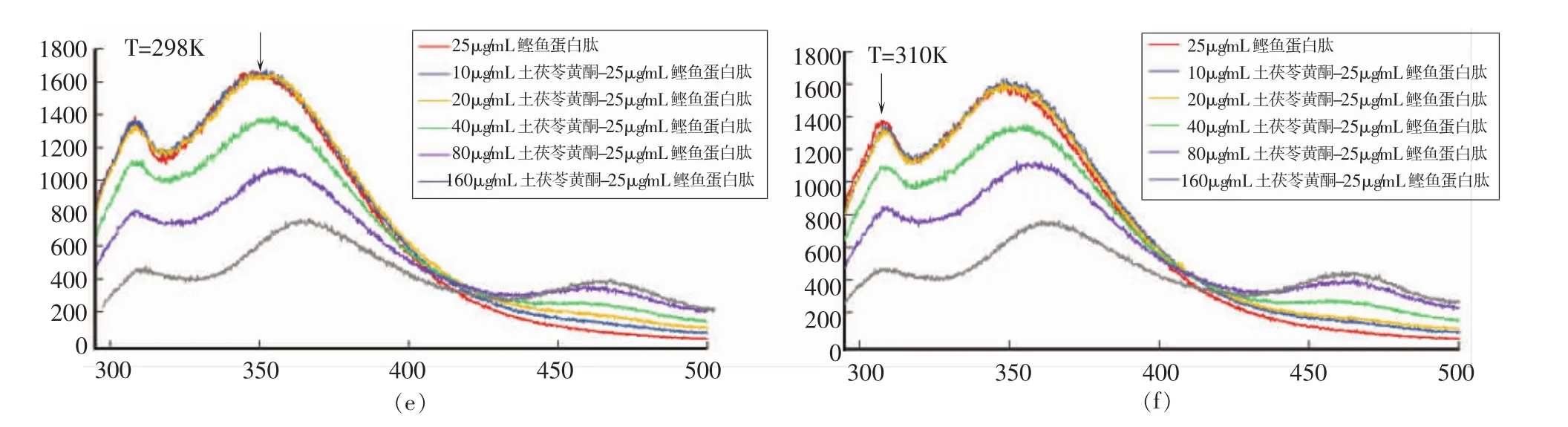
图6 Tris-HCl荧光吸收光谱(a);不同浓度鲣鱼蛋白肽荧光吸收光谱(b);土茯苓黄酮荧光吸收光谱(c)和(d);交互作用产物荧光吸收光谱(e)和(f)Fig.6 The fluorescence absorption spectrum of Tris-HCl(a);The fluorescence absorption spectrum of different concentrations of bonito protein peptide(b);The fluorescence absorption spectrum of flavonoids(c)and flavonoids-peptide(e)and(f)
由图6f可知,温度变化并未引起交互作用产物吸收峰值和峰形的变化,因此黄酮对多肽的猝灭为静态猝灭,说明交互作用可能形成了新的复合物。结合氨基酸分析,多肽的脯氨酸可能与黄酮中的酚羟基通过氢键结合或与疏水性的芳香基团产生疏水相互作用聚集,且交互作用在高温下活性显著降低,说明土茯苓黄酮与鲣鱼蛋白肽可能通过氢键结合成新产物。
3 结论
醇提土茯苓黄酮提取率及化学活性显著高于水提土茯苓黄酮,木瓜蛋白酶酶解液蛋白质回收率高且活性强。两者交互作用后XOD抑制活性显著升高(P<0.05),DPPH·清除活性出现协同增效效果。高温121℃加热20 min使交互作用产物DPPH·清除活性显著降低(P<0.05),且 pH 6.0时其活性最佳。土茯苓黄酮对鲣鱼蛋白肽具有显著的静态猝灭。荧光光谱法和氨基酸分析表明,土茯苓黄酮与鲣鱼蛋白肽之间可能通过氢键形成了新的复合物,使其XOD抑制活性和DPPH·清除活性升高,这为中草药与多肽复合产品的生产和研究提供了科学依据。
