牵张应力刺激下Erk1/2在人牙周膜细胞成骨化的作用分析
2019-11-04
(武汉科技大学附属汉阳医院口腔科,湖北 武汉 430050)
随着我国社会经济快速发展,居民生活水平和医疗水平的不断提升,平均寿命明显增加;统计学显示,在2000年我国已进入老龄化社会,2010年我国60岁及以上的老年人口数已超过1.8亿,占总人口数的10.6%,位居世界首位。传统观点中口腔正畸治疗多适用于12~18岁青少年,在中老年人群中开展较少。但有学者研究认为,年龄不是决定能否进行口腔正畸的主要因素,人牙周膜细胞成骨化活性起决定性作用。口腔正畸治疗中在机械力刺激下能够引发牙周组织改建,最终牙齿移位达到矫治目的。人牙周膜细胞在正畸牙移动过程中发挥重要的生理介质活性,能够通过细胞增殖和分化反应机械力刺激,表达成骨相关因子。
牙周膜是连接牙齿与牙槽骨的结缔组织,能够将牙齿受力传至牙槽骨,在牙周组织改建中发挥重要作用[1]。人牙周膜细胞是牙周膜的主要成分,可将机械力信号转化为生物信号[2]。研究者发现,在牵张应力、挤压应力等刺激能够上调牙周膜细胞中碱性磷酸酶(alkaline phosphatase,ALP)、OCN等成骨相关基因的表达[3]。Runt相关基因2是成骨细胞特异性转录因子,介导骨形成与骨重建,可通过特有的结构域与下游靶基因结合,激活转录,上调成骨细胞表型分化和干细胞向成骨细胞特异性分化[4]。细胞外调节蛋白激酶(Erk)1/2属于MAPKs超家族,在细胞增殖、凋亡等多种生物学行为中发挥调控作用[5]。相关研究显示,Erk1/2、Runt相关基因2为力学信号的靶点[6],但关于其在人牙周膜细胞成骨化中的作用仍鲜有研究报道。本研究在体外使用周期性牵张应力刺激牙周膜细胞来模拟口腔中牙周膜所受的咬合力,检测牙周膜细胞中Erk1/2及成骨相关基因表达情况,探讨牵张应力刺激下Erk1/2在人牙周膜细胞成骨化中的作用机制。
1 材料与方法
1.1 材料与试剂
收集2018年1月至12月间在本院行口腔正畸治疗拔除的健康前磨牙,用于原代培养人牙周膜细胞,患者年龄10~16岁,均签署知情同意书。主要试剂:胎牛血清、α-MEM培养基、胰蛋白酶购于北京裕恒丰科技有限公司;ERK1/2通路抑制剂PD98059购于上海翊圣生物科技有限公司;ERK1/2显性负性突变体构建与鉴定由上海捷瑞生物工程有限公司完成;鼠抗人ERK1/2、p-ERK1/2单克隆抗体,鼠抗人Runt相关基因2单克隆抗体购于上海百力格生物技术有限公司。
1.2 方法
1.2.1 人牙周膜细胞培养与模型构建 采用组织块法和消化法原代培养人牙周膜细胞,培养基使用含10%胎牛血清、青霉素及链霉素的α-MEM培养基,收集第5代细胞,免疫组化法检测Vimentin、角蛋白表达,鉴定细胞来源。胰蛋白酶消化第5代细胞,细胞计数后按1×106/mL接种于FlexcellBioFlex细胞培养板,37 ℃、5%CO2常规培养24~48 h,光学显微镜下观察细胞融合度超过80%时,将培养基中胎牛血清浓度更换为3%,继续培养24天。将细胞分为牵张应力组、对照组,牵张应力组使用FX-5000 T应力加载系统分别刺激细胞1、3、6、12、24 h,振幅10%、频率0.5 Hz,每个循环中松弛和拉伸时间各1 s;对照组在相同系统中培养,但不给予牵张应力刺激。
1.2.2 ERK1/2通路抑制剂PD98059处理 取第5代人牙周膜细胞按1×106/mL接种于6孔板中,分为3组:对照组仅使用含二甲基亚砜的α-MEM培养基常规培养,不加牵张应力;牵张应力组使用含二甲基亚砜的α-MEM培养基培养1 h后,通过应力加载系统刺激细胞3 h;ERK1/2通路抑制剂组先将PD98059溶于二甲基亚砜,配置100 mmol/L的PD98059储备液,加入α-MEM培养基中使其终浓度为20 μmol/L,培养1 h后,通过应力加载系统刺激细胞3 h。
1.2.3 ERK1/2显性负性突变体转染 取第5代人牙周膜细胞按1×106/mL接种于6孔板中,分为3组:对照组使用α-MEM培养基常规培养;空载体转染组、ERK1/2显性负性突变体转染组分别取空载体、ERK1/2显性负性突变体慢病毒原液1 mL,按MOI值比例100加入细胞培养基中,常规培养12 h后更换培养基,之后每48 h更换1次培养基,7天后共聚焦显微镜下观察人牙周膜细胞转染情况。将转染成功后的空载体转染组、ERK1/2显性负性突变体转染组再各分2个亚组:牵张应力组(应力加载系统刺激细胞3 h)、静止组(不加牵张应力)。
1.2.4 RT-PCR检测 Trizol法提取人牙周膜细胞总RNA,逆转录得到cDNA。Runt相关基因2、ALP、OCN、β-actin引物序列由上海捷瑞生物工程有限公司设计合成。Runt相关基因2上游5′-AATTATCGCACGACGGTAAGC-3′,下游5′-ACCTACTTAGAC AAACCGCTG-3′;ALP上游5′-TCGCGGACCCAGA GAAGTGAT-3′,下游5′-AGC CGAAAGTCCTCCGGATA-3′;OCN上游5′-AAGACGTAACCGAGGTCACT G-3′,下游5′-TGTTGGAGAGGTTTA CCACCC-3′;内参β-actin上游5′-TGAGGCTGGA AGTGGAAGG-3′,下游5′-TTAGGGTAGTGGTAGAAGGT-3′。反应条件:94 ℃ 5 min,94 ℃ 30 s,56 ℃ 30 s,共40个循环,延伸72 ℃ 30 s。扩增产物行2%琼脂糖凝胶电泳,计算Runt相关基因2、ALP、OCN mRNA的相对表达量。
1.2.5 Western blot检测 人牙周膜细胞中加入RIPA裂解液,3 000 r/min离心20 min,收集上清BCA蛋白定量,目标蛋白行SDS-PAGE凝胶电泳,分离后的蛋白转膜至PVDF,5%脱脂奶粉室温下封闭1 h,滴加鼠抗人ERK1/2、p-ERK1/2单克隆抗体(1∶500),鼠抗人Runt相关基因2单克隆抗体(1∶1 000),鼠抗人β-actin单克隆抗体(1∶1 000),4 ℃过夜,滴加HRP标记的鼠抗人IgG(1∶2 000),室温静置2 h,ECL显色,暗室中显影、采集图像并分析各条带灰度值。
1.3 统计学分析
本研究使用SPSS20.0处理,研究资料以均数±标准差表示,进行t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 人牙周膜细胞鉴定
传代培养的人牙周膜细胞呈纺锤形或梭形,细胞核呈规则的卵圆形,具有成纤维细胞结构特点。免疫组化染色显示(图1),人牙周膜细胞中可见Vimentin阳性表达,角蛋白阴性表达,提示获取的细胞源自发育早期的中胚层。

图1 免疫组化检测人牙周膜细胞Vimentin和角蛋白表达A:传代培养的人牙周膜细胞(100×);B:Vimentin阳性表达(SP 200×);C:角蛋白阴性表达(SP 200×)
2.2 牵张应力刺激不同时间时各组ERK1/2、p-ERK1/2、Runt相关基因2蛋白表达
牵张应力刺激不同时间p-ERK1/2蛋白表达水平均明显提升(P<0.05),其中以刺激1、3 h时p-ERK1/2蛋白表达水平最高;ERK1/2蛋白表达水平在牵张应力刺激不同时间差异无统计学意义(P>0.05);牵张应力刺激3、6 h时Runt相关基因2蛋白表达水平明显提升(P<0.05),12 h时Runt相关基因2蛋白表达水平明显下降(P<0.05)。提示牵张应力刺激可激活人牙周膜细胞中的ERK1/2信号通路。见表1,图2。
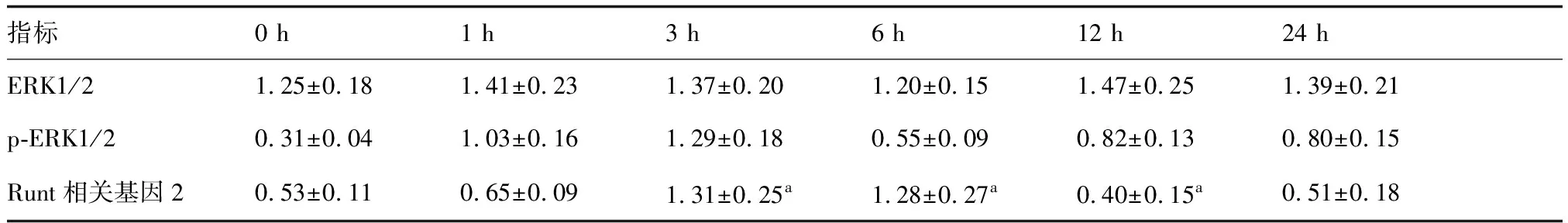
表1 牵张应力刺激不同时间ERK1/2、p-ERK1/2、Runt相关基因2蛋白表达
与0 h比较,aP<0.05(n=6)

图2 ERK1/2、p-ERK1/2、Runt相关基因2蛋白表达变化
2.3 ERK1/2通路抑制剂干预对人牙周膜细胞成骨分化相关基因表达的影响
牵张应力组Runt相关基因2、ALP、OCN mRNA相对表达量明显高于ERK1/2通路抑制剂组、对照组(P<0.05);Runt相关基因2、ALP、OCN mRNA相对表达量在ERK1/2通路抑制剂组与对照组之间差异无统计学意义(P>0.05);见表2。
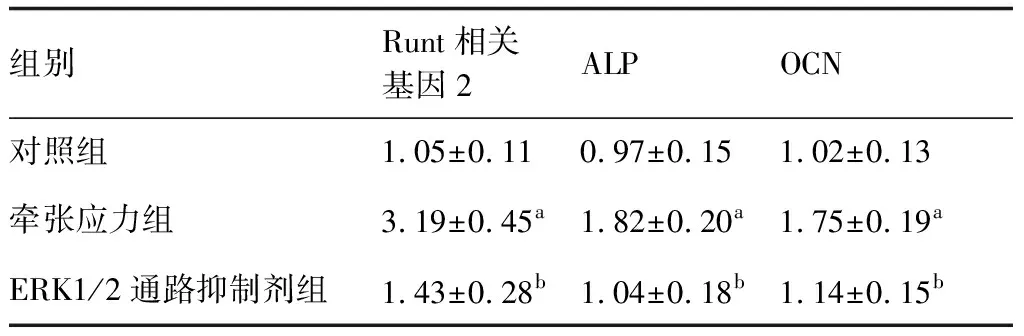
表2 三组人牙周膜细胞中Runt相关基因2、ALP、OCN mRNA相对表达量比较
与对照组比较,aP<0.05;与牵张应力组比较,bP<0.05(n=6)
2.4 ERK1/2通路抑制剂干预对ERK1/2、p-ERK1/2、Runt相关基因2蛋白表达的影响
牵张应力组p-ERK1/2、Runt相关基因2蛋白相对表达量明显高于ERK1/2通路抑制剂组与对照组(P<0.05);ERK1/2蛋白表达水平在三组间差异无统计学意义(P>0.05)。见表3,图3。
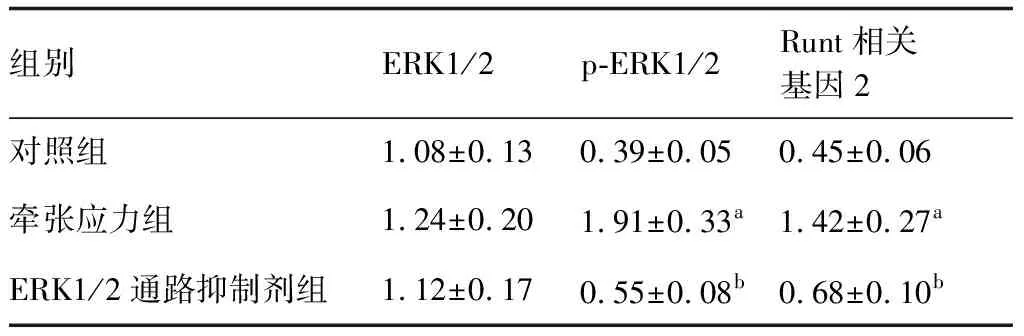
表3 人牙周膜细胞中ERK1/2、p-ERK1/2、Runt相关基因2蛋白相对表达量比较
与对照组比较,aP<0.05;与牵张应力组比较,bP<0.05(n=6)
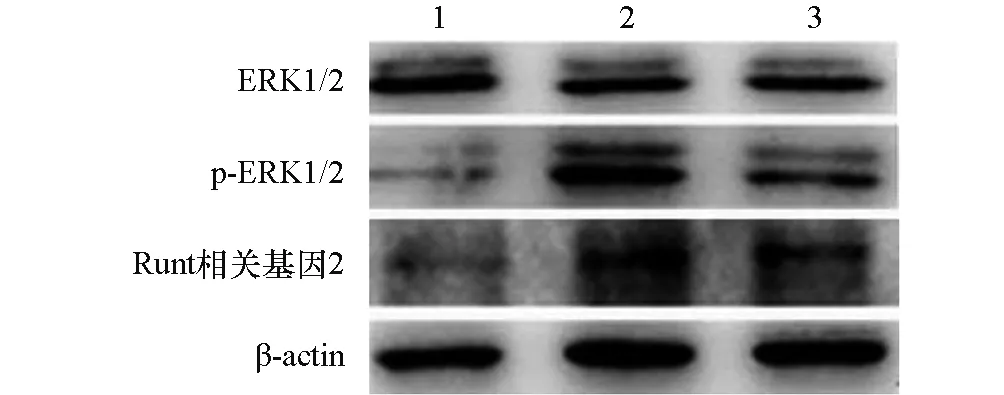
图3 各组ERK1/2、p-ERK1/2、Runt相关基因2蛋白表达的Western blot电泳图1:对照组;2:牵张应力组;3:ERK1/2通路抑制剂
2.5 牵张应力刺激对人牙周膜细胞成骨分化相关基因表达的影响
空载体转染牵张应力组Runt相关基因2、ALP、OCN mRNA相对表达量明显高于空载体转染静止组、突变体转染静止组、突变体转染牵张应力组(P<0.05);Runt相关基因2、ALP、OCN mRNA相对表达量在空载体转染静止组、突变体转染静止组、突变体转染牵张应力组之间差异无统计学意义(P>0.05);见表4。

表4 人牙周膜细胞中Runt相关基因2、ALP、OCN mRNA相对表达量比较
与空载体转染静止组比较,aP<0.05;与突变体转染静止组比较,bP<0.05;与空载体转染牵张应力组比较,cP<0.05(n=6)
2.6 牵张应力刺激对ERK1/2、p-ERK1/2、Runt相关基因2蛋白表达的影响
空载体转染牵张应力组p-ERK1/2、Runt相关基因2蛋白相对表达量明显高于空载体转染静止组、突变体转染静止组、突变体转染牵张应力组(P<0.05);ERK1/2蛋白表达水平在4组间差异无统计学意义(P>0.05)。见表5,图4。
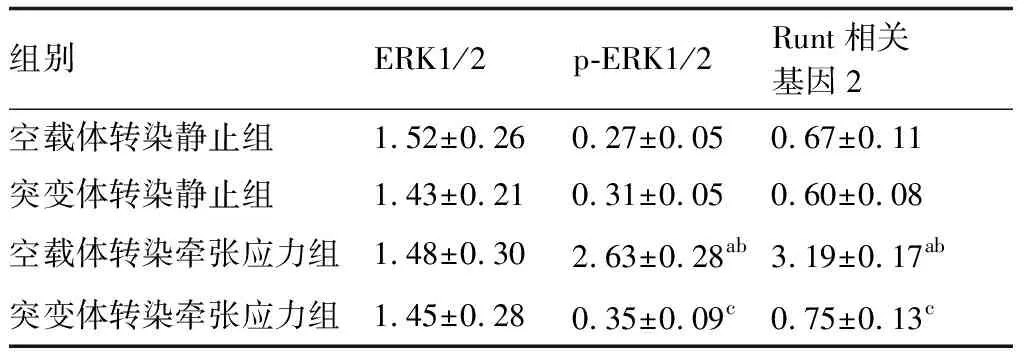
表5 人牙周膜细胞中ERK1/2、p-ERK1/2、Runt相关基因2蛋白相对表达量比较
与空载体转染静止组比较,aP<0.05;与突变体转染静止组比较,bP<0.05;与空载体转染牵张应力组比较,cP<0.05(n=6)

图4 各组ERK1/2、p-ERK1/2、Runt相关基因2蛋白表达变化1:空载体转染静止组;2:突变体转染静止组;3:空载体转染牵张应力组;4:突变体转染牵张应力组
3 讨 论
机械力刺激在牙周组织改建中发挥重要作用[7]。人牙周膜细胞具有成骨细胞表型特征,在一定条件下具有诱导矿化能力,能够形成矿化小结和矿化的胞外基质[8]。人牙周膜细胞是牙周膜的重要组成成分,可将外界机械力刺激信号转化为生物信号[9-10]。机械力刺激信号传导是目前研究热点之一,细胞感受力学信号主要通过以下途径:①细胞膜表面蛋白质在机械力刺激信号的作用下,空间构象发生改变,位于细胞膜表面的钙离子通道、黏附蛋白等被激活,出现级联反应,向下游逐级传递信号[11];②细胞骨架受机械力刺激信号的影响发生改变,导骨架中的张力重新分布,促使机械力信号向化学信号的转变[12]。目前研究认为,细胞种类与机械力刺激类型是细胞内传递力学信号方式的主要决定因素。
丝裂原活化蛋白激酶是分布于细胞质中,具有丝氨酸、酪氨酸磷酸化活性[13-14]。ERK1/2是丝裂原活化蛋白激酶的主要成员,在机械力刺激信号的传导过程中发挥重要作用[15]。相关研究显示,机械力刺激信号可经钙离子通道与整联蛋白途径活化ERK1/2信号通路,促进成骨细胞分化[16-17]。本研究显示,牵张应力组p-ERK1/2蛋白表达水平明显高于对照组,以应力加载系统刺激1、3 h时最为明显;提示人牙周膜细胞在牵张应力刺激下ERK1/2信号通路被激活。
为进一步探讨ERK1/2表达对人牙周膜细胞成骨分化的影响,本研究分别使用ERK1/2通路抑制剂PD98059、ERK1/2显性负性突变体转染来抑制ERK1/2信号通路活化。结果显示,牵张应力组成骨细胞表型基因ALP、OCN mRNA表达水平明显高于对照组,提示机械力刺激能够继发人牙周膜细胞成骨分化的潜力。使用PD98059阻断后,ALP、OCN mRNA表达水平明显下调;且ERK1/2显性负性突变体转染也明显阻断了ALP、OCN mRNA表达在牵张应力刺激下的升高;提示ERK1/2信号通路活化介导了牵张应力刺激下人牙周膜细胞的成骨分化。Runt相关基因2是骨发育和改建的主要调节基因,在间充质细胞向成骨细胞分化中发挥重要作用,且能够抑制充质细胞向软骨细胞分化[18-20]。研究者发现,具有成骨样特征的人牙周膜细胞中Runt相关基因2是机械力刺激信号的靶蛋白,当受到机械力刺激时可上调Runt相关基因2的表达[21]。本研究显示,Runt相关基因2表达水平在应力加载系统刺激1 h时即出现升高,在刺激3 h时达到峰值。给予PD98059阻断剂和ERK1/2显性负性突变体转染后,Runt相关基因2表达水平明显下降,提示ERK1/2信号通路参与了Runt相关基因2的调控过程。
综上所述,在应力加载系统刺激下,人牙周膜细胞的成骨分化过程中可通过激活ERK1/2信号通路,上调Runt相关基因2表达,同时促使Runt相关基因2与成骨基因ALP、OCN上的启动子集合,激活转录过程。但本实验是在体外使用周期性牵张应力刺激牙周膜细胞来模拟口腔中牙周膜所受的咬合力,易受到牵张力强度、温度等多种因素的影响,在今后的研究中应进一步排除外界干扰因素进行深入研究。
