黄酮类化合物干预糖尿病视网膜病变的研究进展
2019-10-30黄永杰李大鹏
黄永杰,李 锋,李大鹏*
(山东农业大学食品科学与工程学院,山东省高校食品加工技术与质量控制重点实验室,山东 泰安 271018)
糖尿病血管并发症具有发病率高和致死率高的特点,糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病众多并发症中最常见的微血管并发症。截至2015年,全球范围内大约有4亿 人患有糖尿病,其中超过45%的人患有DR[1]。DR是一种时间依赖性疾病,其发病率随糖尿病病程的延长而升高,几乎所有病程20 年的I型糖尿病患者和80%接受胰岛素治疗及50%不需要胰岛素治疗的II型糖尿病患者都会有不同程度的视网膜病变[2]。在欧美发达国家,DR已成为20~74 岁成年人失明的主要原因[3],现在这种趋势已经蔓延到发展中国家。DR因其高发病率、高致盲率的特点受到了广泛关注。研究表明,高血糖诱导机体活性氧(reactive oxygen species,ROS)水平的升高进而诱导氧化应激生物过程的发生。在眼部,氧化应激可以导致细胞非正常死亡,最终引起组织损伤,导致DR的发生。因此,抑制ROS的过量产生可能在控制DR中起关键作用[4-7]。
黄酮类化合物主要存在于水果、蔬菜和谷物等植物膳食中,是植物产生的次级代谢产物,可以保护机体免受紫外线、氧化剂以及病原体的侵害[8]。黄酮类化合物具有两个芳香环(A环和B环)的共同结构,通过形成含氧杂环(C环)的三碳链连接在一起。根据C环的通用结构以及C环的氧化和官能团不同,可以将其分为黄酮、黄酮醇、黄烷酮、黄烷醇、花青素、异黄酮以及二氢黄酮7 个亚类(图1)。

图1 黄酮类化合物的基本结构Fig. 1 Basic structures of flavonoids
研究表明,膳食黄酮的分布极其广泛,每个亚类代表性黄酮类化合物在膳食中的分布如表1所示。膳食黄酮的潜在生理功效包括抗氧化、抗炎、抗病毒、抗微生物、抗诱变和清除自由基等。流行病学研究表明,富含黄酮的水果、蔬菜和全谷物可以防止许多慢性疾病的发展,包括癌症、糖尿病及其并发症、心血管疾病、骨质疏松症和神经退行性疾病[9-10]。日常饮食中摄入足量的黄酮类化合物能有效地预防糖尿病及其并发症的发生。本文就氧化应激在DR发生发展中的可能作用以及黄酮类化合物对DR干预的最新实验研究进行了综述。

表1 黄酮类化合物在膳食中的分布Table 1 Distribution of flavonoids in plant diets
1 DR的发病机理
高血糖是糖尿病患者共有的一个特征,也是产生氧化应激的主要原因:高血糖引起机体异常代谢,通过直接诱导ROS的过量产生或通过改变氧化还原平衡而促成机体氧化应激环境[28]。视网膜中不饱和脂肪酸含量极高,与其他组织相比其氧摄取量和葡萄糖氧化量最高,这种现象使视网膜更容易发生氧化应激[29]。在视网膜中ROS通过引起血管内皮生长因子(vascular endothelial growth factor,VEGF)过量表达、细胞凋亡以及炎症反应造成视网膜病变。因此,高血糖、氧化还原稳态变化和氧化应激之间的相关性是DR发病机制中的关键因素(图2)。
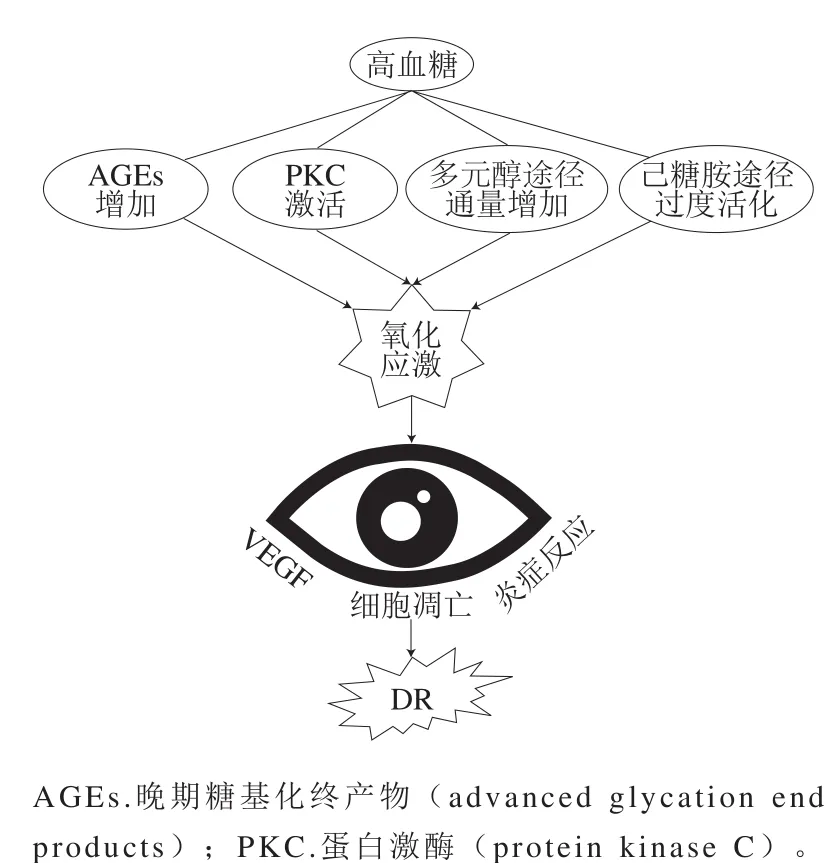
图2 高血糖诱导的氧化应激与DRFig. 2 Hyperglycemia-induced oxidative stress and DR
1.1 高血糖诱导ROS的产生
高血糖通过引起多元醇途径的通量增加、PKC的激活、AGEs含量的增加以及己糖胺途径的过度活化会提高机体ROS水平,引起机体氧化应激状态,造成细胞损伤,这是高血糖诱导DR的重要机制。
1.1.1 多元醇途径的通量增加与ROS的产生
多元醇途径是葡萄糖代谢途径之一,涉及葡萄糖向山梨糖醇的转变过程。在多元醇途径中,醛糖还原酶(aldose reductase,AR)将未被利用的葡萄糖转化成山梨糖醇,同时将烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化成NADP+;然后山梨糖醇脱氢酶将山梨糖醇氧化成果糖,并将NAD+转化成NADH。高血糖状态下细胞内葡萄糖通量的增加导致了多元醇途径的异常激活,AR与细胞内葡萄糖的亲和力异常升高,而AR对葡萄糖的过度利用导致了细胞内NADPH水平的降低。NADPH在细胞内用于从氧化型谷胱甘肽再生谷胱甘肽(体内重要的ROS清除物质),其在细胞中水平的降低会导致谷胱甘肽的缺乏。此外,NADPH水平的降低还会减少一氧化氮(nitric oxide,NO)(血管中最重要的血管扩张剂之一)的合成[30]。因此,NADPH水平的降低是ROS积累和造成氧化应激的重要原因。另外,多元醇途径的通量增加会导致NAD+向NADH的过度转化,细胞内NADH/NAD+比例的升高以及ROS水平的增加会抑制甘油醛-3-磷酸脱氢酶的活性,其反过来会导致细胞内磷酸丙糖的浓度升高,进而诱导甲基乙二醛(甘油二酯和AGEs的前体物质)的形成,从而导致AGEs水平的增加和PKC途径的激活[31]。
1.1.2 PKC的激活与ROS的产生
PKC是指基于其激活机制分组的丝氨酸/苏氨酸蛋白激酶家族。PKC可以被多种信号激活,例如甘油二酯或钙离子浓度的增加。由于高血糖症而增加的ROS水平抑制了糖酵解酶甘油醛-3-磷酸脱氢酶的活性,导致细胞内甘油二酯前体物质磷酸丙糖浓度增加。因此,高血糖能够刺激甘油二酯的形成,进而刺激PKC途径的激活[32]。在高血糖条件下,PKC-α是NADPH氧化酶(能生成用于清除病原微生物的ROS)的有效激活剂,可被α-生育酚抑制。还有报道显示PKC-α和PKC-δ可以激活NADPH氧化酶,进而负责在高葡萄糖条件下诱导Toll样受体(Toll-like receptors,TLR)-2和TLR-4表达[33]。这些改变可直接通过产生ROS或通过激活其他途径间接促成氧化应激环境。PKC的激活还可诱导一系列事件的发生,包括抑制内皮细胞中内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的表达[34]、增加血管平滑肌细胞中VEGF的表达[35]、减少平滑肌细胞中NO的产生[36]。通过高血糖激活PKC也会诱导转化生长因子的表达,其被认为是与硬化相关的疾病中纤维化的主要介质[37]。PKC途径也与核因子-κB(nuclear factor-κB,NF-κB)活化有关,它将高血糖诱导的氧化应激与炎症联系起来。
1.1.3 AGEs的形成与ROS的产生
AGEs的形成过程如下,还原糖的醛基或酮基与蛋白质的游离氨基共价结合形成Schiff碱,然后Schiff碱自发地重新排列成Amadori产物,接着Amadori产物通过两种方式转化为AGEs:一是直接转化;二是经历自动氧化以形成反应性羰基中间体,这些反应性羰基中间体完成一系列复杂的化学重排,产生不可逆的AGEs结构。另外,单独的葡萄糖也可以经历自动氧化以形成反应性羰基中间体,最终形成AGEs[38-39]。由于AGEs积累,导致包括参与基因转录调节在内的许多蛋白质在体内失去其功能。AGEs能够影响细胞外功能和细胞内功能。在细胞外基质中,AGEs的积累有助于形成永久改变细胞结构的交联[40]。在内皮下积聚的AGEs诱导单核细胞迁移穿过内皮细胞单层,导致NF-κB活化[41]。推测NADPH氧化酶的激活是AGEs诱导氧化应激的主要机制,氧化应激反过来转导多种信号,最终导致NF-κB活化、细胞因子形成和促炎途径的激活。
1.1.4 己糖胺途径的过度活化与ROS的产生
高血糖诱导的脂肪酸过量氧化能够增加果糖-6-磷酸进入己糖胺途径的通量,造成己糖胺途径的过度活化,进而促成糖尿病并发症。在己糖胺途径中,谷氨酰胺6-磷酸果糖酰胺转移酶(己糖胺途径的限速酶)将果糖-6-磷酸转化为葡糖胺-6-磷酸,然后将其转化为尿苷二磷酸-N-乙酰氨基葡萄糖,后者参与包括转录因子在内的细胞内因子的翻译后修饰过程[42]。相关研究表明,高血糖诱导氨基己糖途径的主要方式是通过增加关键基因肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)以及TNF-β1的转录而实现,通过氨基己糖途径的过度活化,经大量产生的ROS激活前炎症因子[43]。
1.2 DR与氧化应激
视网膜是体内代谢最活跃的组织,因此很容易受到高血糖的影响。高血糖引起的机体异常代谢状态导致了ROS的过量产生,ROS在眼部的积累会造成视网膜氧化应激损伤,氧化应激标志物水平与DR的严重程度相关,这是DR的最主要的发病机理。
1.2.1 VEGF与氧化应激
VEGF是一种血管生成诱导剂,可以引发非增殖性和增殖性DR,在DR发病进程中起着关键作用[44-45]。视网膜中ROS水平的升高引起VEGF的过量表达[46]。VEGF也可与其他对视网膜病变有重要影响的代谢途径相互作用,如PKC途径和多元醇途径[47-48]。
1.2.2 细胞凋亡与氧化应激
研究表明,视网膜细胞的凋亡是糖尿病视网膜发生组织病理学改变的先导事件[49-50]。氧化应激促进细胞凋亡的机制可能涉及膜脂质过氧化水平的增加和氧自由基对DNA等维持细胞功能所必需的大分子氧化损伤,以及信号转导和基因表达的改变[51-52]。在体外实验和动物模型实验中,视网膜细胞暴露于高葡萄糖条件下表现出氧化应激状态,在这一过程中Caspase-3、Bax活性和导致毛细血管细胞死亡的其他转录因子基因表达上调[53-55]。
Caspases是一组对氧化应激非常敏感的半胱氨酸蛋白酶,对于介导细胞凋亡至关重要[56]。Caspase-3在糖尿病视网膜中被激活,抑制糖尿病大鼠视网膜病变发展的同时也抑制视网膜中Caspase-3的活化,表明氧化应激可能通过调节Caspase-3活性诱导糖尿病患者视网膜细胞凋亡。视网膜及其毛细血管中被高血糖激活的NF-κB是另一种促进细胞凋亡的细胞因子,而且NF-κB的激活被认为是高血糖诱导内皮细胞凋亡的关键信号通路[57]。已有实验证明,高葡萄糖条件下培养的视网膜细胞,在发生细胞死亡或组织病理学改变之前就已经发生了NF-κB的激活,并且NF-κB的激活在组织病理学发展期间持续进行,这表明NF-kB的激活是DR发展的早期事件[53]。
1.2.3 炎症反应与氧化应激
炎症反应可能在DR的发展和进展中起重要作用,而氧化应激可直接或间接诱导炎症介质的释放和涉及DR发病机理的炎症过程,例如ROS可以极大程度地促进细胞炎症因子的释放[58]。高血糖诱导的超氧化物可通过各种途径促进炎症反应,导致内皮细胞被破坏,增加微血管通透性和释放细胞因子,并有助于在炎症部位募集中性粒细胞[59]。
2 黄酮类化合物干预DR的研究进展
大量研究表明,黄酮类化合物具有良好的干预DR的功能。黄酮类化合物通过两个方面起到干预DR的作用:一是通过控制血糖水平来控制机体ROS水平以达到控制DR的目的;二是通过激活多种分子信号途径降低机体ROS含量。
2.1 降血糖作用
橙皮素可以显著降低链脲佐菌素(streptozotocin,STZ)诱导的小鼠血浆葡萄糖含量,改善血浆胰岛素和糖原水平[17]。向糖尿病大鼠体内注射异槲皮素可以显著降低其血糖水平,并调节胰岛素信号基因和碳水化合物代谢酶的mRNA表达[60]。在Pinent等[61]的研究中,原花青素显示出显著的抗高血糖活性。给糖尿病大鼠口服芦丁可降低其空腹血糖水平,并可显著改善糖化血红蛋白和胰岛素水平[14]。槲皮素、(-)-表儿茶素和芦丁是植物中分布最广的3 种黄酮类化合物,可以改善大鼠胰腺的抗氧化状态,抑制高血糖和β-细胞的破坏以及阻断NO的产生和抑制胰岛素从胰岛中释放[62-64]。高血糖状态可以引起机体代谢失衡,造成氧化应激状态,损伤视网膜细胞与组织,进而引发DR。过往的大量实验数据表明,黄酮类化合物具有降血糖、抗糖尿病的功效。这可以为防治DR提供新的研究方向,即黄酮类化合物通过降低机体血糖水平治疗DR。
2.2 抑制AGEs积累和AR活性
莲叶提取物(主要成分为槲皮素-3-O-β-D-吡喃葡萄糖苷和槲皮素-3-O-β-D-葡萄糖醛酸吡喃糖苷)对ROS、大鼠晶状体AR和AGEs显示出优异的抑制效果[65]。橙皮苷通过抗血管生成、抗炎和抗氧化作用以及对多元醇途径和AGEs积累的抑制作用,可以减弱STZ诱导的糖尿病大鼠视网膜和血浆异常[66]。表没食子儿茶素没食子酸酯、根皮素和6-姜酚预处理可以显著降低血糖水平、AGEs积累和AR活性[67]。Kumar等[68]发现,从金凤花中提取的化合物3,6,7,4’,5’-五甲氧基-5,3’-二羟基黄酮以剂量依赖性方式降低STZ诱导的糖尿病大鼠中的AR活性,从而抑制视网膜中山梨糖醇的积累。
2.3 抗氧化及抗炎作用
氧化应激是DR的主要致病因素。体内ROS的水平直接影响DR患者的病情发展,黄酮类化合物等抗氧化剂的使用对视网膜病变的发展具有抑制作用。蓝莓花青素可以通过调节Nrf2/HO-1信号传导保护视网膜细胞免受高血糖诱导的氧化应激和炎症[69]。柚皮苷能减轻糖尿病视网膜实验模型中的炎症反应、氧化应激和NF-κB活化[70]。香叶木素-7-O-芸香糖苷通过调节c-Jun氨基末端激酶(JNK)和p38信号通路,降低细胞色素c、Bax和Caspase-3的表达水平,同时增加B淋巴细胞瘤(B-cell lymphoma-2,Bcl-2)表达,在体外保护人体视网膜色素上皮(retinal pigment epithelium,RPE)细胞免受高糖诱导的氧化损伤[71]。槲皮素通过抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPKs)和蛋白激酶B(Akt)使NF-κB信号失活,从而抑制VEGF诱导的视网膜光感受器细胞过度炎症反应[15]。芒柄花素可以通过抑制NF-κB的激活阻止过氧化氢诱导的氧化应激指标水平的升高,进而阻止视网膜神经节细胞(retinal ganglion cells,RGCs)的凋亡[72]。鹰嘴豆芽素A可通过降低血糖水平、下调TNF-α和IL-1β表达来抑制炎症,并通过降低视网膜组织中的VEGF来减少血管生成,从而改善和延缓视网膜病变[73]。Kumar等[18]用橙皮素处理STZ诱导的糖尿病大鼠24 周,结果显示,橙皮素处理的视网膜与糖尿病视网膜相比抗氧化酶活性升高,促炎细胞因子TNF-α和IL-1β、Caspase-3、胶质纤维酸性蛋白和水通道蛋白4的表达显著降低。
2.4 抑制细胞凋亡
在DR疾病进程中会出现RGCs的凋亡,另外ROS水平的升高与细胞凋亡有关。视网膜细胞的凋亡在糖尿病引起的视网膜病变中起着重要的促进作用,而黄酮类化合物可以通过抑制高血糖引起的细胞凋亡控制DR的进程。在DR中,长时间的高血糖水平可能引起包括RPE细胞在内的各种视网膜组织的显著损伤,7,8-二羟基黄酮可以通过激活激酶B原肌球蛋白受体信号通路有效地预防人RPE细胞中高葡萄糖诱导的视网膜细胞凋亡[74]。橙皮苷通过抑制Caspase-9、Caspase-3的表达和Bax/Bcl-2的下调来抑制高葡萄糖诱导的RGCs的凋亡[75]。在Hao Lina等[23]的研究中,葛根素可通过降低过氧亚硝酸盐水平和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达来减少糖尿病大鼠RPE细胞凋亡,从而减缓DR的进程。槲皮素通过提高抗氧化酶活性、抑制NF-κB和Caspase-3活性发挥抗糖尿病视网膜细胞凋亡的作用,同时通过抑制水通道蛋白4在视网膜内层的表达预防视网膜水肿[76]。柚皮素处理可以改善糖尿病大鼠硫代巴比妥酸活性物质水平的升高和谷胱甘肽水平的降低,提高糖尿病视网膜中神经保护因子(脑源性神经营养因子)、原肌球蛋白相关激酶B和突触素的水平,调控细胞凋亡调节蛋白的水平抑制细胞凋亡[26]。槲皮素可以通过改善神经营养因子的水平以及通过调控关键基因抑制神经元的凋亡来保护糖尿病视网膜中的神经元损伤[77]。在糖尿病视网膜中,芦丁补充剂可改善降低的脑源性神经营养因子、神经生长因子和谷胱甘肽水平,并降低硫代巴比妥酸活性物质的水平。此外,芦丁处理通过抑制糖尿病视网膜中Caspase-3的表达和提高Bcl-2的水平显示出抗细胞凋亡活性[78]。
2.5 抗VEGF
新血管形成增加的视网膜VEGF是眼部新生血管疾病的重要致病因素,其在DR的发生发展中起重要作用。葛花总黄酮可改善糖尿病小鼠视网膜病变的病理形态,并可通过下调糖尿病小鼠视网膜VEGF表达,对DR组织发挥一定的保护作用[79]。黄芩素通过抑制氧化应激,增强缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)降解和降低VEGF分泌表现出抗血管生成作用,从而减缓DR[13]。葛根素通过调节VEGF和HIF-1α的表达可显著降低STZ诱导的糖尿病大鼠DR发病率,表明葛根素对大鼠DR具有显著的保护作用[24]。芒柄花素通过抑制RPE细胞的VEGF分泌,下调VEGFA和脯氨酰羟化酶-2的mRNA表达,降低VEGF、HIF-1α和脯氨酰羟化酶-2的蛋白表达从而改善视网膜新血管形成[80]。视网膜中的VEGF主要来源于Müller细胞,Ke Min等[81]的研究结果表明,黄芪素可以减少Müller细胞中VEGF的过度表达,减轻高糖对其的影响。在早期糖尿病期间,氧化应激可能参与视网膜VEGF的上调,3’,4’,7-三羟乙基芦丁的防治可以减少VEGF的形成[82]。
表没食子儿茶素没食子酸酯通过对MAPK/细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)-VEGF途径的负调节显著降低了高葡萄糖诱导的人视网膜内皮细胞中炎症细胞因子的表达,抑制了VEGF的表达,提高了细胞存活率[83]。Elgayar等[25]研究结果表明,与糖尿病大鼠相比,金雀异黄素处理组大鼠的宏观和小神经胶质细胞反应性和视网膜毛细血管的组织学变化得到改善,胶质纤维酸性蛋白和iNOS在视网膜中的表达和血糖水平降低。圣草酚治疗以剂量依赖性方式显著降低糖尿病视网膜中TNF-α、细胞间黏附分子-1、VEGF和eNOS。此外,圣草酚治疗能够显著抑制糖尿病相关的脂质过氧化以及血-视网膜屏障分解[27]。在Kang等[84]的研究中,白杨素能够减少葡萄糖刺激的RPE细胞和糖尿病小鼠眼中VEGF、胰岛素样生长因子-1和色素上皮衍生因子的产生;此外,白杨素通过阻止AGE-RAGE活化来阻断内质网应激,从而抑制类视黄醇视觉周期的损害。山柰酚通过靶向下调VEGF和胎盘生长因子的表达并抑制Src Akt1-Erk1/2信号通路的激活,从而抑制人视网膜内皮细胞的血管生成[16]。
2.6 其他
以小胶质细胞激活和黏膜细胞功能障碍为特征的炎症过程与STZ诱导的DR有关,黄芩素治疗可改善炎症过程,从而抑制糖尿病视网膜血管异常和神经元丢失[85]。在视网膜病变早期,采取碧萝芷处理可以增强视网膜血液循环,同时伴有水肿消退,有利于改善患者的视力[86]。Zhang Hongtao等[87]的研究结果表明水飞蓟素减少了实验性糖尿病中闭塞的视网膜毛细血管数量,并且恢复了视网膜血管白细胞停滞和细胞间黏附分子-1水平。淫羊藿苷通过调节视网膜微血管中的内皮标志物和胶原蛋白IV表达以及RGC中的Thy-1和Brn3a表达从而减缓DR的进程[88]。与糖尿病视网膜相比,橙皮苷处理的视网膜中VEGF和PKC-β表达量显著降低,且视网膜未出现任何血管功能障碍[89]。

表2 黄酮类化合物在干预DR中的作用及机制Table 2 Role and mechanism of flavonoids in intervention of DR
3 结 语
中国大陆糖尿病人群DR患病率为23%,其中非增生型DR为19.1%,增生型DR为2.8%,农村高于城市,北方高于南方和东部[90]。DR已成为我国50 岁以上人群最主要的致盲性眼病之一。目前,DR确切的发病机制尚未完全明了,但已知氧化应激在DR中的作用非常重要,因此可以通过了解氧化应激与DR之间的相互作用,积极地减少氧化应激对DR的损伤,利用各种有作用的抗氧化剂增强抗氧化酶的活性,减少氧化应激标志物的产生,从而延缓DR的发生发展。细胞和体内研究表明,大量黄酮类化合物对糖尿病视网膜神经变性有益。因此,利用黄酮类物质的膳食干预策略将是改善DR的有效方法。然而,这些研究中使用的黄酮化合物的剂量远高于人类从食物中正常摄入的剂量;另外,使用单一化合物来评估膳食黄酮的生物活性并不合适,因此很难从这些结果中预测膳食黄酮的摄入对预防DR的影响。同样地,大多数体外研究的浓度远远超过膳食黄酮进入人体后在血浆和组织中所达到的生理浓度,这意味着膳食黄酮在体外诱导的某些生物效应可能在饮食摄入后并不会出现。因此,需要进行额外的动物研究和临床实验来探究膳食黄酮的剂量以及各成分之间的相互作用对DR干预效果的影响,以更好地了解膳食黄酮可能对健康的影响。
目前对于DR的治疗主要依靠药物进行,包括血管内皮生长抑制剂、AR抑制剂、PKC抑制剂等,同时还应辅以控制血糖、降压、降脂进行治疗,但是药物治疗或多或少地会带来一定的副作用。功能食品可以调节机体功能且不会对机体产生危害,因此开发以膳食黄酮为主要成分、对干预DR有积极作用的功能食品具有重要的现实意义。
