食品级刺五加叶黄酮微乳的制备及功能特性
2019-10-30于鑫欣赵多佳孙广梅徐晓娟张英华
于鑫欣,赵多佳,张 钋,孙广梅,徐晓娟,张英华*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
近年来随着人们对功能性食品需求的提升,生物类黄酮开始被广泛用作膳食补充剂。刺五加中的黄酮类物质具有广泛的药理活性,除对人体具有免疫调节、抗肿瘤、抗衰老、抗辐射及抗疲劳作用外,还可治疗心脑血管疾病、糖尿病、神经衰弱等症[1]。大量实验表明,黄酮类物质在抗氧化反应中不仅能阻抑自由基链反应的引发,而且可以直接捕获自由基反应链中的自由基,阻断自由基链反应,起到预防和断链的双重作用,是优良的天然抗氧化剂,有较强的清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和超氧阴离子自由基(O2-·)的能力,并能够有效抑制油脂氧化[2-5]。同时,黄酮化合物具有广谱抑菌性能[6-8]。刺五加中的各个部分均含有黄酮类化合物,叶中含量最多。陈貌连等利用电喷雾质谱从刺五加叶中检测到4 种黄酮类化合物,除金丝桃苷外,其余3 种为首次在刺五加叶中发现,经测定,槲皮素及相关黄酮类化合物在刺五加叶中的含量高达37.25%[9]。但黄酮类物质的溶解度和生物利用度低,同时黄酮类物质含有多个羟基,耐碱性和抗光解能力差,化学性质很不稳定,从而限制了其在食品中的应用[10]。因此,寻求合适的手段进一步改善黄酮类物质的溶解性、提高其稳定性和生物利用度十分必要。
微乳液具有黏度小、热力学稳定等特点,是难溶性物质的良好载体,可解决某些营养物质因难溶、易氧化等缺点而造成的难以利用的问题[11-13]。基于微乳的食品载体研究迅速地发展起来[14-15]。国内外对于微乳的报道近几年也逐渐增多,郭瑞雪以微乳区域面积为指标,利用伪三元相图对微乳的处方进行优化,确定杨梅素微乳的最佳配方,并研究其稳定性[16];Sharma等制备二甲胺基硼烷/丙二醇/三乙酰甘油酯/胰岛素水溶液微乳并对糖尿病大鼠进行研究,结果表明其生物利用度为空白胰岛素溶液的10 倍,同时其通过透射电子显微镜、荧光光谱仪对微乳性质进行了研究[17]。微乳用于食品中可以解决某些营养物质难溶、不易吸收、易氧化等缺点,掩盖不良的气味,并防止食品在加工与保藏过程中发生质量劣变,还可以对活性成分进行可控释放[18]。将黄酮类化合物用微乳包埋以后可以有效解决刺五加叶黄酮化合物的溶解性低、稳定性差等问题,有效提高其生物利用度。
国内外对于食品级微乳的报道相对较少,本实验通过选择食品级的表面活性剂、助表面活性剂以及食用油制备食品级O/W型刺五加叶黄酮微乳,以期减少表面活性剂和助表面活性剂的添加比例,增加安全性并提高黄酮化合物的化学稳定性,保护其生物活性。刺五加叶黄酮微乳制剂的开发在食品、保健品和药品领域中具有重要的现实意义。
1 材料与方法
1.1 菌株、材料与试剂
本实验使用的致病性大肠杆菌(简称大肠杆菌)、沙门氏菌、金黄色葡萄球菌和荧光假单胞菌均购自中国工业微生物菌种保藏管理中心。
刺五加叶为市售;肉豆蔻酸异丙酯、聚氧乙烯蓖麻油上海阿拉丁化学试剂有限公司;Tween 20、Tween 60、Tween-80、油酸乙酯 上海晶纯试剂有限公司;食品级橄榄油 益海嘉里集团;丁酸乙酯 天津市光复精细化工研究所;1,2-丙二醇、丙三醇、正丁醇、异丙醇、无水乙醇 天津市博迪化工有限公司;牛肉膏、蛋白胨北京奥博星生物技术有限公司;抗坏血酸 天津市天力化学试剂有限公司。其他分析试剂均为国产分析纯。
1.2 仪器与设备
H-7650透射电子显微镜 日本日立公司;Zetasizer3000HSA型激光粒度分布仪 英国Malvern公司;TU-1800紫外-可见分光光度仪 北京普析通用仪器有限责任公司;TCL-16C台式离心机 上海安亭科学仪器厂;无菌超净台 北京东联哈尔仪器制造有限公司;DH5000A电热恒温培养箱 天津泰斯特仪器有限公司;乌氏黏度计(毛细管内径0.46 mm) 上海隆拓仪器设备有限公司。
1.3 方法
1.3.1 食品级微乳伪三元相图的绘制
将表面活性剂和助表面活性剂按一定质量比(Km,分别为3∶1、2∶1、1∶1、1∶2、1∶3)混合,再按一定质量比(1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1)与橄榄油混合均匀,加入带有磁力搅拌子的称量瓶中,称其质量并控制其总质量一定。将称量瓶恒温(25±1)℃后,在不断搅拌下用细滴管小心滴加双蒸水,同时观察瓶中溶液状态的变化,直至澄清透明的微乳形成,继续滴定,观察可能发生的变化,以确定微乳区界限。在滴加过程中,当乳液黏度较大时,用偏光显微镜观察有无双折射现象,发亮的为液晶,不发亮的为凝胶,同时记录乳液外观由澄清变为浑浊或由浑浊变为澄清时各组分的临界加入量。采用4 组分伪三元相图,以表面活性剂和助表面活性剂作为三元相图的一个顶点(S),油相和水相分别为三元相图的另两个顶点(O、W),根据油、水、表面活性剂在临界点的质量分数来确定该点在相图中的位置,将每个临界点连成曲线即得该组分在一定Km下的伪三元相图,确定微乳区,比较各相图的微乳区面积,对配方进行初步筛选[19]。
1.3.2 食品级空白微乳的制备
按照1.3.1节的操作绘制伪三元相图,研究表面活性剂、助表面活性剂、表面活性剂与助表面活性剂的质量比(Km)、油相4 个因素对食品级微乳形成的影响。
根据相图筛选出表1中的两个配方,按照配方比例应用滴加水相法制备空白微乳。

表1 微乳配方中各组分质量分数Table 1 Compositions of different microemulsions%
1.3.3 食品级刺五加叶黄酮微乳的制备
先将黄酮类物质溶于油相中,取刺五加叶黄酮化合物置于烧杯中,分别加入20 mL的A、B空白微乳溶液,25 ℃、200 r/min在磁力搅拌器上连续分散12 h,使其达饱和状态,静置2 h以达到平衡。用0.8 μm的滤膜过滤即可得到刺五加叶黄酮微乳A’、B’[20]。
1.3.4 食品级微乳理化性质的测定和稳定性考察
1.3.4.1 微乳的形态观察
采用透射电子显微镜对微乳进行形态学评价。选取制备好的微乳,用去离子水稀释100 倍体积,取一滴稀释液将其滴在覆有支持膜的铜网上,静置10 min后,再滴加质量分数3%磷钨酸溶液于铜网上复染5 min,自然挥发干,透射电子显微镜观察、拍照[21]。
1.3.4.2 微乳的粒径测定
在比色杯中加入适量的待测微乳样品,使用Zetasizer 3000HSA光散射测径仪测定样品的粒径及分布。仪器参数设定如下:温度设定为25 ℃,散射角度设定为90°[22]。
1.3.4.3 微乳黏度的测定
用乌氏黏度计,依照黏度测定法第一法(《中华人民共和国药典》2005版附录VI G)恒温20 ℃条件下测定。
1.3.4.4 微乳的类型判断
取相同体积的微乳两份,分别同时加入苏丹红III染料和亚甲基蓝染料溶液2 滴,静置观察两种染料(红色和蓝色)在微乳中的扩散速率以及外观的变化。微乳类型判定标准为:如蓝色的扩散速率大于红色,则为水包油(O/W)型微乳;反之为油包水(W/O)型微乳;二者速率相同,则为双连续型微乳[23]。
1.3.4.5 微乳稳定性的测定
分别考察微乳高速离心、不同温度下长时间放置对微乳稳定性的影响,以微乳的颜色和状态评定微乳是否稳定。
1.3.5 刺五加叶中黄酮类化合物的提取
以刺五加叶为原料,采用乙醇回流方式提取叶中的黄酮类化合物。参照文献[24-25]方法进行提取。
1.3.6 抗氧化能力的测定
1.3.6.1 清除O2-·能力测定
在10 mL试管中加入4.5 mL pH 8.2磷酸盐缓冲液,25 ℃水浴20 min,分别加入1 mL不同质量浓度的样品溶液和25 ℃预热的0.4 mL 25 mol/L邻苯三酚溶液,振荡3 min后立即加入100 μL质量分数3%抗坏血酸,振荡均匀。在320 nm波长处测定吸光度[26]。按式(1)计算O2-·清除率。
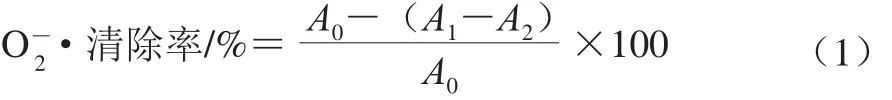
式中:A0为不加样品时吸光度;Al为加入样品的吸光度;A2为不加邻苯三酚样品的吸光度。
1.3.6.2 清除羟自由基能力测定
利用Fenton反应检测黄酮及黄酮微乳对羟自由基(·OH)的清除作用[27]。·OH清除率按式(2)计算。
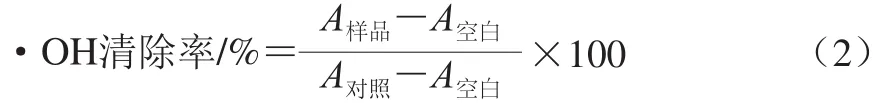
式中:A对照为以等体积的重蒸水代替样品溶液和H2O2溶液的吸光度;A空白为以等体积的重蒸水代替样品溶液的吸光度;A样品为样品溶液的吸光度。
1.3.6.3 清除DPPH自由基能力测定
在10 mL试管中分别加入各质量浓度样品液2 mL及2×10-4mol/L DPPH溶液2 mL,摇匀,30 min后在517 nm波长处测定其吸光度Ai,同时测定2 mL 2×10-4mol/L DPPH溶液与2 mL无水乙醇混合液的吸光度Ac,以及2 mL测定液与2 mL无水乙醇混合液的吸光度Aj,根据式(3)计算样品液对DPPH自由基的清除率[28]。
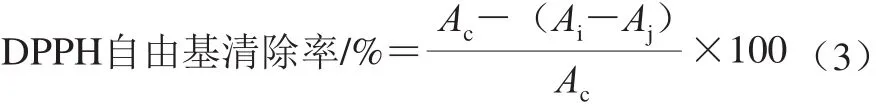
1.3.7 抑菌圈实验
5 种不同质量浓度的刺五加叶黄酮溶液和黄酮微乳中分别放入直径为6 mm的灭菌滤纸片,浸泡12 h,待其自然干燥后,用紫外线照射灭菌10~15 min,之后将滤纸片放在含供试菌(0.1 mL浓度为105~106CFU/mL的大肠杆菌、金黄色葡萄球菌、沙门氏菌及荧光假单胞菌)的平板上,把每个处理过的培养皿放到各供试菌最适温度下培养48 h。用游标卡尺测定抑菌圈直径,以生理盐水作空白对照,各供试菌做3 次重复实验[29]。
1.4 数据处理与分析
采用Origin 8.0软件绘制伪三元相图,用SPSS软件进行数据统计分析,采用单因素方差分析进行差异显著性检验。与对照组比较,当P<0.01时表示具有极显著性差异,P<0.05时表示具有显著性差异。
2 结果与分析
2.1 食品级微乳形成的影响因素
本研究的目的是制备乳化剂含量低、质量指标良好的微乳,故选择与乳化剂含量、粒径和微乳稳定性关系密切的微乳区面积作为主要的评价指标。
2.1.1 油相的选择


图1 不同油相对伪三元相图的影响Fig. 1 Pseudo-ternary phase diagrams with different oil phases
在25 ℃和Km=2条件下,以乙醇为助表面活性剂和Tween-80为表面活性剂分别与不同油相制备微乳,所形成的微乳区域如图1所示。肉豆蔻酸异丙酯的微乳区域面积最大,油酸乙酯其次,而橄榄油、玉米油和豆油作为油相的体系均不能形成微乳,可能是因为这几种油相都是混合物,纯度不高。刺五加叶黄酮化合物在各油相中的溶解度顺序为:肉豆蔻酸异丙酯>油酸乙酯>油酸>丁酸乙酯>橄榄油>大豆油,综合考虑刺五加叶黄酮在各油相中的饱和溶解度,选用肉豆蔻酸异丙酯为油相。
2.1.2 助表面活性剂的选择
在25 ℃和Km=2条件下,固定Tween-80为表面活性剂、丁酸乙酯为油相,用伪三元相图从乙醇、丙三醇、1,2-丙二醇、聚乙二醇、正丁醇、异丙醇中筛选出形成微乳区域面积最大的助表面活性剂。由图2可知,乙醇形成的微乳区域面积最大,其次是异丙醇和1,2-丙二醇,甘油由于黏度最大,易形成凝胶和液晶,导致形成微乳区域面积最小。所以选择乙醇为最佳的助表面活性剂。

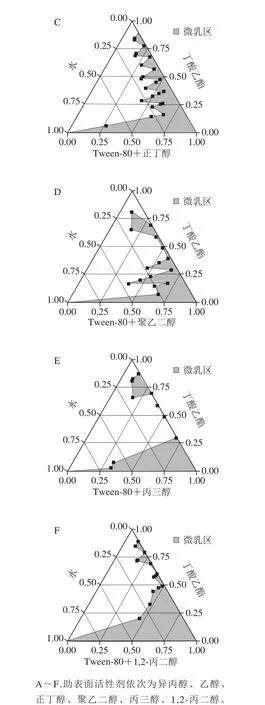
图2 不同助表面活性剂对伪三元相图的影响Fig. 2 Pseudo-ternary phase diagrams with different cosurfactants
2.1.3 表面活性剂的选择
在25 ℃和Km=2条件下,以肉豆蔻酸异丙酯为油相和乙醇为助表面活性剂分别与不同的表面活性剂制备微乳,所形成的微乳区域见图3。不难看出Tween-80/乙醇/肉豆蔻酸异丙酯形成的微乳区域面积最大,效果最佳,微乳可无限稀释。所以选择微乳区域面积较大的Tween-80作表面活性剂。

图3 不同表面活性剂对伪三元相图的影响Fig. 3 Pseudo-ternary phase diagrams with different surfactants
2.1.4 表面活性剂/助表面活性剂Km的选择
在25 ℃条件下,以乙醇为助表面活性剂、肉豆蔻酸异丙酯为油相、Tween-80为表面活性剂,分别以不同的Km制备微乳,所形成的微乳区域见图4。在一定范围内随着Km的增加,微乳区域面积也增加,当Km为2时微乳区域面积达到最大,随后Km过大易形成液晶和凝胶,导致微乳区面积减小,而且高浓度的表面活性剂会增大微乳的黏度,不利于其在实际领域中的一些应用(如注射药剂)。
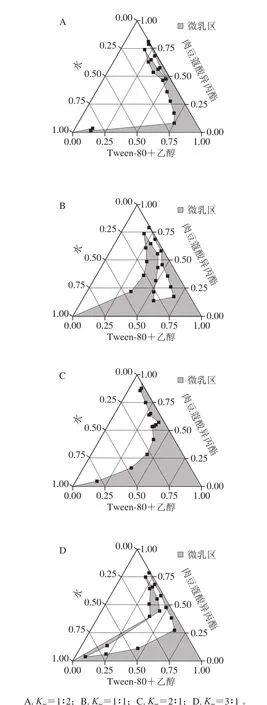
图4 不同Km对伪三元相图的影响Fig. 4 Pseudo-ternary phase diagrams with different Km
2.1.5 刺五加叶黄酮提取物的添加对微乳区域的影响
在25 ℃、Km=2条件下,以乙醇为助表面活性剂、Tween-80为表面活性剂、肉豆蔻酸异丙酯为油相,在此条件下制备微乳,结果见图5。
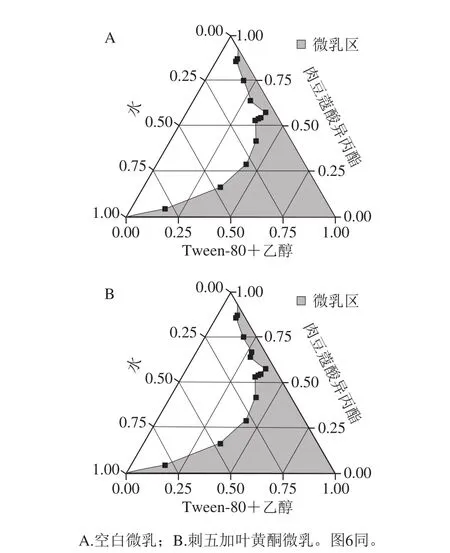
图5 刺五加叶黄酮对伪三元相图的影响Fig. 5 Effect of flavonoids on pseudo-ternary phase diagram
从图5中可以看出,空白微乳和刺五加叶黄酮微乳的区域面积变化不明显,所以,刺五加叶黄酮的加入对微乳区域面积几乎没有影响。在Tween-80体系中,刺五加叶黄酮类化合物的加入对微乳区域略有影响但很小,这可能是因为药物分子不仅分布于微乳液的油相和水相,而且可能与微乳的界面膜发生相互作用而均匀分散,因此不会影响微乳形成的区域范围。
2.2 微乳理化性质的测定和稳定性考察
2.2.1 微乳的理化性质
室温下,空白微乳A、B外观呈透明、淡黄色,黏度小、流动性好的液体。刺五加叶黄酮微乳A’、B’的外观呈黄绿色、透明、黏度小、流动性高的液体。按照1.3.3.4节方法测定微乳类型,亚甲基蓝在微乳中的扩散速率明显快于苏丹红III,结果表明所制备的微乳为O/W型。
2.2.2 微乳的形态
透射电子显微镜下,空白微乳A及刺五加叶黄酮微乳B的液滴呈球形,粒径比较均一(图6)。

图6 空白微乳及刺五加叶黄酮微乳的透射电子显微镜照片(100 000×)Fig. 6 TEM images of microemulsion with and without flavonoids (100 000 ×)
2.2.3 微乳的粒径
所制备的微乳粒径分布见图7,空白微乳与黄酮微乳的粒径均在10~100 nm范围之间,符合微乳的要求,粒径分布情况均为正态分布。
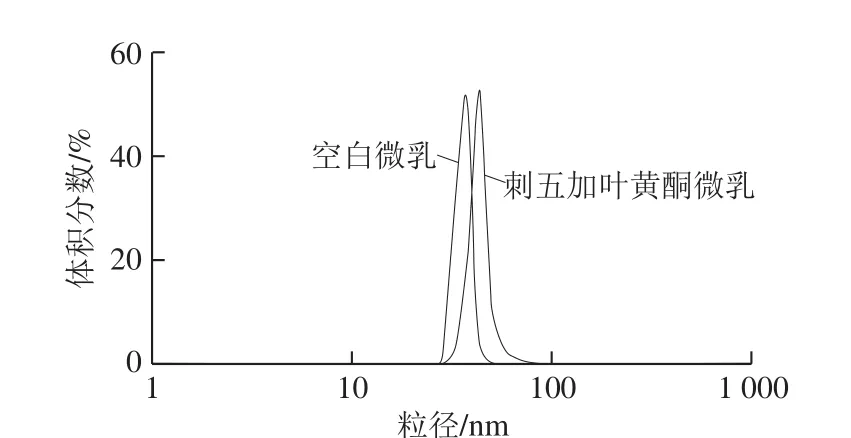
图7 刺五加叶黄酮微乳与空白微乳的粒径分布Fig. 7 Particle size distribution of microemulsion with and without flavonoids
2.2.4 微乳的黏度
经测定空白微乳A、B的平均黏度分别为(4.17±0.08)mm2/s和(2.64±0.05)mm2/s,刺五加叶黄酮微乳A’、B’的平均黏度分别为(4.18±0.05)mm2/s和(2.63±0.03)mm2/s,实验结果表明所制备的微乳黏度较小,流动性指标良好。微乳的流变性对微乳制剂的使用具有重要的意义,液体需要有一定的流动性,如口服剂需易从容器中倾出,皮肤用药需要有适宜的铺展性等。
2.2.5 微乳的稳定性
空白微乳和刺五加叶黄酮微乳分别经4 000 r/min离心30 min、10 000 r/min离心20 min后,仍保持原有状态,透明且不分层。
将配制好的空白微乳和刺五加叶黄酮微乳分别放置在4、25 ℃和37 ℃下,分别在5、10、20、40、60、90 d观察其外观,结果微乳均为透明、不分层、状态稳定。最佳配方制备的微乳在中、低温下均稳定,可以长时间贮存,可作为食品与药品的载体。
2.3 刺五加叶黄酮微乳抗氧化、抑菌能力分析
按照1.3.3节的实验方法,制备刺五加叶黄酮微乳A’,对其进行抗氧化实验并以相同质量浓度的刺五加叶黄酮提取物作空白对照。
2.3.1 抗氧化能力分析结果
分析样品的抗氧化能力,以各自由基清除率与黄酮质量浓度作图,结果见图8。不同质量浓度的刺五加叶黄酮类化合物及刺五加叶黄酮微乳都有较好的清除O2—·、·OH、DPPH自由基能力,并随着刺五加叶黄酮类化合物质量浓度的增加而不断增强。相同质量浓度的刺五加叶黄酮的抗氧化性不及黄酮微乳,表明微乳对刺五加叶黄酮提取物有一定的保护作用,能提高其抗氧化能力。微乳作为活性物质的载体能够保护活性物质不被破坏,王锦旋采用自微乳化技术和膜控释包衣技术制备了山楂叶总黄酮自微乳化膜控释滴丸,并测定了其体外释放度[30];颜秀花等制备出了β-胡萝卜素微乳液并对其稳定性进行了研究[31],实验结果均表明微乳能够保护生物活性物质,与本实验中黄酮微乳清除O2—·、·OH、DPPH自由基的能力均优于黄酮溶液的结果相同。

图8 不同质量浓度的刺五加叶黄酮和刺五加叶黄酮微乳溶液抗氧化能力的比较Fig. 8 Antioxidant capacity of flavonoids from Acanthopanax senticosus leaves at different concentrations and microemulsion with flavonoids
2.3.2 抑菌圈实验结果
进行抑菌圈实验,考察刺五加叶黄酮微乳液对各供试菌的抑菌能力,同时以刺五加叶黄酮溶液作空白对照,实验结果见表2。
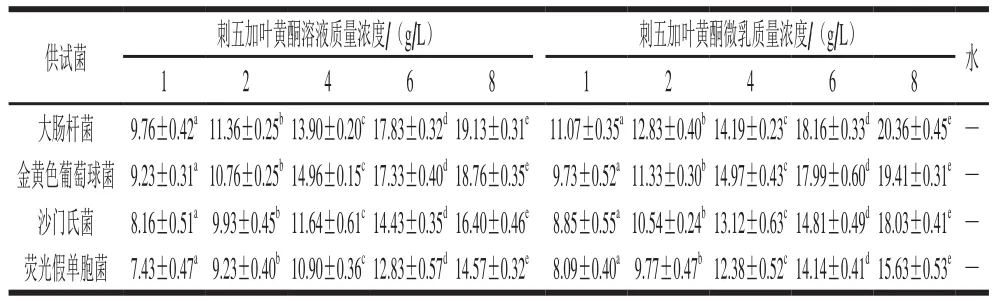
表2 不同质量浓度的刺五加叶黄酮和刺五加叶黄酮微乳下供试菌的抑菌圈直径Table 2 Antibacterial effects of flavonoids at different concentrations and microemulsion with flavonoids on test bacteria mm
表2结果表明,刺五加叶黄酮及其微乳对供试菌均有较显著的抑制作用,并且随着刺五加叶黄酮提取物质量浓度的增加,其抑菌效果明显提高。酚类化合物及其衍生物一般呈弱酸性,能使蛋白质凝固或变性[32]。因而黄酮类化合物作为植物多酚类的衍生物,也表现出一定的抑菌作用。由表2可直观地看出,刺五加叶黄酮微乳对供试菌的抑制作用均优于刺五加叶黄酮对照,并且,随着质量浓度的升高,抑菌圈直径增大,当制备的黄酮微乳质量浓度为8 g/L时,对大肠杆菌、金黄色葡萄球菌、沙门氏菌及荧光假单胞菌的抑菌圈直径分别为20.36、19.41、18.03、15.63 mm。并且各质量浓度刺五加叶黄酮微乳对供试菌的抑制作用差异显著。刺五加叶黄酮微乳的抑菌效果优于黄酮溶液的原因一方面是由于黄酮的生物活性在微乳液中得到保存;另一方面是微乳本身所具有的抑菌作用[33]。
3 讨 论
微乳制备和处方筛选的经典方法为伪三元相图法,本实验利用伪三元相图考察了不同组合的空白微乳成乳情况,结果表明,微乳的微乳区域受多方面因素的影响,必须综合考察油相、表面活性剂、助表面活性剂、Km的作用。
制备微乳时油相分子的大小对微乳的形成较为重要,理论上油相分子体积越小,溶解力越强,越易形成微乳,原因在于大分子油相不易嵌入表面活性剂中。本实验中肉豆蔻酸异丙酯是小分子油相,碳链短、极性强,它在水相中有一定的溶解度,与亲水性混合表面活性剂互相渗透的能力最强,比较容易渗透到油-水间混合表面活性剂形成的界面膜中,因而其微乳区最大[34]。
在油-水-表面活性剂体系中,油和水之间的界面张力已大幅降低,但仍不能形成微乳或极少能形成微乳。助表面活性剂的存在会产生混合吸附,导致界面张力进一步下降[35]。此外,油-水界面的柔性对微乳的形成也很关键,当体系中有助表面活性剂存在时,表面活性剂与其形成混合膜,增加界面的柔性,易于弯曲,更易形成微乳。由图2可知,乙醇形成的微乳区面积最大,比较稳定,且无限稀释微乳仍能保持透明、澄清状态。在表面活性剂的选择上,亲水亲油平衡(hydrophile lipophilic balance,HLB)值与被乳化物(即油相)的HLB值相等时,其乳化效果最好[36],对油相的增溶能力也就越强,即微乳区就越大。非离子表面活性剂由于其本身毒性和刺激性小,成为食品行业广受关注的表面活性剂类型。本实验选择的非离子表面活性剂毒性比较低,较适合在食品中应用。根据图3可知,Tween-80效果最好,微乳区域面积最大。
合适的表面活性剂/助表面活性剂比例有利于微乳的形成。当Km=2时形成的微乳区面积最大。当Km<l时,微乳体系稳定性下降,容易分层和混浊。Km>1时,随着Km的增加,微乳区域面积先增大再缩小,这是由于表面活性剂与助表面活性剂在最佳质量配比时,助表面活性剂完全镶嵌到表面活性剂中,形成的微乳结构增溶空间最大,载油量最大;如表面活性剂的量继续增加,无法形成较大的增溶空间,而且Km过大易形成凝胶和液晶区,导致微乳区减小[37]。在保证微乳液稳定性及使用性能的前提下,应尽可能减少表面活性剂的用量。
本实验同样对微乳的理化性质和稳定性进行考察,透射电子显微镜下观察空白微乳及黄酮微乳的颗粒呈球形,粒径比较均一,平均粒径在10~100 nm之间,平均黏度为(2.58±0.07)mm2/s,符合微乳要求,适于应用。稳定性的实验结果表明,所得到的微乳体系在常温下可以存放3 个月,体系未发生性状的变化。高、低温稳定性分析结果表明,在食品正常使用和保存温度范围内,空白微乳与黄酮微乳体系均可以很好地保持原有性状。
刺五加叶黄酮提取物对·OH、O2-·及DPPH自由基均有较好的清除作用,而当用微乳作为刺五加叶黄酮化合物的载体时,其抗氧化能力进一步增强,原因可能是:黄酮类物质含有多个羟基,耐碱性和抗光解能力差,化学性质很不稳定,而用微乳包埋以后,黄酮分子均匀分布在微乳介质中,增加了黄酮分子与被还原物质的生物相容性,接触的效率更高;同时微乳作为黄酮的载体,可以提高黄酮化合物的溶解度,Garti等用荷荷巴油微乳来增溶在水和油中都难溶的营养素番茄红素,结果表明其增溶能力为原来的20 倍[38];此外,羟基数目对黄酮化合物的抗氧化能力有很大的影响,但是黄酮化合物的羟基暴露在外很容易被分解,导致其稳定性变差,微乳包埋保护了黄酮物质的酚羟基,导致黄酮微乳的抗氧化性优于黄酮溶液[39]。抑菌圈实验结果表明刺五加叶黄酮微乳对大肠杆菌、金黄色葡萄球菌、沙门氏菌以及荧光假单胞菌均有较好的抑制作用,并且其作用效果优于刺五加叶黄酮空白对照。其原因除了微乳可提高黄酮类物质的稳定性和保护生物活性外,已有研究证明微乳本身就有较好的抑菌作用[33]。
