加工方式对绿豆蛋白亚基和功能性质的影响
2019-10-30王长远盛亚男冯玉超富天昕
张 舒,王长远,*,盛亚男,冯玉超,富天昕,李 雪
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.国家杂粮工程技术研究中心,黑龙江 大庆 163319)
绿豆别名青小豆,在我国种植历史悠久,是经典的药食同源食品[1]。绿豆营养丰富,其蛋白质含量高于其他常见谷物,且绿豆蛋白富含赖氨酸、亮氨酸和苏氨酸3 种必需氨基酸[2],是优质的植物蛋白。绿豆因具有清热、解毒等功效通常被制作成绿豆汤、绿豆糕、绿豆饼等以供食用,其味道香甜、口感松软,老少皆宜,热处理后的绿豆食用范围更广泛。有研究表明热处理后蛋白质的变化对食品的风味以及感官特性会形成有利影响[3],刘琳琳等[4]发现微波加热过程中可能造成蛋白质分解,降解成可溶性小分子物质,使溶解度增大。Lertittikul等[5]的研究表明热加工可能会降低可溶性蛋白分子间作用力,使蛋白丧失凝胶能力,分子质量出现不同程度的下降,分子柔顺性加大,从而使蛋白的起泡性和泡沫稳定性升髙;Chandrasiri等[6]发现热处理会导致蛋白质发生氧化,引起蛋白质的基本理化性质以及功能特性发生改变。
食品中常用的3 种热处理方式分别为湿热、干热以及微波加热[7-9],生活中绿豆的加工多采取湿热法,最常见的即为蒸制和煮制,研究表明对绿豆进行适当的热处理会使其蛋白的溶解性、表面性质、持水性、凝胶性以及热稳定性等功能性质得到改善[10]。基于此,本实验以蒸制和煮制两种热处理后的绿豆为原料提取蛋白,并对绿豆蛋白的结构和功能性质进行测定,探讨两种湿热处理加工方式对绿豆蛋白功能性质及结构的影响,以期找到绿豆的最适加工方式,使其在食品体系中具有良好风味及功能性质。为绿豆蛋白的改性提供理论依据,对促进绿豆蛋白在食品行业中的应用以及绿豆产品的精深加工具有参考意义。
1 材料与方法
1.1 材料与试剂
绿豆、大豆油为市售;牛血清白蛋白、盐酸、氢氧化钠、磷酸氢二钠、磷酸二氢钠、福林-酚试剂,均为国产分析纯。1-苯胺基-8-萘磺酸、丙烯酰胺、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Tris、过硫酸铵、甘油、尿素、β-巯基乙醇、乙二胺四乙酸 美国Sigma公司;蛋白Marker(SM0431) 立陶宛Fermentas Life Sciences公司;考马斯亮蓝G250 天津市科密欧化学试剂厂。
1.2 仪器与设备
TG16-WS离心机 长沙湘仪有限责任公司;DELTA 320精密pH计 梅特勒-托利多仪器(上海)有限公司;Alpha 1-2 LD plus冷冻干燥机 德国Christ公司;A360型紫外-可见分光光度计 翱艺仪器(上海)有限公司;HHS-21-6数显恒温水浴锅 上海博迅实业有限公司医疗设备厂;DGG-9140电热恒温鼓风干燥箱上海森信实验仪器有限公司;Quintik 224-1CN电子天平赛多利斯科学仪器(北京)有限公司;Mini-Protean 4电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 绿豆的热加工
将绿豆清洗去除杂质,然后置于清水中浸泡10 h,对浸泡好的完整绿豆进行常压蒸制以及常压煮制加工,常压蒸制和煮制均在100 ℃下进行,加工时间均分别为10、15、20、25、30 min。
1.3.2 绿豆蛋白的提取
将加工后的绿豆放入烘干箱烘干至恒质量,然后将烘干的各组绿豆粉碎机粉碎,过80 目筛,放入烧杯中与石油醚以1∶5(m/V)的比例混合,在搅拌机的搅拌下脱脂2~3 次,每次5 h,脱脂完成之后将绿豆粉晾干装入袋中备用。绿豆蛋白的提取采用碱提酸沉法进行,参照安家静等[11]的实验方法,并略加改动:绿豆粉与蒸馏水按1∶10(m/V)的比例混合,用1 mol/L NaOH溶液调节pH值至10.0,50 ℃水浴中搅拌提取60 min,以3 500 r/min离心20 min取上清液;用1 mol/L HCl溶液将上清液的pH值调至等电点,静置1 h,之后3 500 r/min离心20 min,取沉淀进行冷冻干燥,于-20 ℃贮存备用。
1.3.3 等电点的测定
根据蛋白质在等电点处溶解性最低的原理,采用福林-酚法[12]在650 nm波长处进行绿豆蛋白等电点的测定。
1.3.4 持水性、持油性的测定
取0.5 g绿豆蛋白,加入20 mL的蒸馏水混匀,振荡,静置20 min后于3 000 r/min下离心30 min,测定上清液的体积,体积减少的量即为样品吸附水的量(即样品吸附水的体积)。
取0.5 g绿豆蛋白,加入10 mL大豆油混匀,振荡,静置20 min后于3 000 r/min下离心30 min,测定上清液体积,体积减少量即为样品的吸附油的量(即样品吸附油的体积)[13]。
1.3.5 乳化性、乳化稳定性的测定
将20 mL质量浓度3 g/100 mL的蛋白溶液(pH 7.0)倒入烧杯中,室温下均质30 min,加入40 mL大豆油均质2 min,迅速将乳化液倒入100 mL离心管中,2 700 r/min离心5 min,测量乳化层体积(V1),将上述方法所得混合液80 ℃保温30 min,冷却至室温后2 700 r/min离心5 min,取出测量乳化层体积(V2)[14]。乳化性和乳化稳定性分别按式(1)、(2)计算。

1.3.6 起泡性、泡沫稳定性的测定
参考Agyare等[15]的方法,并选择适当条件进行测定:取100 mL质量浓度为1 g/100 mL的蛋白溶液,用自动搅拌机均质30 min,快速移至100 mL量筒中,记录泡沫所占的体积V0,将该量筒放在30 ℃水浴锅中静置30 min后,记录泡沫的残留体积V1,起泡性和泡沫稳定性分别按式(3)、(4)计算。

1.3.7 溶解性的测定
参照贺建华等[12]的实验方法,并进行适当调整,以牛血清白蛋白绘制标准曲线,标准曲线方程为:y=0.204 3x+0.000 2(R2=0.996 9)。然后测定不同加工条件下绿豆蛋白的吸光度。0.5 g样品加入到100 mL的0.05 mol/L磷酸盐缓冲液(pH 7.0)中,搅拌30 min后静置,3 000 r/min离心20 min[16],取1 mL上清液加入试管中,然后分别加入1 mL碱性铜溶液和4 mL福林-酚试液,立即摇匀,于55 ℃的水浴中准确反应5 min,取出后置于冷水浴中反应10 min,于650 nm波长处测定吸光度。按式(5)计算溶解度。

1.3.8 SDS-PAGE测定
用0.1 mol/L NaOH溶液将绿豆蛋白溶解,蛋白质量浓度为0.5 mg/mL,然后向其中加入等量的上样缓冲液,沸水浴5~8 min使蛋白质热变性。蛋白质上样量为10 μL,浓缩胶质量分数5%,分离胶质量分数12%。SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)具体步骤:首先用80 V电压电泳至条带位于浓缩胶和分离胶分界处,然后加压至120 V,条带在分离胶底端处停止电泳。用考马斯亮蓝G250对绿豆蛋白进行染色,之后用洗脱液洗脱[17]。
1.4 数据统计分析
实验均进行3 次平行,数据处理采用Excel 2013软件进行分析和作图,采用SPSS Statistics 24.0软件中的独立样品T检验法进行数据显著性分析(P<0.05)。
2 结果与分析
2.1 绿豆蛋白的等电点
由图1可知,当pH值为4.5时吸光度达到最低,说明此pH值下离心上清液中蛋白质的含量最低,则未加工绿豆蛋白的等电点为pH 4.5。对蒸制和煮制后的绿豆进行蛋白提取时发现,热处理后绿豆蛋白的等电点也会发生变化,这与曾剑华等[18]的观点一致。在碱提酸沉过程中,碱性pH值控制在9.5~10.0的范围,酸性pH值控制在4.5~4.9范围时,可提取出热处理后的绿豆蛋白。这种情况可能是因为对整个绿豆体系进行热加工处理后,随着加工时间和方式的改变,绿豆蛋白的结构会发生变化[19],导致蛋白质分子与大分子物质及小分子活性物质之间产生相互作用,从而使绿豆蛋白的等电点发生改变。

图1 未加工绿豆蛋白等电点Fig. 1 Isoelectric point of raw mung bean protein
2.2 持水性和持油性分析
蛋白质的持水性是指蛋白质与水直接作用后吸收水分的能力,持油性是指蛋白质在一定条件下保持油脂的能力[20]。蛋白的持水性和持油性与食品储藏过程中的“保鲜”及“成型”有密切关系。
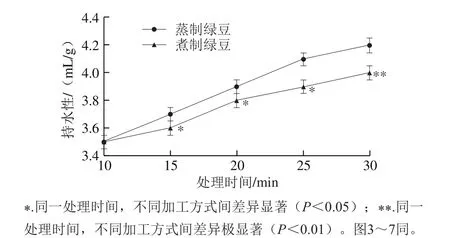
图2 蒸制和煮制处理绿豆蛋白的持水性Fig. 2 Water-holding capacity of steamed or boiled green bean protein
由图2可见,未经加工绿豆蛋白的持水性为3.4 mL/g,处理30 min时,蒸制绿豆蛋白的持水性增加了23.5%,煮制绿豆蛋白的持水性增加了17.6%。随加工时间的延长,蒸制和煮制处理的绿豆蛋白的持水性均不断增大,但两种处理的绿豆蛋白在初始时持水性差异并不显著(P>0.05),随着时间的延长,两种处理的持水性差异显著(P<0.05),在30 min时两种处理方式呈极显著差异(P<0.01)。由图2可知,蒸制绿豆蛋白的持水性要高于煮制绿豆蛋白。出现这种情况的原因可能是热处理使绿豆蛋白的内部空间结构发生改变,肽链展开,内部疏水基团暴露出来,同时水分子的运动速率加快,分布更加均匀,促进蛋白质和水分子发生相互作用,减少蛋白之间的缔合和收缩,呈现较高程度的水化和膨胀[21]。但蒸制过程中水分子的供应量较均衡,而煮制过程中水分供应充足,过多的水分使得暴露的疏水基团主要用来维持蛋白聚集,从而使得疏水基团暴露量少于蒸制。故使得长时间后两种处理持水性差异增大。
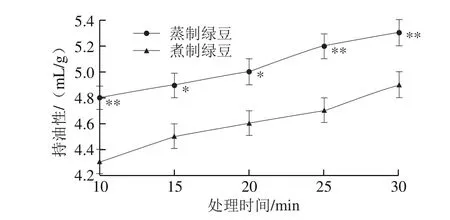
图3 蒸制和煮制处理绿豆蛋白的持油性Fig. 3 Oil-holding capacity of steamed or boiled mung bean protein
由图3可知,未经加工的绿豆蛋白的持油性为4.0 mL/g,处理30 min时,蒸制绿豆蛋白的持油性增加了32.5%,煮制绿豆蛋白的持油性增加了22.5%。随加工时间的延长,蒸制和煮制处理的绿豆蛋白的持水性均不断增大,两种处理的绿豆蛋白的持油性差距较恒定,蒸制绿豆蛋白的持油性要显著高于煮制绿豆蛋白(P<0.05)。随着热处理时间的延长,蛋白质的内部空间结构改变或被破坏,肽链展开[19],油在蛋白质中的分布更加均匀,增加了蛋白质和油分子间的相互作用[22-23]。蒸制与煮制后的绿蛋白相比较,蒸制的持油性要高,这可能是因为蒸制处理后蛋白内部的极性基团对油的结合速率更快,程度更高。周小泉[24]对菜籽蛋白进行干热加工处理后发现随着时间的延长,菜籽蛋白的持油性呈现先下降后上升的趋势,可能是因为与豆类蛋白相比菜籽蛋白的成分十分复杂,蛋白的分子质量和颗粒度较大,在较短时间内菜籽蛋白不易于分散到油脂界面[25]。
2.3 乳化性和乳化稳定性分析
乳化性是指蛋白质将油和水结合在一起形成乳状液的能力,乳化稳定性是指油-水乳状液保持稳定的能力[26]。影响乳化性的因素有很多,如蛋白质分子质量、蛋白表面疏水性以及空间阻碍等[27]。

图4 蒸制和煮制处理绿豆蛋白的乳化性Fig. 4 Emulsifying capacity of steamed or boiled green bean protein

图5 蒸制和煮制处理绿豆蛋白的乳化稳定性Fig. 5 Emulsion stability of steamed or boiled green bean protein
图4 、5分别为蒸制和煮制两种加工方式对绿豆蛋白乳化性、乳化稳定性的影响。绿豆蛋白乳化性、乳化稳定性分别为42.3%、50.1%。处理30 min时,蒸制绿豆蛋白的乳化性、乳化稳定性分别增加了19.9%、20.8%,煮制绿豆蛋白的乳化性、乳化稳定性分别增加了18.9%、19.0%。由图4、5可知,随着热处理时间的延长,两种处理绿豆蛋白的乳化性和乳化稳定性均呈上升趋势,且蒸制绿豆蛋白乳化性显著大于煮制绿豆蛋白(P<0.05),差距较稳定;两种处理的绿豆蛋白在不同时间下的乳化稳定性均差异显著(P<0.05),在加工20 min时蒸制绿豆蛋白的乳化稳定性要极显著高于煮制(P<0.01)。彭伟伟[28]在热处理豌豆蛋白时发现当处理温度在100 ℃左右,乳化性从11.26 m2/g增加到17.88 m2/g,乳化稳定性从14.28 min增加到32.90 min,均显著增高,与本实验研究结果一致。
上述情况的出现可能是因为热处理过程中,绿豆蛋白分子的柔顺性提高、疏水性增强,从而导致乳化性提升。王金梅[29]发现90 ℃和120 ℃处理后蛋白的乳化性上升,且蛋白表面压均与时间呈线性关系,通过小角X光散射证明蛋白在加热处理后确实具有更加柔性的构象。热处理后,绿豆蛋白由于氢键的断裂导致疏水作用的形成以及亲水基团和疏水基团分布发生改变[30],加速了蛋白质与小分子生物活性物质(如酚类化合物、糖、多肽等)的相互作用,形成了多层蛋白吸附膜,使蛋白质降低油-水界面张力的能力增强,继而使蛋白质的乳化性增强[31]。而随着热处理时间的延长,蛋白质展开使蛋白分子柔韧性增强,从而可以更快地吸附在表面,从而使热处理后绿豆蛋白的乳化稳定性增强。利用蛋白质的乳化性和乳化稳定性可以将绿豆蛋白应用于牛奶、烘焙食品、冷冻食品、汤类食品以及食品添加剂中。
2.4 起泡性和泡沫稳定性分析
起泡性是蛋白质搅打起泡的能力,泡沫稳定性是泡沫保持稳定的能力。起泡性是由于蛋白质能够降低气-液界面的张力来推动空气与液体相结合所至,并通过吸附在气-液界面形成保护膜从而使泡沫稳定存在[32]。
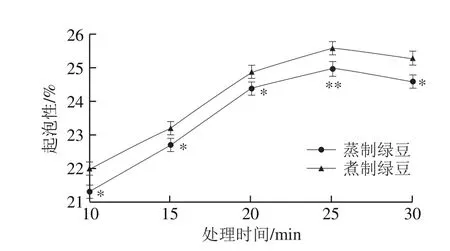
图6 蒸制和煮制处理绿豆蛋白的起泡性Fig. 6 Foaming capacity of steamed or boiled green bean protein

图7 蒸制和煮制处理绿豆蛋白的泡沫稳定性Fig. 7 Foam stability of steamed or boiled green bean protein
图6 、7为蒸制和煮制两种加工方式对绿豆蛋白起泡性和泡沫稳定性的影响。随着热处理时间的延长,两种处理的绿豆蛋白起泡性和泡沫稳定性均呈先上升后下降的趋势,且两种处理之间总体呈显著性差异(P<0.05),煮制绿豆蛋白起泡性和泡沫稳定性均大于蒸制绿豆蛋白。两种性质均在处理25 min时达到最佳,且在25 min时煮制绿豆蛋白的起泡性极显著高于蒸制绿豆蛋白(P<0.01),而30 min时两种处理的泡沫稳定性无显著性差异(P>0.05)。绿豆蛋白的起泡性为20.1%,在25 min时蒸制和煮制绿豆蛋白的起泡性分别为25.0%、25.6%,两种处理的绿豆蛋白的起泡性分别增加了24.4%、27.4%,该性质呈上升趋势可能是因为热处理一方面可能会使绿豆蛋白肽链柔软程度增加,分离的蛋白聚成了小分子亚基[33],增加了空气-水界面的蛋白质的分子数量,使蛋白分子在空气-水界面展开吸附并形成网络更加简单;另一方面热处理会使更多的疏水性氨基酸暴露,疏水相互作用和—SH向—S—S—的交换反应增加[34],从而提高蛋白与空气结合的能力,进而提高起泡能力。夏宁[35]发现采用喷射蒸煮处理大米后,大米蛋白的起泡性和泡沫稳定性也显著提高,与本研究结果一致。热处理时间继续延长时,两种性质均呈下降的趋势,可能是绿豆蛋白肽链柔软程度减弱造成的,故起泡能力随之减弱。van der Plancken等[36]也认为适当的热加工处理可以改善蛋白质的起泡能力。
绿豆蛋白泡沫稳定性为55.4%,蒸制和煮制的绿豆蛋白泡沫稳定性在25 min时分别为75.7%和77.1%,泡沫稳定性分别提高了36.6%、39.2%。整体看来,煮制绿豆蛋白的两种性质均大于蒸制绿豆蛋白,这可能是因为蛋白质同时含有单体分子和蛋白聚集体,两种热处理后大分子蛋白分解成可溶性小分子蛋白,蛋白的溶解度上升,故前期泡沫稳定性呈上升趋势。后期蛋白质溶解度降低,气泡黏度、厚度、强度变弱,因此稳定性也随之下降。乔立文[37]发现热处理6.5 min前全蛋液的泡沫稳定性增加,之后下降,同样认为是蛋白及其复合物分解使泡沫稳定性下降。适宜的起泡性和泡沫稳定性可以赋予食品疏松的结构和良好的口感,因此可用于加工奶油、蛋糕、冰激凌等泡沫型的产品。
2.5 溶解性分析
蛋白质的溶解性是指蛋白质在水溶液或盐溶液中溶解的能力。通过溶解性可判断蛋白质的变性以及聚集情况,溶解性是蛋白质可应用性的一个很重要的指标[38]。溶解性好的蛋白质易于食品的加工利用,如利用蛋白质的溶解性可增加饮料的营养价值,具有不影响透明度、提高黏度等优点。
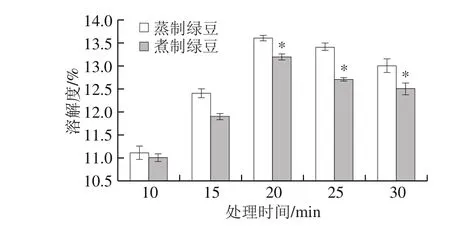
图8 蒸制和煮制处理绿豆蛋白的溶解性Fig. 8 Solubility of steamed or boiled green bean protein
由图8可知,蒸制和煮制两种加工方式下绿豆蛋白的溶解性均随着时间的延长呈先上升后下降的趋势,在20 min时,溶解性达到最佳,蒸制绿豆蛋白的溶解度为13.6%,煮制绿豆蛋白的溶解度为13.2%,且蒸制改性的绿豆蛋白溶解度在20 min后要显著优于煮制(P<0.05)。绿豆蛋白溶解度为9.8%,蒸制绿豆蛋白的溶解度增加了38.8%,煮制绿豆蛋白的溶解度增加了34.7%。在热处理过程中,初期大分子蛋白质降解成可溶性小分子蛋白质,使溶解度上升。随着加热时间的延长,一方面可溶性小分子蛋白聚集成了大分子蛋白质;另一方面变性的蛋白质可能会和小分子等活性物质结合产生某种不溶聚集物,从而导致溶解度降低[39]。李爽[40]对葵花分离蛋白进行热处理改性,发现热处理后完全变性的蛋白质二硫键含量增多,溶解度下降,与本实验加工20 min后的结果一致,可能是因为在20 min内,蒸制和煮制两种加工方式均未使绿豆蛋白完全变性,导致溶解度上升。在食品加工过程中,可以适当控制热加工条件,控制大分子聚集物的生成,避免蛋白质的溶解性下降。
2.6 SDS-PAGE分析结果

图9 蒸制加工下绿豆蛋白的SDS-PAGE图Fig. 9 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis of steamed mung bean protein

图10 煮制加工下绿豆蛋白的SDS-PAGE图Fig. 10 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis of boiled mung bean protein
图9 中泳道6、图10中泳道1均为绿豆蛋白的条带,均有5 个亚基条带,分子质量分别为61.7、57.5、50.1、25.1 kDa和19.5 kDa,与曾志红等[41]研究结果一致。
相同加工方式下,随着热处理时间的延长蛋白条带和含量都发生了变化,大分子质量的亚基条带颜色变浅,小分子质量的亚基条带颜色略加深,即大分子蛋白降解成小分子蛋白;条带II为8S球蛋白,随着时间延长逐渐消失。这可能是热处理使蛋白质的内部结构破坏,肽链展开断裂,分解成为小分子蛋白造成的,这与蛋白的功能性质相对应;也可能是因为随着热处理时间的延长,蛋白质和小分子等活性物质发生相互作用,导致亚基条带变浅。Gambuti等[42]发现唾液蛋白与单宁结合互作后,蛋白质的亚基条有明显变浅的趋势。两种处理相比,煮制绿豆蛋白增加了一条分子质量为35.4 kDa的条带VI;而蒸制绿豆蛋白未出现该条带,只是原有的小分子条带灰度变浅,含量降低。一方面可能是因为大分子蛋白降解成该分子质量的蛋白;另一方面可能是因为大分子蛋白降解成小分子蛋白,小分子蛋白重新聚集,出现新分子质量的蛋白。曾志红等[41]发现未进行加工的河南毛绿豆品种蛋白具有6 条亚基条带,多了一条分子质量为39.5 kDa的亚基条带,与本实验煮制绿豆蛋白中增加的亚基条带分子质量相似。蒸制绿豆蛋白的功能性质普遍比煮制绿豆蛋白的功能性质好,也可能是因为大分子蛋白更多地分解成了游离的分子质量较小的蛋白。
3 结 论
本研究通过蒸制和煮制两种热处理方式对绿豆进行加工,采用碱提酸沉法提取绿豆蛋白,并对热处理后的绿豆蛋白进行结构和功能性质的测定,SDS-PAGE分析发现,蒸制和煮制的绿豆蛋白中大分子蛋白亚基条带灰度随热处理时间的延长均变浅,即其含量均减少;随着热处理时间的延长,8S球蛋白所在的II亚基条带逐渐消失;两种处理相比,煮制绿豆蛋白增加了一条分子质量为35.4 kDa的条带VI;而蒸制绿豆蛋白未出现该条带。功能性质研究中发现,两种处理的绿豆蛋白的功能性质均得到改善,优于未处理的原绿豆蛋白。与原绿豆蛋白比较,处理结束时蒸制和煮制的绿豆蛋白其持水性分别增加了23.5%、17.6%,持油性分别增加了32.5%、22.5%,乳化性分别增加了19.9%、18.9%,乳化稳定性分别增加了20.8%、19.0%,起泡性分别增加了24.4%、27.4%,泡沫稳定性分别增加了36.6%、39.2%。溶解性分别增加了38.8%、34.7%。蒸制与煮制相比较,除起泡性、泡沫稳定性外,蒸制绿豆蛋白的功能性质均高于煮制绿豆蛋白。
综上所述,蒸制和煮制两种热处理,会使绿豆蛋白中大分子蛋白降解成小分子蛋白;煮制处理的绿豆蛋白中还出现分子质量为35.4 kDa的蛋白。蒸制和煮制的热处理方式会使绿豆蛋白功能性质得到改善,使其更有益于食品的加工以及提升绿豆制品的食味品质,且蒸制比煮制能更好地提升绿豆蛋白的功能性。研究中还发现热处理会使绿豆蛋白的等电点发生改变,变化范围在0.5左右,对熟制蛋白进行提取时,pH值要适当调整。
