PELP1 激活Ras-Raf-MEK-ERK 信号通路调控牙周膜干细胞成骨分化
2019-10-22孙琼严妍刘彦
孙 琼 严 妍 刘 彦
牙周膜干细胞(human periodontal ligamentstem cell,hPLSC)是一类取材于根周膜的间充质来源的干细胞[1],在不同条件的诱导下,它可以分化为成骨细胞、脂肪细胞、软骨细胞以及胶原形成细胞,在牙槽骨的缺损修复当中发挥了重要作用。干细胞的成骨分化受各种不同的信号通路调控,其中ERK/MAPK 信号通路是调控干细胞成骨分化的一个很重要的信号通路[2]。在我们课题组的前期研究中发现,维生素C 能够通过PELP1-ERK 信号轴调控牙周膜干细胞的成骨向分化[3]。外源性转染PELP1 过表达的质粒同样能够促进牙周膜干细胞内成骨相关基因的表达。那么,在PELP1 调控牙周膜干细胞成骨基因上调的同时,Ras-Raf-MEKERK 信号通路是否也发生了变化呢?所以本研究以牙周膜干细胞为模型,探讨PELP1 调控牙周膜干细胞成骨基因变化的同时,对Ras-Raf-MEK-ERK信号通路的影响。
1.材料和方法
1.1 主要材料和试剂 DMEM 培养基、Opti-MEM 培养液、胎牛血清(Gibico,美国);Dispase酶、I 型胶原酶、Trice-HCl、TEMED、β-甘油磷酸钠、维生素C、蛋白酶抑制剂、磷酸酶抑制剂、地塞米松(Sigma,美国);胰蛋白酶(Amresco,美国);BAD 蛋白定量试剂盒(Thermo,美国);RIPA 裂解液、脱脂奶粉、辣根过氧化物酶标记的IgG、Ras、Raf、p-MEK、MEK、GAPDH、ERK、P-ERK 抗体和辣根过氧化物酶标记的羊抗兔IgG(CST,美国);无水甲醇(北京化工厂,中国);30%丙烯酰胺(碧云天,中国);10%SDS、Lipofectmine 2000TM、PELP1 siRNA(Invitrogen 美国);过硫酸铵(上海生工,中国);显影液、定影液(普利莱,中国)。
1.2 主要仪器 T225 细胞培养瓶、6 孔板、10cm 以及6cm 细胞培养皿(Costar,美国);二氧化碳恒温培养箱(Thermo,美国);超净工作台(苏州净化设备仪器厂,中国);Mini Protein II 蛋白电泳仪、棉垫以及半干转膜仪(Bio-Rad,美国)。
1.3 牙周膜干细胞的分离、培养 参考Seo[1]等学者的实验方法,与课题组前期发表的文章[3]中方法一致,选取新鲜拔除的健康第三磨牙(所选患者年龄在18~30 岁)根中1/3 处的牙周膜组织原代培养,采用单克隆法获取原代牙周膜干细胞。接种至装有10%胎牛血清(体积分数)的DMEM 培养基中,置于恒温培养箱培养(5%CO2,100%饱和湿度)。长满约80%左右时,0.25%的胰酶消化,1∶3 传代培养。本研究所用的细胞为第3 代干细胞。本研究的实验分为两部分:第一部分为PELP1 过表达实验,实验组为转染了pIRES2-EGFP-PELP1 过表达载体的牙周膜干细胞,对照组为转染了了pIRES2-EGFP 的牙周膜干细胞。第二部分为PELP1 的抑制实验。实验组为转染了对照的si RNA 的牙周膜干细胞,对照组为转染了PELP1 siRNA 的牙周膜干细胞。
1.4 PELP1 过表达载体的转染 本研究使用的pIRES2-EGFP-PELP1 过表达载体为课题组所构建。如表1 所示:按照实际情况,将不同浓度的PELP1 过表达质粒转染至牙周膜干细胞48h 后收集细胞。

表1 不同转染培养器转染液组分
1.5 PELP1 siRNA 转染 如表1 所示,将适量PELP1 siRNA 溶于Opti-MEM 培养液中充分混匀;同时将LipofectAmineTM2000 分散于等体积Opti-MEM 培养液中混匀5min;两液相混匀,室温放置25min。弃细胞培养液,PBS 洗涤三次后,换Opti-MEM 培养液。将转染液缓缓转入培养板中,细胞培养箱中孵育6h。弃转染液,加入成骨诱导液继续培养48h 后收集细胞。
1.6 细胞总RNA 的提取以及qRT-PCR 检测 用Trizol 法分别提取细胞总RNA,检测不同样本的含量和纯度后,依照反转录试剂盒的说明书将提取的RNA 反转录成cDNA,1∶10 倍稀释待用。利用表2 中设计的引物进行qRT-PCR 检测。

表2 qRT-PCR引物
1.7 细胞总蛋白的提取以及western blot 检测以蛋白裂解法提取细胞总蛋白后,用BAD 蛋白定量试剂对提取蛋白进行定量。100℃变性10min 后,12%SDS 胶电泳后将分离的蛋白转移至0.45μm PVDF 膜后,5%脱脂奶粉封闭1h 后,分别加入一抗PELP1(1∶2500)、Ras(1∶1000)、p-c-Raf(1∶1000)、c-Raf(1∶1000)、p-MEK(1∶100)、MEK(1∶1000)、p-ERK(1∶1000)、ERK(1∶1000)4℃过夜,TBST 洗涤后,二抗室温孵育1h 后,暗室曝光检测。
1.8 统计学分析 采用SPSS17.0 软件对数据进行单因素方差分析,P<0.05 为差异有统计学意义。所有的实验步骤至少重复三次。
2.结果
2.1 pIRES2-EGFP-PELP1 质粒转染至牙周膜干细胞后PELP1 以及成骨相关基因的表达qRT-PCR 结果显示(表3),PELP1 过表达质粒pIRES2-EGFP-PELP1 转染至牙周膜干细胞48h后牙周膜干细胞胞内PELP1 基因mRNA 水平显著升高,约为空载对照组基因表达水平的3200 多倍。骨形成相关指标Runx2、ALP 和OCN 的表达水平也显著升高。较空质粒对照组分别较对照组约增加4.7 倍、2.3 倍和2.3 倍。其差异具有显著统计学差异(P<0.01)。
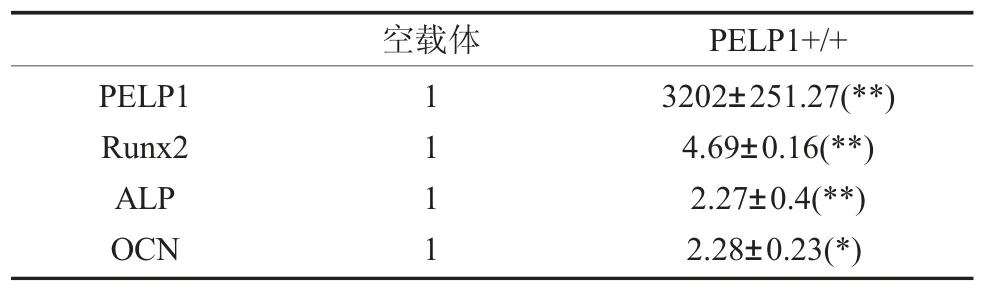
表3 重组质粒pIRES2-EGFP-PELP1 处理hPDLSCs 48h 后,PELP1 以及成骨相关指标Runx2、ALP 和OCN基因水平的变化
2.2 PELP1 siRNA 转染至牙周膜干细胞后PELP1 以及成骨相关基因的表达 qRT-PCR 结果显示(表4),PELP1 siRNA 转染至牙周膜干细胞48h 后牙周膜干细胞胞内PELP1 基因mRNA 水平显著下降,约降低至mock 对照组表达水平的33%。骨形成相关指标Runx2、ALP 和OCN 的表达水平也显著降低。分别约降低至mock 对照组的24%、44%和57%。其差异具有显著统计学差异(P<0.01)。
2.3 牙周膜干细胞内PELP1 蛋白的变化对Ras-Raf-MEK-ERK 信号通路的影响 Western blot 结果显示,PELP1 siRNA 处理牙周膜干细胞48h 后(图1A),牙周膜干细胞内PELP1 水平的下降抑制了ERK 的磷酸化。当PELP1 过表达质粒转染48h 后(图1B),PELP1 基因水平的上调激活了ERK 的磷酸化。并且,牙周膜干细胞胞内PELP1基因的表达被抑制时,Ras 的表达水平也是被抑制的,同时Ras 的下游激酶c-Raf 和MEK 的活性同样被抑制(图1A)。反之,增加牙周膜干细胞内PELP1 蛋白的表达不仅能够促进Ras 的表达,同时还能够激活c-Raf 和MEK 的活性(图1B)。
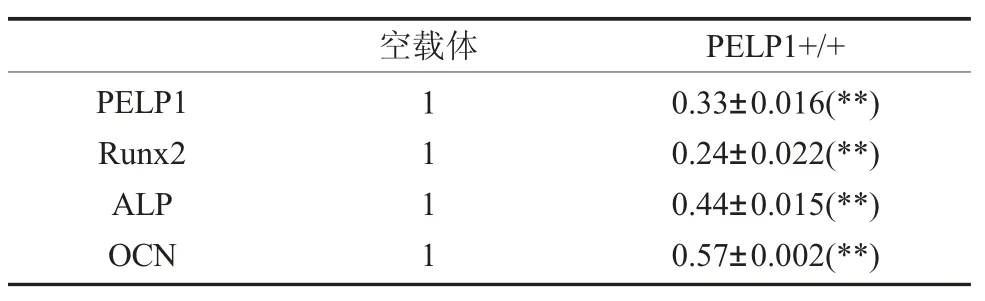
表4 PELP1 siRNA 处理hPDLSCs 48h 后,目标基因PELP1 基因以及成骨相关指标Runx2、ALP 和OCN基因水平的变化
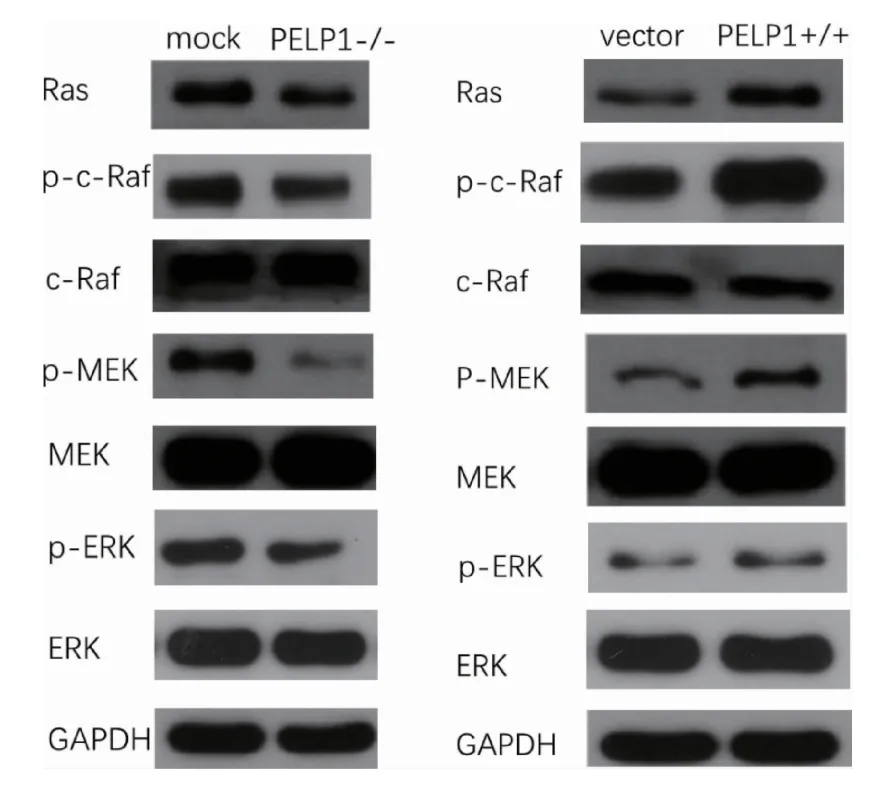
图1 PELP1 siRNA
3.讨论
炎症、外伤、肿瘤以及面部先天畸形等疾病能够导致牙槽骨的吸收甚至缺损,严重影响患者的口颌系统乃至身心健康[4]。牵张成骨、异体或自体骨的移植、以干细胞为基础的组织工程学方法[5,6]是临床上常用的牙槽骨缺损修复的方法。随着干细胞研究的深入,学者们希望通过探讨生物因子调控干细胞的定向分化而获得组织缺损的修复再生,其中牙周膜干细胞是一类来源于根周膜的间充质来源的干细胞,它在牙周组织的再生修复过程中发挥了重要作用[7]。
在我们的前期研究中发现,维生素C 能够通过PELP1-ERK 信号轴促进牙周膜干细胞的成骨分化[3]。而PELP1 蛋白[8]被认为是一种雌激素受体的共调节因子,它能够广泛表达于雌激素相关的器官及肿瘤中。在王婧等学者的研究中发现PELP1 蛋白在鼠的牙周组织及鼠的牙周膜细胞中是有表达的,并且外源性雌激素的摄入能够上调PELP1 的表达[9]。所以PELP1 蛋白对牙周膜干细胞成骨分化的调控作用引起了我们的兴趣。为此我们通过构建的PELP1 过表达载体上调牙周膜干细胞胞内PELP1 的基因表达水平时发现成骨相关基因的表达也是显著上调的(见表3),当抑制牙周膜干细胞胞内PELP1 基因水平的表达时我们得到相反的结论(见表4)。这提示PELP1 蛋白可能本身就能够调控牙周膜干细胞的成骨分化。于是,它调控牙周膜干细胞成骨分化的机制引起了我们的兴趣。
目前的研究已知PELP1 蛋白一方面能够直接与雌激素受体相互作用发挥相应的基因信号功能[8],另一方面它还能够通过调控如Src-MAPK 等信号通路发挥非基因信号功能[10,11]。在胚胎干细胞分化过程中,ERK-MAPK 信号通路是调控细胞分化的一个关键因素[12],在细胞成骨分化过程中,FGFs家族的成员能够与细胞表面的膜受体相结合,激活下游MAPK 等信号通路发挥相应的功能[13]。同样,在我们的研究中发现,当牙周膜干细胞胞内PELP1蛋白水平高表达时,ERK 被激活,反之则得到相反的结论(见图1)。由于Ras-MAPK 是一种保守的信号通路,且Ras-Raf-MEK-ERK 信号通路广泛参与调节细胞的各种生物学行为[14,15]。那么,在PELP1 发挥功能的同时,ERK 的上游激酶Ras-Raf-MEK 是否也发生了变化呢,所以我们探讨了ERK 上游激酶Ras、c-Raf 和MEK 的变化,发现PELP1 蛋白的表达能够促进Ras 的表达和c-Raf和MEK 的磷酸化,反之亦然(见图1)。这一结果提示我们PELP1 可能是通过Ras-Raf-MEK-ERK信号通路调控牙周膜干细胞的成骨分化。然而本研究仅仅是一个初步探讨,其具体的调控机制还有待进一步探讨。
