藜麦抗氧化肽制备工艺研究
2019-10-16杨庆华李文道和继刚
杨庆华 李文道 和继刚
摘要 采用酸性蛋白酶、碱性蛋白酶、木瓜蛋白酶和中性蛋白酶对藜麦蛋白提取液进行酶解制得抗氧化肽,通过单因素试验筛选出最佳蛋白酶。以DPPH自由基清除率为指标,通过响应面试验对酶解条件进行优化,并采用HPLC法对酶解液进行氨基酸种类及含量的测定。结果表明,藜麦抗氧化肽的最佳制备工艺为木瓜蛋白酶、酶解pH值6.63、加酶量2.36%、酶解温度58.44 ℃、酶解时间1.0 h。藜麦抗氧化肽中共含有18种氨基酸,其中丝氨酸的含量最高,为65.46%。
关键词 藜麦;抗氧化肽;酶解;响应面试验;HPLC
中图分类号 TS201.1 文献标识码 A
文章编号 1007-5739(2019)14-0230-03 开放科学(资源服务)标识码(OSID)
Abstract The acid protease,alkali protease,papain and neutral protease were used to prepare antioxidant peptides from quinoa protein extract by enzymatic hydrolysis,and the best protease was screened by single factor test.The DPPH free radical scavenging rate was used to optimize the enzymatic hydrolysis conditions by response surface methodology,the amino acid kinds and contents of the enzymatic hydrolysate were also determined by HPLC.The results showed that the optimal preparation method of antioxidant peptides from quinoa were using papain,enzymatic hydrolysis pH 6.63,dosage of enzyme 2.36%,enzymatic hydrolysis temperature 58.44 ℃,and enzymatic hydrolysis time 60 min.The antioxidant peptides from quinoa contains 18 kinds of amino acids,and the content of serine is up to 65.46%.
Key words quinoa;antioxidant peptides;enzyme hydrolysis;response surface methodology;HPLC
藜麦(Chenopodium quinoa Willd.)又名南美藜、藜谷等,是一种粮食作物,属苋科,原产于南美洲安第斯山脉地区,种植历史悠久[1-2]。我国西藏地区于1987年引进,现已在山西、甘肃、青海等地实现了产业化种植[3]。藜麦含有多种营养物质,其中蛋白质含量为12.9%~16.5%,高于传统的谷物[4]。藜麦中氨基酸含量丰富,含有大多数谷物蛋白缺乏的赖氨酸和精氨酸[5]。藜麦中的黄酮和多酚含量较高,具有较强的抗氧化活性[6],但目前对藜麦抗氧化肽的研究较少。相对于化学法水解蛋白质,蛋白酶酶解法更加安全、快捷、无污染。马永强等[7]采用木瓜蛋白酶对大豆蛋白进行酶解制得大豆小分子肽。于 慧等[8]采用胃蛋白酶对龙须菜蛋白进行酶解,再通过响应面试验来优化龙须菜蛋白的酶解工艺,得出最佳制备条件。本研究以藜麦为原料提取藜麦蛋白,采用4种不同类型的蛋白酶对其进行酶解来制备藜麦抗氧化肽。同时,以DPPH自由基清除率为指标优化蛋白酶酶解条件,并对藜麦抗氧化肽中包含氨基酸的种类及含量进行测定,以期为藜麦活性成分的应用提供参考。
1 材料与方法
1.1 原料与试剂
藜麦,产地山西静乐;酸性蛋白酶、碱性蛋白酶、木瓜蛋白酶和中性蛋白酶均购于合肥博美生物科技有限责任公司;DPPH购于西格玛奥德里奇(上海)贸易有限公司;无水乙醇、盐酸、氢氧化钠、碳酸氢钠、磷酸氢二钾、磷酸二氢钾等其他試剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 供试仪器
供试仪器有1260型高效液相色谱仪、DF-101S型数显恒温水浴锅、AR1140型分析天平、TDZ5-WS型多管架自动平衡离心机、UV-2550型紫外可见分光光度计、101A-1型电热恒温鼓风干燥箱。
1.3 试验方法
1.3.1 藜麦蛋白的提取。将藜麦粉碎后过100目筛,采用95%乙醇,按料液比1∶50在室温下连续反应12 h,烘干得脱脂藜麦粉。准确称取2.00 g脱脂藜麦粉,按料液比1∶30加入去离子水,调节pH值为8.0,在35 ℃下反应1.5 h,离心取上清液,调节pH值至等电点3.5,静置,再次离心,取沉淀物,烘干至恒重,得藜麦蛋白粉。
1.3.2 藜麦抗氧化肽的制备及性能测定。配制5.0%的藜麦蛋白提取液,调节pH值至一定值,加入一定量的酸性蛋白酶、碱性蛋白酶、木瓜蛋白酶或中性蛋白酶,在一定温度下进行酶解,反应结束后,置于沸水中灭酶15 min,待冷却后调节pH值为3.5,离心取上清液冷冻干燥,得藜麦抗氧化肽。取一定量的藜麦抗氧化肽溶于水,滴加适量现配的0.1 mmol/L DPPH溶液,以无水乙醇作为参比,计算DPPH自由基清除率[9]。
1.3.3 藜麦抗氧化肽中氨基酸组成及含量的测定。采用筛选出的最佳蛋白酶对藜麦蛋白进行酶解反应,得相应的藜麦蛋白酶酶解液,对其进行氨基酸的衍生化反应,置于80 ℃水浴中加热,避光反应1 h,待冷却后用磷酸缓冲溶液调其pH值为7.0,定容,经0.45 μm有机相滤膜过滤后进行HPLC分析[10]。
2 结果与分析
2.1 制备藜麦抗氧化肽最佳蛋白酶的选择
采用酸性蛋白酶、碱性蛋白酶、木瓜蛋白酶和中性蛋白酶对藜麦蛋白提取液进行酶解,通过单因素试验考察了酶解pH值、加酶量、酶解温度和酶解時间这4个反应条件对DPPH自由基清除率的影响,从而确定出4种蛋白酶的最佳反应条件。结果表明,4种蛋白酶的最佳酶解条件分别为酸性蛋白酶pH值3.0,加酶量4.0%,温度35 ℃,时间1.0 h;碱性蛋白酶pH值9.0,加酶量3.0%,温度55 ℃,时间2.0 h;木瓜蛋白酶pH值6.5,加酶量2.0%,温度55 ℃,时间1.0 h;中性蛋白酶pH值7.0,加酶量2.0%,温度35 ℃,时间1.5 h。
在4种蛋白酶的最佳反应条件下对藜麦蛋白提取液进行酶解,并对蛋白酶酶解液进行抗氧化活性的测定,结果如图1所示。可以看出,在这4种蛋白酶中,木瓜蛋白酶酶解液的DPPH自由基清除率最高,达到了91.73%;碱性蛋白酶次之;中性蛋白酶最低。因此,本试验采用木瓜蛋白酶对藜麦蛋白进行酶解来制备藜麦抗氧化肽。
2.2 响应面试验优化酶解条件
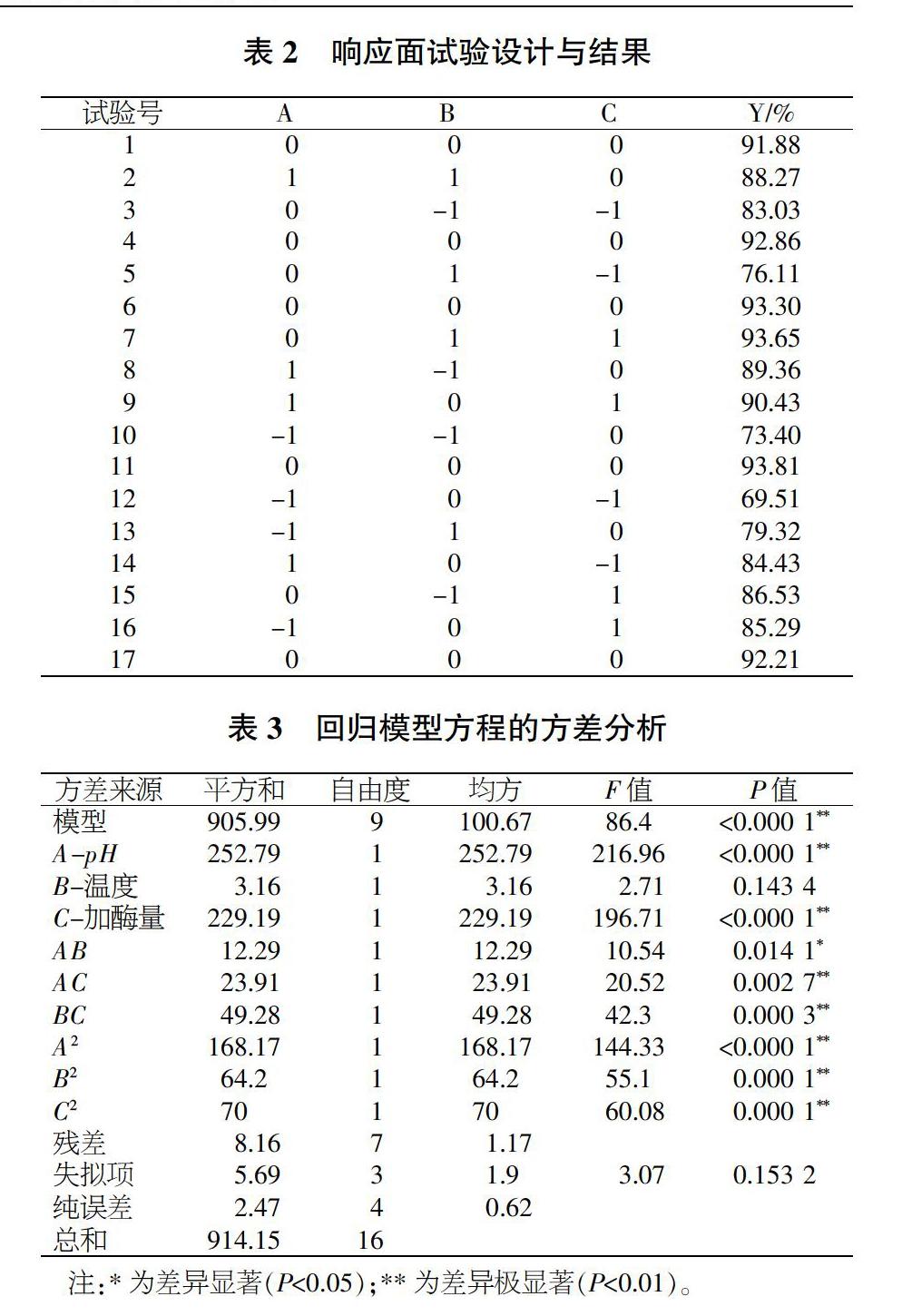
2.2.1 响应面优化的试验设计与结果。在木瓜蛋白酶的单因素试验中,对DPPH自由基清除率影响最显著的3个因素为pH值、酶解温度和加酶量,为进一步优化藜麦抗氧化肽的制备工艺,进行响应面试验。固定酶解时间1.0 h,探究pH值(A)、酶解温度(B)和加酶量(C)对DPPH自由基清除率(Y)的影响(表1),采用Design-Expert系统Box-Behnken试验设计,进行3因素3水平的响应面试验,结果见表2。
采用Design Expert 8.0.6.0软件对表2中数据进行多元回归拟合,获得二次多项回归模型方程:Y=92.81+5.62A+0.63B+5.35C-1.75AB-2.45AC+3.51BC-6.32A2-3.90B2-4.08C2。
2.2.2 响应面回归模型方程的方差分析。为了检验回归模型方程的有效性,进一步确定各因素对藜麦抗氧化肽性能的影响,对回归模型进行了方差分析,结果见表3。可以看出,回归模型的F值为86.4,P值<0.01,模型极显著;失拟项的P值为0.1532>0.05,失拟不显著。表明该模型拟合度较好,可靠性高,回归模型能较好地分析3个因素与响应值之间的关系,试验办法具有可行性。回归模型中F(A)=216.96,F(B)=2.71,F(C)=196.71,说明各因素对DPPH自由基清除率的影响顺序为pH值>加酶量>温度。此外,回归模型方程中一次项A、C,交互项AC、BC和二次项A2、B2、C2对DPPH自由基清除率的影响极显著(P值<0.01);回归模型方程中交互项AB对DPPH自由基清除率的影响显著(P值<0.05);回归模型方程中一次项B对DPPH自由基清除率的影响不显著。
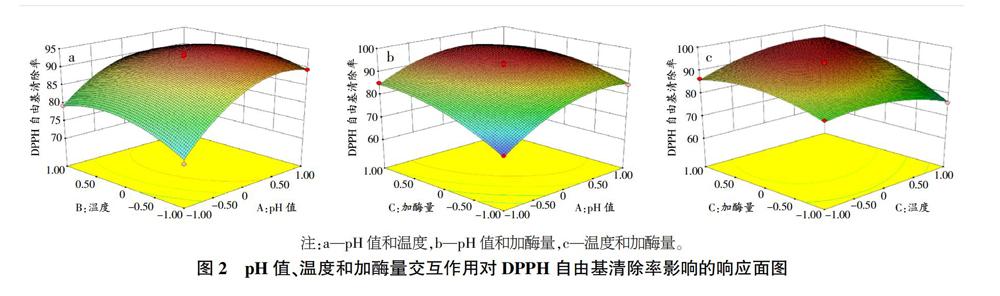
2.2.3 DPPH自由基清除率的响应面分析。由图2可以看出,pH值、温度和加酶量的交互作用对DPPH自由基清除率的影响均呈现先升高后降低的趋势,存在极大值。由图1(a)可知,温度一定时,DPPH自由基清除率随着pH值的增加而增大;当pH值一定时,DPPH自由基清除率随着温度的增加而增大。由图1(b)可知,加酶量一定时,DPPH自由基清除率随着pH值的增加而增大;当pH值一定时,DPPH自由基清除率随着加酶量的增加而增大。由图1(c)可知,当加酶量一定时,温度对DPPH自由基清除率的结果影响不大;当温度一定时,加酶量对DPPH自由基清除率的结果亦影响不大。
综合考虑pH值、温度和加酶量对DPPH自由基清除率的影响,通过响应面试验优化得到藜麦抗氧化肽的最佳制备工艺为酶解pH值6.63、加酶量2.36%、酶解温度58.44 ℃、酶解时间1.0 h,此时DPPH自由基清除率为95.66%。
2.3 HPLC法测定结果分析
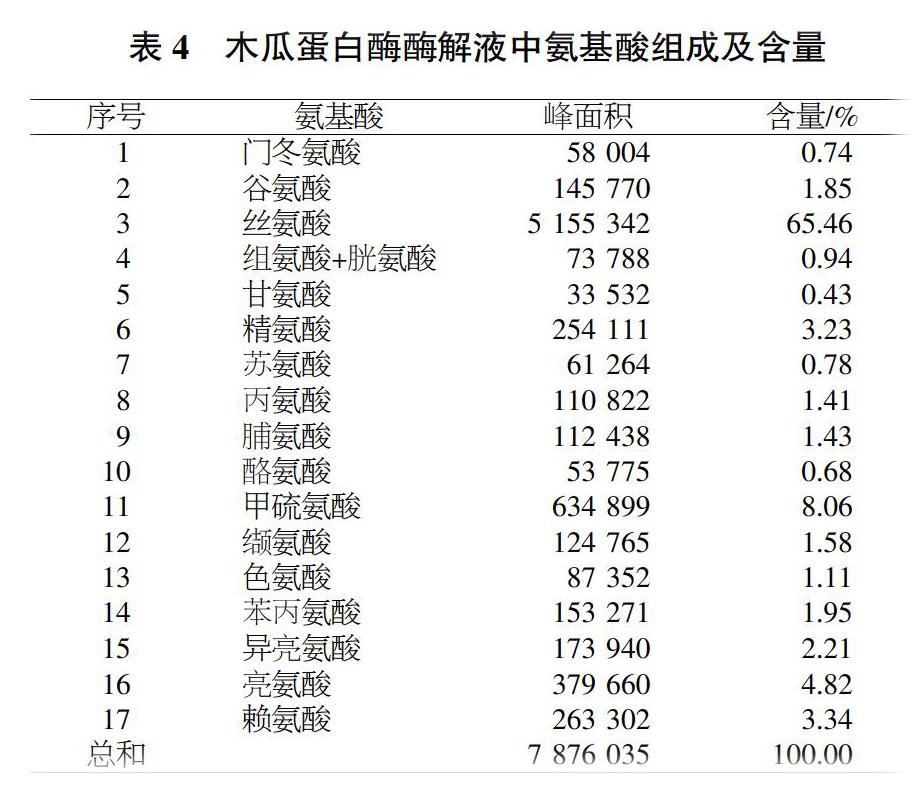
采用木瓜蛋白酶在最佳制备工艺下对藜麦蛋白提取液进行酶解,通过HPLC法对藜麦抗氧化肽中氨基酸的组成及含量进行测定,结果见表4。可以看出,采用木瓜蛋白酶酶解制备的藜麦抗氧化肽中氨基酸种类丰富,共含有18种氨基酸,其中丝氨酸的含量最高,为65.46%;甲硫氨酸含量次之,为8.06%;甘氨酸含量最低,为0.43%。此外,藜麦抗氧化肽还包含大多数谷物蛋白所缺乏的赖氨酸和精氨酸,含量分别为3.34%和3.23%。
3 结论
在酸性蛋白酶、碱性蛋白酶、木瓜蛋白酶和中性蛋白酶的最佳酶解条件下,木瓜蛋白酶酶解液的DPPH自由基清除率最高。通过响应面试验分析,得到各因素对DPPH自由基清除率的影响顺序为pH值>加酶量>温度;藜麦抗氧化肽的最佳制备工艺为酶解pH值6.63、加酶量2.36%、酶解温度58.44 ℃、酶解时间1.0 h,此时DPPH自由基清除率高达95.66%。通过HPLC法测定出藜麦抗氧化肽中共含有18种氨基酸,其中丝氨酸的含量最高,甘氨酸含量最低。
4 参考文献
[1] GRAF B L,ROJASSILVA P,ROJO L E,et al.Innovations in health value and functional food development of quinoa(Chenopodium quinoa Willd.)[J].Comprehensive Reviews in Food Science & Food Safety,2015,14(4):431-445.
[2] 闕淼森,蒋玉蓉,曹美丽,等.响应面试验优化藜麦种子多酚提取工艺及其品种差异[J].食品科学,2016,37(4):7-12.
[3] 任贵兴,杨修仕,么杨.中国藜麦产业现状[J].作物杂志,2015(5):1-5.
[4] MAHONEY A W,LOPEZ J G,HENDRICKS D G.An evaluation of the protein quality of Quinoa[J].Journal of Agricultural & Food Chemistry,1975,23(2):190-193.
[5] 孙雪婷,蒋玉蓉,袁俊杰,等.响应面法优化提取藜麦种子黄酮及抗氧化活性[J].中国食品学报,2017,17(3):127-135.
[6] ABDERRAHIM F,HUANATICO E,SEGURA R,et al.Physical features,phenolic compounds,betalains and total antioxidant capacity of coloured quinoa seeds(Chenopodium quinoa Willd.)from peruvian altiplano[J].Food Chemistry,2015,183:83-90.
[7] 马永强,赵毅,石彦国.大豆蛋白水解物中肽分子分布的研究[J].中国粮油学报,2001,16(3):15-17.
[8] 于慧,刘海梅,李蒙娜,等.响应面法优化龙须菜蛋白酶解工艺及酶解液的抗氧化活性[J].食品工业科技,2017,38(12):157-163.
[9] 邝高波,黄和.番石榴多酚体外抗氧化活性的研究[J].食品工业科技,2014,35(2):111-115.
[10] 刘世凯.籽粒苋籽蛋白和多酚物质的提取及性质研究[D].天津:天津商业大学,2011:12.
