罗非鱼养殖环境中益生菌的筛选
2019-10-16赵光军朱海佟延南
赵光军 朱海 佟延南

摘要 该研究从不同的罗非鱼养殖区域、养殖模式、养殖环境中分别采集样品,经前期处理后得到262株待测菌株。以无乳链球菌为指示菌株,利用琼脂扩散法筛选拮抗菌。通過安全性试验对初筛菌株进行复筛,同时进行16S rDNA分子鉴定。结果显示,初筛得到29株拮抗菌,其中6株对无乳链球菌安全,分属于芽胞杆菌属、假单胞菌属、肠杆菌属3个属。
关键词 罗非鱼;养殖环境;益生菌;筛选
中图分类号 S917.1 文献标识码 A
文章编号 1007-5739(2019)14-0210-02 开放科学(资源服务)标识码(OSID)
Abstract The study collected samples from different tilapia culture areas,culture models and culture environments,and obtained 262 strains after pretreatment.Streptococcus agalactiae was used as an indicator strain to screen antagonistic strain by agar diffusion method.The primarily screened strain was rescreened through a safety test,and the 16S rDNA sequence molecule was simultaneously identified.The results showed that,among 29 primarily screened strains of antagonistic bacteria,6 strains were safe to Streptococcus agalactiae,belonging to the genus Bacillus,Pseudomonas,and Enterobacter.
Key words tilapia;culture environment;probiotics;screening
罗非鱼(Tilapia)自1976年被联合国粮农组织列为优良养殖品种进行推广以来,现已成为世界性的养殖鱼类[1]。中国的罗非鱼养殖产业在世界上占有举足轻重的地位,养殖产量在2017年达到了158.47万t,占全部淡水养殖鱼类的6.14%,是除四大家鱼和鲤鱼、鲫鱼外唯一养殖产量超100万t的淡水养殖鱼类[2]。中国早已成为世界最大的罗非鱼生产国和出口国,且南方的罗非鱼是我国非常重要的养殖品种[3-4]。近几年的链球菌病爆发,导致罗非鱼的产量下降,加之养殖环境恶化,磺胺类、喹诺酮类抗生素等药物的滥用,致使罗非鱼的出口受限,给罗非鱼产业造成了重创[5]。通过环境友好的方式进行链球菌病防控可改善现有状况,为罗非鱼产业的发展起到一定的推动作用。国际益生菌和益生元科学协会将益生菌定义为当达到足够剂量时能够给宿主带来有益影响的活体微生物[6],通过此定义可知,具有改良水质效果、改善水产动物胃肠道、拮抗病原菌等的菌株均可归属为益生菌。利用益生菌进行生物防治,可减少抗生素的使用,避免出现耐药性,达到生态养殖的效果。
1 材料与方法
1.1 试验材料
该研究以无乳链球菌(Streptococcus agalactiae)为拮抗菌筛选的指示菌株,该菌株于2016年从海南琼海某养殖场A的患病罗非鱼中分离获取,且经过分子鉴定,编号QHTY-3。试验所用罗非鱼由海南琼海某养殖场B提供,选用罗非鱼体重200 g左右、规格整齐、体格健壮、体表无损伤。牛肉膏蛋白胨培养基:胰蛋白胨10 g,牛肉浸粉3 g,NaCl 5 g,去离子水1 000 mL,pH值为7.2~7.4;固体培养基为1 000 mL加20 g琼脂;半固体培养基为1 000 mL加10 g琼脂。脑心浸出液培养基(BHI)购自广东环凯微生物科技有限公司。其他试验用试剂耗材均由海南诺琪兰科技有限公司购置。
1.2 样品的采集与前期处理
1.2.1 样品采集。于2017年5月至2018年5月在海南的罗非鱼主养区海口、文昌、琼海等地采集不同水体环境中的水样与泥样,于4 ℃条件下带回实验室处理。
1.2.2 水样处理方法。用无菌去离子水对水样进行10倍梯度稀释,取0.1 mL合适浓度的稀释液涂布于牛肉膏蛋白胨琼脂平板,37 ℃倒置培养1~5 d,连续观察菌落生长情况。挑取菌落形态不同的菌株进行纯化后保种,用作待测菌株。
1.2.3 泥样处理方法。取5 g泥样加5 mL无菌生理盐水,于4 ℃条件下振荡30 min(条件不允许时在涡旋混合器上以最大速度混合10 min),4 ℃静置30 min,取上层液体4 ℃,1 000 r/m离心30 min,取上清液,以生理盐水进行10倍梯度稀释,取0.1 mL合适的浓度的稀释液涂布于牛肉膏蛋白胨琼脂平板,37 ℃倒置培养2~5 d,连续观察菌落生长情况。挑取菌落形态不同的菌株进行纯化后保种,用作待测菌株。
1.3 拮抗菌的筛选
用BHI活化无乳链球菌,用牛肉膏蛋白胨培养基活化待测菌株。制作双层平板,下层为固体牛肉膏蛋白胨培养基,上层为混有无乳链球菌的半固体BHI(50 ℃左右时在BHI中加入活化的无乳链球菌,混匀)。以6 mm孔径打孔器在双层平板上打孔,每孔加入50 μL待测菌株,以等量生理盐水作为对照,37 ℃静置培养20 h,测量抑菌圈大小。选取抑菌效果较好的菌株用于后续研究。
1.4 安全性试验
选取体长为20 cm左右,体重约200 g的健康罗非鱼在实验室暂养7 d后进行分组,每组10尾,饲养在约150 cm×100 cm×50 cm规格的水族箱中(或网箱中)。将待测菌株接种于普通淡水液体培养基中,37 ℃扩大培养18 h,用灭菌的生理盐水洗菌2次,浓度调至1×108 CFU/mL,按菌液与罗非鱼体重1∶1 000的质量比进行腹腔注射,对照组每尾注射等量的无菌生理盐水,每株菌设置2个平行组进行试验。每天正常投喂人工配合饲料,连续观察15 d,并每天记录实验用鱼的死亡情况。
1.5 16S rDNA分子鉴定
利用通用引物扩增出前期研究筛选菌株的16S rDNA序列并委托技术公司进行测序,將测定的序列在GenBank数据库中进行比对分析,初步得到待检菌株的分子鉴定信息。
2 结果与分析
2.1 样品的采集和前期处理
采集到的样品经前期处理后,初步获取不同生长形态的单菌落262株,详细结果见图1和表1。
2.2 拮抗菌的筛选
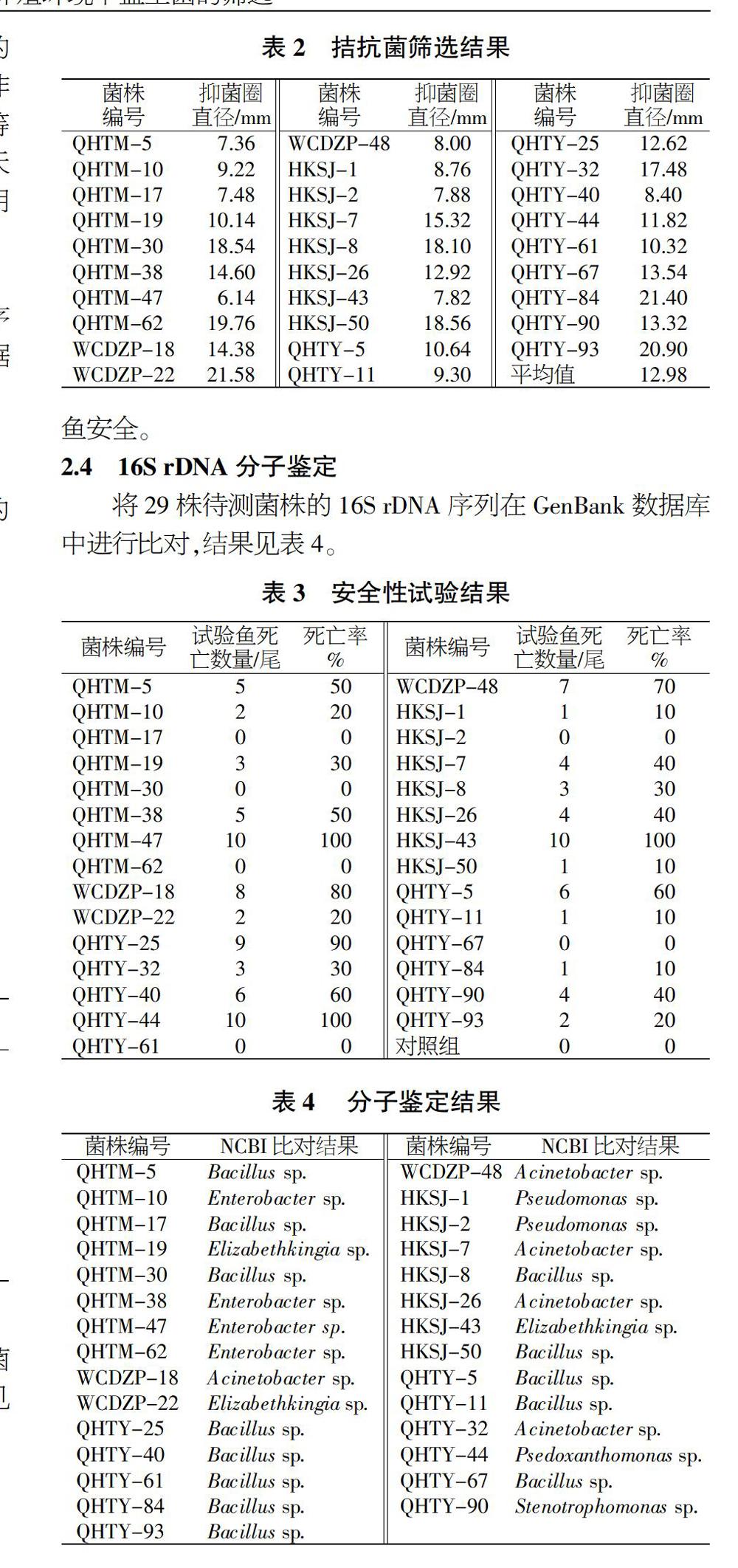
经双层培养基的培养初筛后,得到29株对无乳链球菌具有较强拮抗作用的菌株,抑菌圈直径为12.98 mm,结果见图2和表2。
2.3 安全性试验
试验罗非鱼注射待测菌株后,经15 d的连续饲养,死亡情况见表3。其中,有6株待测菌株的致死率为0,即对罗非鱼安全。
2.4 16S rDNA分子鉴定
将29株待测菌株的16S rDNA序列在GenBank数据库中进行比对,结果见表4。
3 结论与讨论
本次试验共采集了4个养殖场、3种养殖模式的样品,通过分析池塘的养殖模式可知,泥样中微生物种类较水样中更为丰富;养殖环境生态多样性越复杂,微生物种类越丰富。林国荣等[7]利用Illumina高通量测序技术对不同养殖模式下养殖池塘水体和底泥中的菌群结构进行检测,结果表明,不同养殖模式下池塘的水体和底泥之间、同一养殖池塘的水体和底泥之间,微生物的区系组成存在着一定差异;微生物的多样性和丰富度也表现出了很大的差异,底泥的微生物多样性明显高于水体,与本研究的结果相符。微生物在水产养殖环境生物多样性中占有重要的位置,并发挥着极其重要的作用,对养殖水体调控、养殖对象菌群结构稳定、养殖环境物质循环和能量流动等都有较大影响[8]。养殖环境中微生物的多样性受到养殖模式、养殖品种影响的同时,也存在着一定的季节性差异[9-10],对于罗非鱼养殖环境及肠道的微生物多样性,已有学者做过相关研究,结果显示,不同养殖区域、不同养殖阶段、不同养殖模式、不同养殖环境下罗非鱼的肠道菌群均存在显著差异[11],微生物多样性受养殖环境的影响,同时,微生物也可通过调节水质、增强免疫力、提供饵料利用率等方面改善养殖环境、养殖生物的现状。因此,可通过加强对养殖环境微生物的研究对水产养殖环境调控进行科学指导。
待测菌株经20 h的体外拮抗试验后,有29株对对无乳链球菌具有较强拮抗作用,抑菌圈直径为(12.98±8.60)mm,各菌株的抑菌效果差异较大,其中WCDZP-22、QHTY-84、QHTY-93等菌株的拮抗效果最好,抑菌圈超过20 mm。国内对于水产养殖对象病原菌的拮抗菌筛选,已有超过15年的时间,并取得了一定成效,主要针对的病原菌有副溶血弧菌(Vibrio parahaemolyticus)、鳗弧菌(Vibrio anguillarum)、飘浮弧菌(Vibrio natriegen)和沙蚕弧菌(Vibrio nereis)等病原性弧菌[12-13]及嗜水气单胞菌[14]、水霉(Saprolegnia)[15]、维氏气单胞菌(Aeromonas veronii)[16]等。近年也有学者对罗非鱼源无乳链球菌的拮抗菌进行了研究,结果表明,该类拮抗菌广泛存在与罗非鱼的养殖环境及其肠道内,较易分离得到,但生产应用尚需进一步研究[17-18]。
初筛菌株的安全性试验与16S rDNA分子鉴定结果显示,有QHTM-62、HKSJ-2、QHTY-61等6株菌对罗非鱼无致病性,该6株菌分属于芽胞杆菌属、假单胞菌属、肠杆菌属等3个属,其中有4株均为芽胞杆菌,说明无乳链球菌对芽胞杆菌属的细菌表现较为敏感,这与何涛等人的研究结果一致[19-21]。在后续拮抗菌筛选可缩小研究范围,专门针对芽孢杆菌进行筛选,这将大幅度减少工作量。
针对拮抗菌的作用机理与生产应用的研究相对匮乏,后续的研究工作方向重点偏向机理与应用,这将为今后有益微生物制剂的研发、应用及水产养殖病害防治提供科学依据。
4 参考文献
[1] 赵光军.拮抗菌的筛选及其对无乳链球菌粘附罗非鱼粘液的拮抗作用研究[D].海口:海南大学,2014.
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.中国渔业统计年鉴[M].北京:中国农业出版社,2018.
[3] 袁媛,袁永明,代云云,等.罗非鱼供给侧结构改革的思考[J].中国农学通报,2018,34(8):118-122.
[4] 张红燕,袁永明,贺艳辉,等.中国罗非鱼产品出口贸易特点及展望[J].农业展望,2017,13(9):104-107.
[5] 周远扬,王玉梅,曹俊明,等.2015年广东罗非鱼产业发展形势与对策建议[J].广东农业科学,2016,43(6):23-27.
[6] HILL C,GUARNER F,REID G,et al.Expert consensus document:The International Scientific Association for Probiotics and Prebiotics consen-sus statement on the scope and appropriate use of the term probiotic[J].Nature reviews Gastroenterology & hepatology,2014,11(8):506.
[7] 林國荣,王春忠,孙富林,等.海水混养池塘虾蛤肠道与养殖环境的微生物多样性[J].微生物学通报,2018,45(9):1989-1999.
[8] 马富平.主养草鱼池塘微生物群落结构分析及嗜水气单胞菌拮抗菌筛选[D].重庆:西南大学,2017.
[9] 夏海峰,杜宗军,陈冠军.刺参肠道及养殖池塘底泥微生物多样性的比较研究[J].海洋湖沼通报,2015(4):105-110.
[10] 张皓.养殖环境微生物群落的动态变化及与水环境的互作[D].苏州:苏州大学,2015.
[11] 佟延南,李芳远,李忠琴,等.不同养殖阶段罗非鱼肠道微生物多样性的动态分析[J].南方农业学报,2018,49(7):1415-1422.
[12] 张新明.对虾养殖用微生态制剂菌株的筛选与应用效果的研究[D].青岛:中国海洋大学,2004.
[13] 李继秋.对虾微生态制剂的研究和应用[D].青岛:中国海洋大学,2004.
[14] 张皎皎,马富平,熊波,等.一株新型嗜水气单胞菌拮抗菌的筛选及鉴定[J].西南大学学报(自然科学版),2017,39(12):18-23.
[15] 梁永增.鱼类水霉病病原生物拮抗菌的筛选及其拮抗机理分析[D].乌鲁木齐:新疆大学,2016.
[16] 何涛,邹升,龚亮,等.草鱼病原菌AvX005的分离鉴定及其拮抗菌筛选研究[J].水产科学,2018,37(1):15-23.
[17] 赵光军,周永灿,杨慧,等.罗非鱼无乳链球菌拮抗菌的分离、鉴定及多样性分析[J].热带生物学报,2014,5(4):312-319.
[18] 高艳侠,张德锋,可小丽,等.罗非鱼源无乳链球菌肠道拮抗芽孢杆菌的筛选及其生物学特性[J].微生物学报,2019,59(5):926-938.
[19] 韦露,陈偿,龙云映,等.一株短小芽孢杆菌B1的筛选鉴定及其抗菌特性研究[J].水产科学,2015,34(3):161-168.
[20] 王金燕,李彬,王印庚,等.刺参养殖池塘一株贝莱斯芽孢杆菌的分离及其生理特性[J].中国水产科学,2018,25(3):567-575.
[21] 赵彩春,陈国明,张家学.短小芽胞杆菌HLK8-1的分离鉴定及抑菌特性分析[J].微生物学杂志,2016,36(2):33-38.
