EMA-qPCR检测空肠弯曲活菌方法研究
2019-10-15闻子钰顾一心王佳奇鞠长燕马艳萍张茂俊段永翔
闻子钰,顾一心,梁 昊,王佳奇,鞠长燕,马艳萍,张茂俊,段永翔
空肠弯曲菌(Campylobacter jejuni,C.jejuni)是最常见的食源性病原菌之一,与沙门氏菌、志贺氏菌并列为人类三大腹泻致病菌。该菌属于弯曲菌属,为微需氧菌,在大气或厌氧的环境中均不生长,广泛存在于家禽肠道中[1],并通过污染肉品、食物或水源导致人类感染,主要引起人的发热和急性肠胃炎,进一步还可引发心内膜炎、关节炎、骨髓炎等全身性疾病[2],研究表明,特定血清型的空肠弯曲菌感染与吉兰-巴雷综合征的发病密切相关[3-5]。
目前对于弯曲菌的检测方法是传统的培养法,从富集培养、选择性分离、形态特征观察、生化反应和血清学鉴定等过程,时间长达5~7 d左右,操作过程费时费力,影响因素较多,灵敏度偏低[6]。荧光定量PCR技术能够快速定量检测样本中病原菌的污染,但其通过检测样品中特异核酸的存在及拷贝数,对样本中“死菌”的扩增导致假阳性结果,不能真正反映样品中活菌的数量。
叠氮溴化乙锭(Ethidium monoazide,EMA)是溴化乙锭的衍生物,能够进入受到损害的细菌细胞壁和细胞膜,随后共价结合在其DNA上,不能被PCR所扩增。活菌细胞因具有完整的细胞壁和细胞膜,使其得到保护不受EMA共价反应的影响,因此,利用EMA预处理模板可克服PCR检测的假阳性结果。本研究通过优化EMA使用浓度,建立EMA-qPCR组合检测技术,并进行模拟食品标本的验证,从而建立一种快速定量检测“活的”空肠弯曲菌的方法。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株 空肠弯曲菌为中国疾病预防控制中心传染病所保存。
1.1.2 试剂和仪器 叠氮溴化乙锭EMA(Biotium,美国),裂解液(由本实验室配制),QIAamp DNA mini kit(德 国 QIAGEN)、QIAamp DNA Stool Mini Kit(德国QIAGEN)、弯曲菌培养检测试剂盒(青岛中创生物科技有限公司),TranStartProbe qPCR Super Mix(北京全式金生物技术有限公司);振荡恒温金属浴(MB-102,杭州博日科技有限公司)、17R离心机(Thermo)、实时荧光定量PCR仪(美国Bio-Rad公司)、活菌甄选仪BluCoo(北京博瑞立安生物技术有限公司BBI)。
1.1.3 引物和探针 针对弯曲菌扩增的探针引物参考文献[7],序列见下:

1.2 方 法
1.2.1 优化EMA使用浓度
1.2.1.1 空肠弯曲活菌、死菌的制备 空肠弯曲菌接种于加脱纤维羊血Karmali培养基上,置于三气培养箱(5%O2,10%CO2,85%N2)中37℃生长48 h,使用1 L接种环刮取一环空肠弯曲菌溶于1 mL 0.85%预冷的生理盐水中,紫外分光光度计调节菌液浓度A600=1(109CFU/mL),用生理盐水10倍梯度稀释至106CFU/mL、105CFU/mL、104CFU/mL、103CFU/mL,各浓度取1/2体积作为活菌,取1/2体积于水浴锅加热(95℃,10 min)作为死菌,并于培养基验证完全处死。
1.2.1.2 EMA 处理 将106CFU/mL、105CFU/mL、104CFU/mL、103CFU/mL的活、死菌悬液分别分装200μL至1.5 mL EP管中,加入不同体积的1 mg/mL EMA 至终浓度为0(对照组)、2、5、10、20、50μg/mL,并进行标记,重复1次操作作为平行对照,以上步骤均在冰上操作。充分混匀后置于活菌甄选仪中,4℃,暗反应5 min,光反应15 min。
1.2.1.3 DNA提取 取出活菌甄选仪中的样品,离心(4℃,12 000 g,10 min)后,重悬于裂解液中,金属浴加热(100℃,10 min),离心(4℃,16 000 g,5 min),DNA于-20℃保存。
1.2.1.4 荧光定量PCR 反应条件:总体系20μL,成分 如 下:TranStart○RProbe qPCR Super Mix 10 μL,Nuclease-free Water 5.5μL,上游及下游引物0.3μmol/L,探针0.15μmol/L,DNA 3μL。反应程序:94℃预变性5 min,45个循环中94℃变性15 s,60℃退火及延伸1 min,退火阶段采集荧光信号。
1.2.2 EMA-qPCR检测空肠弯曲菌的死/活混合物按1.2.1.1所述步骤制备106CFU/mL、105CFU/mL、104CFU/mL的死、活空肠弯曲菌,每个浓度均进行以下操作:以活菌比例占0%(800μL D),10%(80μL V+720μL D),30%(240μL V+560μL D),50%(400μL V+400μL D),70%(560μL V+240μL D),90%(720μL V+80μL D),100%(800 μL D)与同浓度的死菌混合(V:活菌,D:死菌),充分混匀后分装200μL至EP管中,每个比例的两管作为处理组,两管作为对照组1,同时活菌按相同比例与生理盐水混合作为对照组2,设一个平行对照,以上操作在冰上进行。处理组加入1 mg/mL EMA至终浓度为5μg/mL,对照组不加EMA,充分混匀后置于预冷4℃的活菌甄选仪中,暗反应进行5 min,光反应进行15 min,按1.2.1.3、1.2.1.4步骤提取DNA及进行荧光定量PCR。
1.2.3 EMA-qPCR检测模拟食品标本
1.2.3.1 食品盥洗液制备 于超市购买3只鸡腿肉各75 g,分别放入无菌袋中,加入100 mL 0.1% 灭菌蛋白胨水盥洗15 min,盥洗液分装至2个50 mL离心管中,4℃保存。
1.2.3.2 本底检测 取1管50 mL盥洗液,将试剂盒中的双孔板从4℃冷藏室拿出后,室温平衡后(约30 min),使用无菌镊子将滤膜轻轻贴在双孔板的中间上,吸取300μL混匀后的增菌培养液分6~7个点均匀滴加双孔板的滤膜上,待水分充分透过滤膜(约1 h),使用无菌镊子轻轻的揭去滤膜,翻转平板。置于微需氧环境37℃培养48 h。离心管内剩余溶液离心(4℃,4 000 r/min,10 min,离心半径为9 cm),弃上清,按照QIAamp DNA Stool Mini Kit步骤说明提取DNA,应用检测弯曲菌的荧光定量PCR验证是否含有弯曲菌。
1.2.3.3 模拟感染空肠弯曲菌 按1.2.1.1所述步骤制备107CFU/mL、106CFU/mL浓度活、死状态的空肠弯曲菌,各浓度分别以活菌占10%(2μL V+18μL D)的比例与同菌种同浓度的死菌混合作为处理组和对照组1,同时与生理盐水混合作为对照组2,于含有死/活菌混合液的EP管中分别加入180μL的3份验证无弯曲菌存在的鸡肉盥洗液(此时空弯活菌浓度为105CFU/mL、104CFU/mL)。处理组加入EMA至终浓度为5 g/mL,对照组不加EMA,所有步骤在冰上操作。处理组充分混匀后置于活菌甄选仪中,4℃,暗反应5 min,光反应15 min。反应结束后使用Qiagen mini kit试剂盒提取DNA,应用扩增弯曲菌的荧光定量PCR检测。
1.3 统计学方法 实验数据SPSS20.0统计软件分析,采用Dunnett-t检验,检验水准α=0.05。
2 结 果
2.1 EMA最优浓度 将106CFU/mL、105CFU/mL、104CFU/mL、103CFU/mL死、活菌分别使用EMA作用后,荧光定量PCR结果如下(见表1),EMA终浓度为5~10μg/mL时,死菌在106、105、104、103时,死菌的Ct值比不加EMA的Ct明显提高6个单位左右,EMA终浓度为10μg/mL时,活菌在105CFU/mL时,Ct值约增加1个单位,EMA终浓度小于5μg/mL时,对活菌Ct值无影响。综合各浓度考虑,5μg/mL为EMA应用于“活的”空肠弯曲菌检测前处理的最优浓度。

表1 EMA作用浓度的优化结果Tab.1 Optimization of EMA concentration
2.2 EMA-qPCR检测空肠弯曲菌死/活混合物对不同浓度的以不同活菌、死菌比例混合后的死/活混合物进行终浓度为5μg/mL的EMA处理,荧光定量PCR结果如下(见图1,图2,图3):菌总量在106CFU/mL、105CFU/mL、104CFU/mL时,活、死菌混合物进行EMA处理后与活菌与生理盐水混合物的对照组2的Ct值在活菌比例占10%、20%、50%、70%、90%、100%时基本一致,活、死菌混合物进行EMA处理后与活、死菌混合物的不加EMA处理对照组1的Ct值在活菌比例小于70%时有差距,并随着活菌比例趋于100%而趋于一致。表明EMA-qPCR可从纯培养的空肠弯曲菌的死/活混合物中识别出“活的”空肠弯曲菌。

图1 空肠弯曲菌的不同活菌比例的EMA-qPCR(106)Fig.1 EMA-qPCR results of different ratios of viable C.jejuni cells(106)
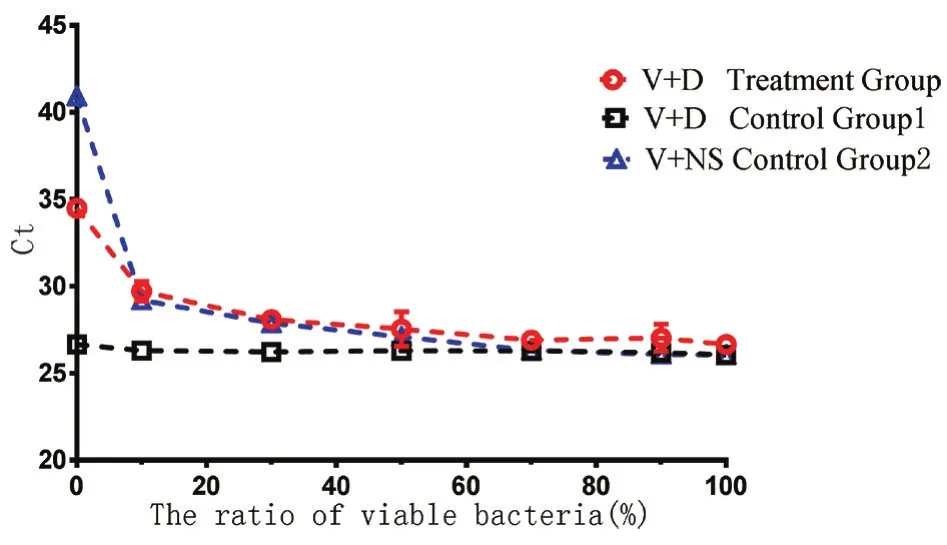
图2 空肠弯曲菌的不同活菌比例的EMA-qPCR(105)Fig.2 EMA-qPCR results of different ratios of viable C.jejuni cells(105)
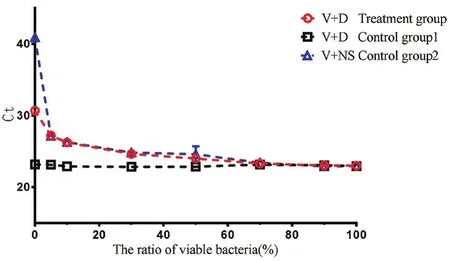
图3 空肠弯曲菌的不同活菌比例的EMA-qPCR(104)Fig.3 EMA-qPCR results of different ratios of viable C.jejuni cells(104)
2.3 EMA-qPCR检测模拟食品标本 对人工感染空肠弯曲菌的模拟食品进行终浓度为5μg/mL的EMA结合qPCR,经SPSS24.0单因素方差分析及LSD多重比较,检验水准=0.05。结果如表2,菌浓度为106CFU/mL,活菌占10%时,3组Ct值的差异有统计学意义(F=49.404,P=0.001<0.05),处理组与对照组1的Ct值的差异有统计学意义(t=9.378,P<0.001);处理组与对照组2的Ct值的差异无统计学意义(t=1.834,P=0.116);菌浓度为105CFU/mL,活菌占10%时,3组Ct值的差异有统计学意义(F=26.190,P=0.001<0.05),处理组与对照组1的Ct值的差异有统计学意义(t=6.756,P=0.001),处理组与对照组2的Ct值的差异无统计学意义(t=1.129,P=0.302)。表明EMA-qPCR可成功识别模拟食品中“活的”空肠弯曲菌。

表2 模拟食品感染空肠弯曲活、死菌混合物的EMA-qPCR结果Tab.2 EMA-qPCR results of simulated food infection of viable and dead C.jejuni
3 讨 论
针对特异基因序列设计引物或探针的PCR技术,以DNA为靶标进行扩增,无法避免死菌DNA产生扩增信号的影响。仅识别活菌的扩增信号对于分子生物学技术在食品检测及监测的应用更有意义,同时减轻了大量的经济损失。基于mRNA及基于膜通透性的活性染料法是目前实现PCR进行活菌检测的2种方法。mRNA半衰期较短,在细菌死亡后很快降解,因此对mRNA进行逆转录PCR可达到只检测活菌的目的,但存在一系列困难,首先,食品中存在的脂肪等抑制剂导致RNA提取较为困难[8];其次,RNA在细菌中含量较少,易被内源性外源性RNA酶降解,受实验操作者影响较大;再次,RT-qPCR灵敏性较低[8],检测过程需要结合增菌步骤,增加了检测时间,当死菌含量较大时,RNA并不能完全降解,导致产生假阳性结果[9]。
EMA是一种可以进入死菌受损的细胞膜并结合DNA形成共价化合物的活性染料,对样本进行前处理后,可避免PCR对死菌DNA进行扩增产生的假阳性结果[10]。但成功地应用EMA,必须考虑可能会影响结果数据的多因素,包括染料的浓度、孵育时间;光源及曝光时间、光照距离;是否存在大量死亡细胞,待检样品中存在高水平的悬浮固体或生物量;反应混合液中的盐浓度、p H;目标基因的长度、序列等[9]。以往研究大多采用卤素灯作为光源,卤素灯是一种产热光源,其产生的热能可能对活细胞产生杀伤作用,研究者通过控制光源距离及冰上操作进行实验,由于研究条件不同,研究结果通常呈现多样性。本研究采用了活菌甄选仪,其冷光源对活细胞无损伤,实验中发现环境温度也是一个重要影响因素,可能是由于细菌周围环境的升高使得细菌细胞膜处于不稳定状态,因此在EMA使用的过程中需在在冰上操作,保持活菌细胞膜的稳定性。
本研究以建立“活的”空肠弯曲菌的检测技术为目的,结果表明空肠弯曲菌的最优EMA终浓度为5~10μg/mL,EMA的使用浓度并未随空肠弯曲菌浓度的不同发生较大改变,综合浓度及经济考虑,将5μg/mL应用于纯培养的死/活菌混合物及模拟食品检测后,EMA-qPCR技术成功区分活、死菌。活菌比例大于5%或10%时,处理组与对照组2即保持一致,表明可区分死、活菌。在对加入EMA处理后的样品进行菌落培养发现,经过EMA处理后的活菌样品无菌落生长,可能是EMA对活细胞具有毒性作用,无法培养,但进行荧光PCR可检测出Ct值,与未进行EMA处理的活菌样品相比无差异,不影响EMA区别死、活菌的效果。研究表明,在实际标本的基质中除空肠弯曲菌之外的其他菌群不会影响EMA的作用[11]。相比之下,RT-qPCR共消耗7美元[12],EMA-qPCR处理1份样品需比qPCR成本增加0.4元,EMA更为经济,且无需增菌步骤,本研究建立的EMA-qPCR活菌检测技术可用于“活的”空肠弯曲菌的检测。
利益冲突:无
引用本文格式:闻子钰,顾一心,梁昊,等.EMA-qPCR检测空肠弯曲活菌方法研究[J].中国人兽共患病学报,2019,35(9):821-825.DOI:10.3969/j.issn.1002-2694.2019.00.117
