基于UPLC-Q/TOF-MS的间变性星形细胞瘤发病机制的系统代谢组学研究
2019-09-27李香兰黄哲浩
李香兰,韩 亮,李 淼,黄哲浩*
(吉林大学中日联谊医院 1.皮肤科;2.病理科;3.神经外科,吉林 长春130033)
间变性星形细胞瘤(AA)是星形胶质细胞瘤的一种,其发病机制广泛涉及营养代谢、表观遗传等诸多方面[1-3]。基于系统生物学与生物信息学手段研究胶质瘤的发生机理已经取得了长足进步[4]。其中代谢组学作为关注于机体内小于1 kDa小分子代谢物新型组学手段已经被认为是揭示疾病发病机理的最佳手段之一[5]。然而,对于AA的代谢组学机制研究目前大多停留在体外细胞模型,对于机体系统水平的组学差异机制仍鲜有报道[6]。本研究采用基于超高效液相色谱四极杆高分辨时间飞行质谱(UPLC-Q/TOF-MS)联用的代谢组学技术探讨AA的发病机制。
1 材料与方法
1.1 材料甲醇、甲酸及乙腈(质谱级,Fisher Chemical公司,货号:A4521/PI85170/A998-4);亮氨酸-脑啡肽(Sigma-Aldrich公司,货号:87-89-8);双蒸水(广州屈臣氏公司,货号:20170126C);分离胶促凝管。实验用分子生物学耗材及超高效液相进样瓶均为无菌新开的一次性耗材。
1.2 样本来源及患者招募患者招募自吉林大学中日联谊医院,均为初次诊断为AA且未受任何放化疗、年龄50-60岁之间。年龄与性别匹配无神经病史健康志愿者(HC)亦被招募。所有纳入研究的受试者均被明确且充分告知研究内容且签署知情同意书。所有受试者均禁食12小时后于清晨空腹采集外周血10 ml,于分离胶促凝管中分离获得血清,立即置于-80℃超低温冰箱保存。
1.3 样本处理方法所采集的血清样本于冰上避光解冻后按1:3(v/v)的比例加入甲醇,并涡旋混匀3 min使蛋白变性并于4℃,×10,000g离心去除。收集上清置于-60℃、10pa气压的真空冷冻干燥机中干燥24 h。残留物于100 μl甲醇-水(4∶1,v/v)复溶。每个样本汲取20 μl上清混合制备QC样本;灯检后上机检测。
1.4 液相质谱条件采用UPLC系统(Waters,ACQUITY;BEH C18柱,2.1 mm× 100 mm,1.7 mm)与Q/TOF质谱仪(Waters,Xevo G2-S)。色谱条件与参数如文献所述[7]并进行适当优化。BEH柱温30℃,自动进样器温度15℃。流动相A(0.1%甲酸水溶液)和B(0.1%的甲酸乙腈溶液),依次进行90%-10%梯度洗脱,流速0.4mL/min;质谱采集模式为ESI+。
1.5 化合物鉴定组学数据的采集、峰对齐及解卷积均由Masslynx软件平台完成。差异性代谢物通过比对HMDB(v4.0)中物质的精准分子量及二级质谱碎片模式(MS/MS)得以确认同时参照Metlin高分辨二级质谱碎片数据库进一步确证。分子量偏差允许范围为10 ppm。
1.6 多元协变量统计及生物信息学分析多元协变量分析采用SIMCA(v14.0)软件以建立主成分分析(PCA)和基于正交的偏最小二乘法判别(OPLS-DA)模型,并进行置换验证,选取投影变量重要性值(VIP)大于1且具有统计学意义的代谢物进行基于MetaboAnalyst 4.0平台的扰动代谢通路识别[8]。
1.7 统计学方法数据的方差齐性及正态性分别通过F检验及Kolmogorov- Smirnov检验完成。数据不满足正态性的,使用Mann-Whitney-Wilcoxon检验进行分析。Student’st检与Welch’st检验分别用于方差齐与不齐的数据。所有的统计学显著性P<0.05 时接受。ROC及统计分析由R语言的基础统计包及pROC包完成。
2 结果
2.1 主成分分析本研究共纳入符合条件的AA患者12名(男/女:6/6),HC受试者15名(男/女:8/7)。所有样本的PCA分析结果如图1A所示。PCA模型共解析得到5个主成分,累计为68.24%。QC样本紧密聚集在PCA图中央,表明色谱及质谱稳定性良好。PCA分析结果显示,AA患者的系统代谢模式与HC存在显著的差别,且两组样本中并无显著异常样本存在(置信区间95%内)。

(A) PCA分析结果;(B) OPLS-DA模型分析结果;(C) OPLS-DA模型置换检验结果;(D) 差异性化合物S-plot展示图。
2.2 基于正交的偏最小二乘法判别分析OPLS-DA模型被进一步建立,用于判别两组之间的显著性差异。如图1B所示,两组样本被显著区分,表明两组之间差异显著。进一步的模型置换检验结果如图1C所示,Q2<0.5且拟合线显著位于随机线下方,表明OPLS-DA模型成功,且CV-ANOVA检验发现P<0.0001,表明基于此判别模型识别的差异性化合物可信度高,可代表两组之间的显著差异组分。
2.3 差异代谢物OPLS-DA模型共涉及4386个潜在化合物特征,而基于该判别模型识别的VIP >1且组间P<0.05的差异性化合物经过数据库比对后共识别15种差异性物质,如表1及图1D中S-plot所示。其中,ROC分析表明,二氢鞘氨醇及乳糖神经酰胺作为生物标志物具有极好的敏感性及准确性(AUC>98%)。
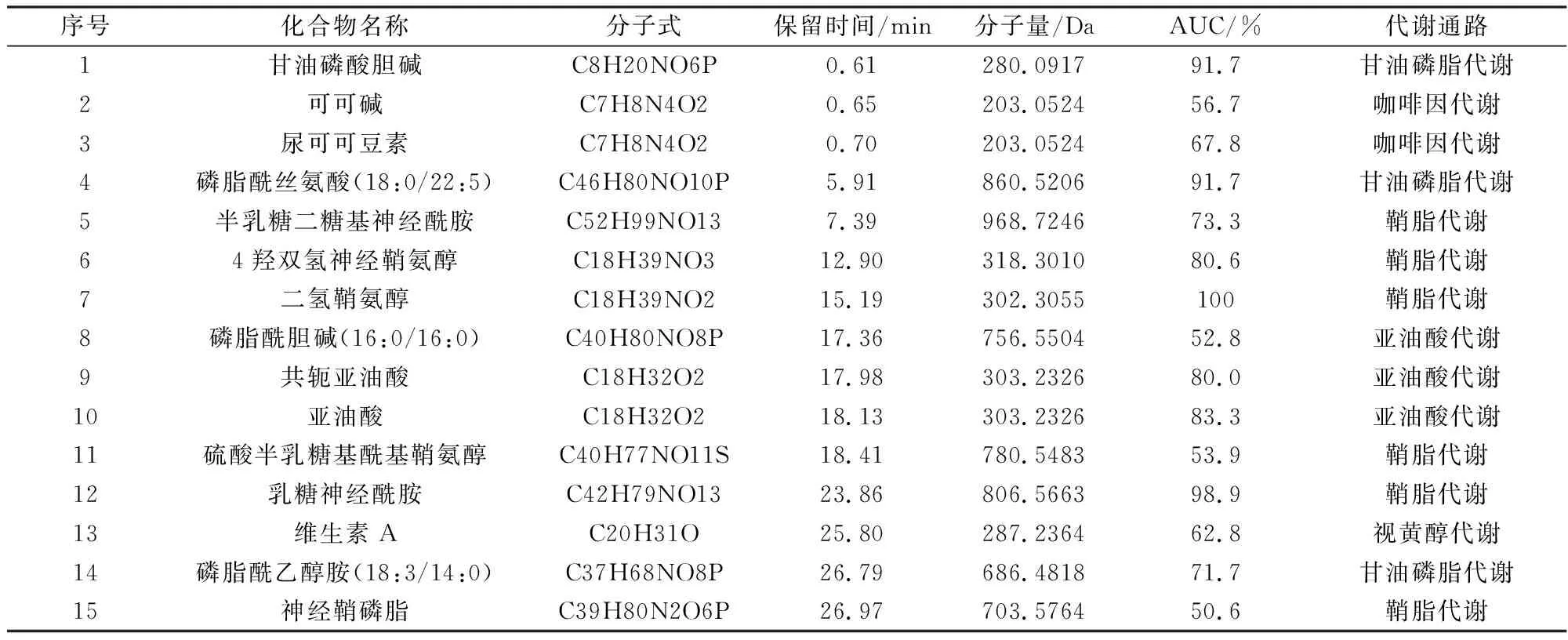
表1 差异性代谢产物识别与鉴定
2.4 扰动的代谢通路上述已经识别的差异性化合物参与了4条显著扰动的代谢通路(-log(P) >4且Impact > 0.1),包括鞘脂代谢、甘油磷脂代谢、亚油酸代谢以及咖啡因代谢。如图2所示,各代谢通路扰动程度存在差异。此外,视黄醇代谢通路虽有一定程度扰动,但未达到显著性水平(-log(P) <2且Impact < 0.1)。各代谢通路中的差异代谢物如表1所示。
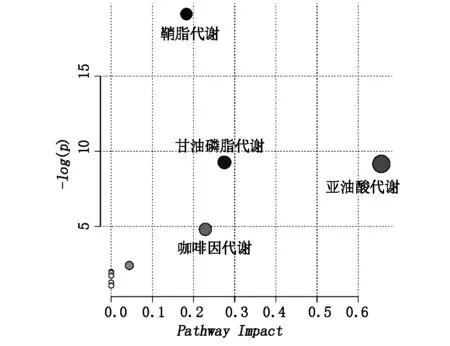
Pathway Impact,代谢通路扰动程度值
3 讨论
星形胶质细胞瘤是胶质瘤中术后易复发的一类颅内肿瘤。星形胶质细胞瘤中,AA患者的预后较差,两年生存率往往低于30%[9]。已有研究报道,AA的发病机制涉及环境因素、表观遗传以及免疫调控等诸多方面[10-12]。近年来,代谢组学技术因其所关注对象的特点而被广泛应用于疾病发生机制的研究[5,7]。目前,代谢组学技术应用于胶质瘤的研究大多局限于体外细胞水平或仅关注了恶性母细胞瘤的代谢模式差异[13],而对于AA的系统差异代谢模式尚无明确报道。
本研究中,我们发现AA患者存在显著改变的代谢模式,其原因可能与机体中恶性细胞自身能量代谢模式等的显著改变相关[14]。具体而言,我们在外周血中共发现了15种差异代谢产物并预测了4条显著扰动的代谢通路。关于AA的代谢扰动通路,甘油磷脂及鞘脂类成分作为中枢神经元的关键组成成分已有报道[15],本研究以前报道了代谢扰动通路对于肿瘤细胞的进一步增殖、生长、抗凋亡及机体的免疫调控具有至关重要的作用[16]。
诸多研究表明,甘油磷脂、鞘脂类组分及亚油酸类物质能直接参与机体能量代谢、免疫及炎症状态的调节[5],显示这三类物质与AA的发病机制有着密切的关联。Albers M 等利用基于质子去耦合的核磁共振技术首次发现原始神经外胚层肿瘤组织的甘油磷脂代谢显著紊乱[17],但机制至今尚不明确。线粒体功能异常已成为公认的癌症发生的标志,Kiebish M等研究已发现脑线粒体中磷脂酰胆碱及磷脂酰乙醇胺代谢异常的小鼠极易形成自发性胶质瘤[18]。
近来,鞘脂代谢物参与胶质瘤免疫学机制的研究已经逐步开展,如二氢神经酰胺参与胶质瘤细胞自噬[19]、神经酰胺促进胶质瘤细胞凋亡[20]而半乳糖神经酰胺则能参与到树突状细胞及NK细胞自然杀伤肿瘤细胞的过程中[21]。本研究系统地观察了甘油磷脂代谢及鞘脂代谢通路在AA中的全身扰动情况,并且挖掘出了两个关键鞘脂代谢化合物——二氢鞘氨醇及乳糖神经酰胺。本研究结果提示:这两个关键鞘脂代谢化合物均可能是潜在的AA诊断标志物。我们还推测:这两化合物也存在与AA肿瘤的相关细胞信号转导及免疫调控直接相关的可能。
亚油酸类物质对于AA肿瘤细胞具有直接的干预作用已被报道[22],本研究的结果与其相符。除此之外,咖啡因代谢及相关代谢物,如组织蛋白酶B、MAPK及Caspase-3等,已被证实参与激活胶质瘤细胞凋亡相关信号通路的调控[23-25],同时对于胶质瘤细胞的活力、细胞周期及增殖状态有着负向调控作用[26]。本研究还发现:AA患者中的差异咖啡因代谢产物可可碱及尿可可豆素与AA发病机制存在一定程度的关联。关于可可碱及尿可可豆素与AA的发生、发展关系的分子机制的研究,目前国内外尚未见文献报道。
综上,本研究鉴定的间变性星形细胞瘤患者机体显著扰动的差异代谢模式为深化对该疾病发病机制的认识提供了新的理论基础,同时发现二氢鞘氨醇及乳糖神经酰胺可能是潜在的AA临床诊断的新的生物标志物。
