胎儿弯曲菌PCR检测方法的建立及其初步应用
2019-09-19徐仲兰唐海燕范正杨焦新安黄金林
唐 虹,徐仲兰,孔 科,唐海燕,范正杨,焦新安,黄金林
胎儿弯曲菌(Campylobacterfetus,C.fetus) 属于弯曲菌属,包括胎儿弯曲菌胎儿亚种(C.fetussubsp.fetus),胎儿弯曲菌性病亚种(C.fetussubsp.venerealis)和胎儿弯曲菌龟亚种(C.fetussubsp.testudinum) 3个亚种[1]。C.fetus呈弧形或S形,有鞭毛,革兰染色阴性,是一种可导致人类肠外感染(如菌血症、脑膜炎、关节炎、蜂窝组织炎等),牛羊等牲畜流产、不育和生殖道炎症等疾病的人兽共患病原菌,主要通过污染的水源、精液、流产的胎儿、粪便等进行传播,给人的健康安全带来巨大威胁,同时也对畜牧业造成严重的经济损失[2]。
在人的肠道弯曲菌病中,90%是由空肠弯曲菌和结肠弯曲菌导致的,由C.fetus感染导致的案例较少[3]。但是Iraola G等人的最新研究表明人适应性C.fetus在人体内作为一种肠道致病菌能够无症状携带,这大大增加了其在人与人之间传播的可能性[4]。相反,在人弯曲菌菌血症案例中,19%~53%是由C.fetus感染导致的,而且据报道其死亡率高达14%[5-7]。在国外C.fetus感染案例屡见不鲜,已然构成一个公共卫生问题,然而在国内有关C.fetus感染病例的报道极少,其流行传播未能得到重视。C.fetus培养条件严苛,需要在微需氧环境(5% O2,10% CO2,85% N2)下才能生长,由于其培养和鉴定的特殊性导致日常工作中容易被忽视或错误鉴定。传统的C.fetus鉴定方法是通过观察形态、培养特性及生理生化特性等生物学特征,用以区分C.fetus与其他细菌。该方法耗时较长,难以适应现代诊断和研究需求,且传统鉴定方法中能区分C.fetus与其他弯曲菌的特异性试验较少,主要通过1%甘氨酸生长试验、25 ℃和42 ℃温度生长试验、3.5% NaCl生长试验、萘啶酮酸和头孢霉素药敏试验、马尿酸水解试验以及氧化酶试验等来区分C.fetus与其他弯曲菌,从分离培养到鉴定完成至少需要6~8 d,对于某些需要增菌处理的样品,还需多耗费1~2 d[8]。由于弯曲菌种类繁多,生物学特性各异,难以将C.fetus与其他弯曲菌区分开,此外C.fetus生化变型中间种的存在,更是增加了其区分难度[9-10]。因此,本研究旨在建立一种特异性检测C.fetus的PCR方法,为C.fetus感染的快速诊断、防控及深入研究奠定基础。
1 材料与方法
1.1菌种 实验菌株C.fetus标准株(NCTC10842)购自ATCC菌种库,空肠弯曲菌(NCTC11168)由遵义医学院孙万邦教授惠赠,结肠弯曲菌、唾液弯曲菌、豚肠弯曲菌、鼠伤寒沙门菌、鸡白痢沙门菌、恶臭假单孢杆菌、大肠杆菌、单核细胞增生李斯特菌、粪肠球菌、屎肠球菌、副干酪乳酸杆菌、干酪乳酸杆菌、嗜低温弓形菌、乳酸乳球菌、福氏志贺菌、副溶血弧菌、小肠肠球菌、格氏乳球菌、肠链球菌、金黄色葡萄球菌由本室保存。
1.2主要试剂 2 Taq Master mix(南京Vazyme公司);DNA marker(大连TaKaRa公司);厌氧罐、微需氧产气袋(日本MGC公司);Carry-Blair运送培养基(中国科学院上海昆虫科技开发公司);弯曲菌CCDA琼脂和Bolton肉汤(英国OXOID公司);无菌脱纤维绵羊血(北京Solarbio公司);抗生素甲氧苄氨嘧啶、放线菌酮(日本Wako公司);两性霉素B(上海Uniche公司);多粘菌素B(美国Amresco公司);萘啶酮酸(青岛海博公司);525份临床检测样品中,400份奶牛肛门擦拭样品采自某奶牛养殖场,125份产妇阴道擦拭样采自某妇幼保健院。
1.3 方 法
1.3.1引物设计 从GenBank中获得C.fetus特异性基因sapB2序列(登录号:AF048699),应用软件Primer Premier 5.0设计特异性引物(见表1),经比对得知引物覆盖区域与NCBI库中已有的C.fetus菌株的同源性均为100%。引物由南京金斯瑞生物科技有限公司合成。
表1 PCR引物序列
Tab.1 Primers used for PCR
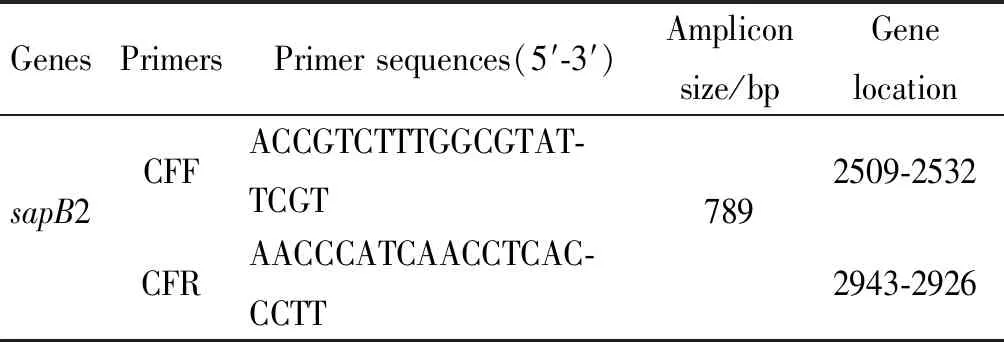
GenesPrimersPrimer sequences(5′-3′)Amplicon size/bpGene locationsapB2CFFACCGTCTTTGGCGTAT-TCGT7892509-2532CFRAACCCATCAACCTCAC-CCTT2943-2926
1.3.2细菌基因组DNA的提取C.fetus的DNA模板参照黄金林等方法制备[10]。将菌株接种于CCDA培养基上,37 ℃微需氧条件下培养36~48 h后挑取3~5个菌落,加到100 μL SW中用移液枪吹匀,沸水煮15 min,取出立即置于冰上,8 000 r/min离心5 min,吸取上清转移至-20 ℃保存备用。同时提取菌株基因组DNA用于特异性及灵敏度试验。
1.3.3PCR扩增条件优化 PCR扩增体系(25 μL)如下:DNA模板2 μL,2×Taq Master mix 12 μL,上下游引物(10 mmol/L)各1 μL,灭菌去离子三蒸水9 μL。配好体系瞬时离心10 s,使反应物集中于PCR管底部后再进行PCR扩增。PCR循环参数为:95 ℃ 7 min,95 ℃ 30 s,最佳退火温度下45 s,72 ℃ 1 min,30个循环;72 ℃ 7 min;4 ℃保存备用。取8 μL PCR扩增产物点样,用1.0%的琼脂糖凝胶(含0.5 mg/L溴化乙锭),以PCR Marker DL2000作对照,100 V电泳45 min。凝胶在紫外灯下观察,GelDoc 2000凝胶成像系统成像并保存图片。利用建立的PCR方法,在53 ℃~60 ℃退火温度范围进行PCR反应,经琼脂糖凝胶电泳检测扩增效果,确定最佳退火温度。
1.3.4特异性试验 用引物CFF/CFR对C.fetus、空肠弯曲菌、结肠弯曲菌、唾液弯曲菌、豚肠弯曲菌以及鼠伤寒沙门菌、鸡白痢沙门菌、恶臭假单孢杆菌等22种细菌进行PCR检测,并通过电泳观察PCR扩增结果。
1.3.5灵敏度试验 用分光光度计测定C.fetusDNA模板的浓度后,分别作10倍梯度稀释,每个梯度各取2 μL进行PCR扩增,并通过电泳观察比较条带亮度,直至不出现条带。
1.3.6模拟污染试验 收获新鲜培养的C.fetus,用PBS作10倍梯度稀释,同时每个梯度做菌落计数,然后将每个稀释度各取10 μL菌液分别加入到10 mL污水、10 g奶牛粪便样品中,向模拟污染样品中加入90 mL增菌培养基,微氧条件下置于摇床上37 ℃ 120 r/min培养48 h。将菌液梯度稀释后转接至CCDA培养基上培养36~48 h后,挑取典型菌落3~5个,按上述煮沸法提取DNA模板,再用该PCR方法对可疑菌落进行鉴定,鉴定正确后对培养基上的阳性菌落进行计数。根据计数结果以及10 mL污水和10 g奶牛粪便样品中C.fetus的污染量,计算该PCR检测方法在两类样品中C.fetus检测限。
1.3.7临床样品检测 将本研究建立的PCR检测方法应用于检验检疫实际工作中。从某奶牛养殖场采集400份奶牛肛门擦拭样品,同时连续10 d从某妇幼保健院共采集125份产妇阴道擦拭样品,在两类样品采集过程中各随机选取10个个体采集双份样品用于设置分离过程阳性对照组,样品均用Carry-Blair运送培养基暂时保存,并于24 h内送至实验室检测。将棉拭子头剪下置于无菌采样袋中,实验组直接加入10 mL增菌培养基进行增菌,对照组额外加入50 CFU的C.fetus,微氧条件下置于摇床上37 ℃ 120 r/min培养48 h。取菌液0.5 mL,8 000 r/min 离心5 min,弃上清液,加入100 μL灭菌去离子三蒸水,混匀后煮沸15 min,10 000 r/min离心5 min,吸出上清液作为DNA模板,用本研究建立的PCR方法进行C.fetus病原学检测。同时对增菌产物以弯曲菌传统的平板分离方法进行平行检验。
2 结果与分析
2.1PCR反应条件优化结果 在53 ℃~60 ℃退火温度范围对相同C.fetusDNA模板进行PCR扩增,扩增效果经琼脂糖凝胶电泳检测如图1所示,确定59 ℃时扩增效果最佳,即为最优退火温度。PCR扩增的目的片段约789 bp,与预期结果(789 bp)相符。
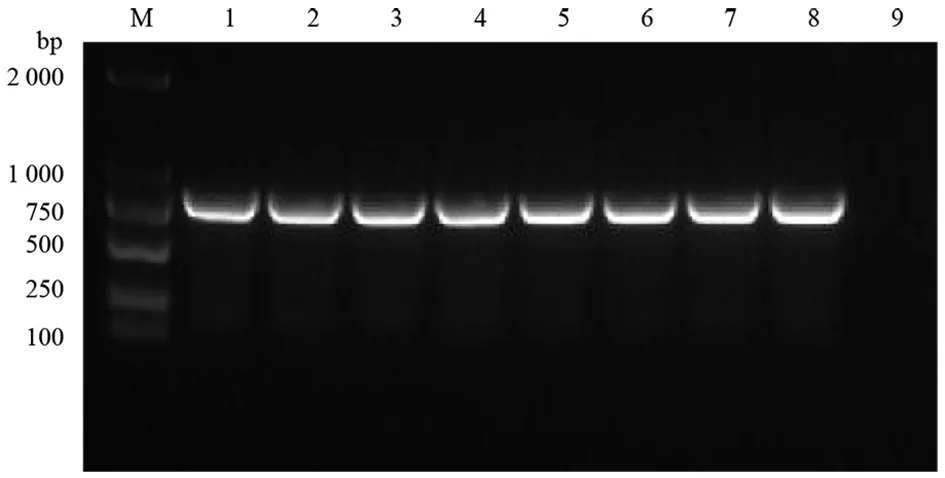
M: DL2000 DNA Marker; 1-8: Annealing temperature of 53.0 ℃, 53.5 ℃, 54.3 ℃, 55.7 ℃, 57.3 ℃, 58.6 ℃, 59.5 ℃ and 60.0 ℃, respectively; 9: Negative control图1 C.fetus温度梯度PCR扩增结果Fig.1 Results of PCR amplification by temperature gradient of Campylobacter fetus
2.2特异性试验 电泳结果显示,仅C.fetus在789 bp处出现属特异性条带,而空肠弯曲菌、结肠弯曲菌、唾液弯曲菌和豚肠弯曲菌均没有条带,其他17株参考菌株如沙门菌、大肠杆菌也均不能扩增出条带(图2)。

M: DL2000 DNA Marker; 1: C.fetus, 2: C.jejuni, 3: C.coli, 4: C.sputorrum, 5: C.hyointestinalis, 6: S.typhimurium, 7: S.pullorum, 8: P.putida, 9: E.coli, 10: L.monocytogenes, 11: E.faecalis, 12: E.faecium, 13: L.paracasei, 14: L.casei, 15: A.Cryaerophilus, 16: L.lactis, 17: S.flexneri, 18: V.parahaemolyticus, 19: E.hirae, 20: L.garvieae, 21: S.entericus, 22: S.aureus图2 C.fetus PCR检测方法的特异性Fig.2 Specificity test of PCR for the detection of C.fetus
2.3灵敏度试验 用分光光度计测得C.fetus纯培养物DNA模板浓度为227.23 ng/μL,对不同稀释度的模板进行PCR扩增,最低在10-6稀释度时能检测到目的条带。由此可知该PCR检测方法最低可检出0.23 pg/μL的C.fetusDNA(图3)。
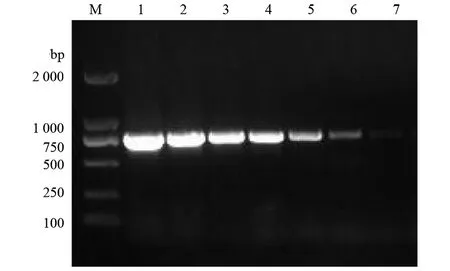
M: DL2000 DNA Marker; 1-7: 227.23×100 ng/μL-227.23×10-6 ng/μL图3 C.fetus PCR检测方法的敏感性Fig.3 Sensitivity test of PCR for the detection of C.fetus amplification
2.4模拟污染试验 经人工模拟污染的污水、奶牛粪便样品,通过增菌、平板选择性培养以及PCR检测,得知污水中C.fetus检测限为0.9 CFU/mL,牛粪便样品为20 CFU/g。
2.5临床样品检测 用本研究建立的PCR方法对525份临床样品进行检测,结果显示525份临床样品均为C.fetus阴性,其中400份奶牛肛门擦拭样品对应的10份对照组PCR检测结果均为C.fetus阳性,125份产妇阴道擦拭样品对应的10份对照组也均为C.fetus阳性。弯曲菌传统平板分离方法同步检测结果显示,400份奶牛肛门擦拭样品中检出7份空肠弯曲菌阳性,2份唾液弯曲菌阳性,1份豚肠弯曲菌阳性,未检测到C.fetus,10份对照组中,8份为C.fetus阳性,2份C.fetus阴性;125份产妇阴道擦拭样品用传统平板分离方法检出1份空肠弯曲菌阳性,未检出C.fetus,其10份对照组均为C.fetus阳性。实验组中两种检测方法结果一致,均为C.fetus阴性;对照组中两类样品的PCR方法的回收率均为100%,奶牛肛门擦拭样品平板分离法回收率为80%产妇阴道擦拭样品平板分离法回收率为100%。PCR方法整个检测过程仅需2 d,而传统方法耗时7 d。
3 讨 论
当今社会,随着宠物家庭数量增加,人与动物亲密接触机会增多,此外人类食用多种生的或半熟肉制品,都大大增加了人感染人兽共患病的风险。C.fetus作为一种常见的人兽共患病原菌,其引起的感染常因其生长缓慢,培养条件特殊等特性以及传统检测技术耗时费力、诊断不准确而导致误诊或延误治疗。因此开发C.fetus快速检测方法,以识别该病原菌的暴发流行,及时诊断和控制胎儿弯曲菌病显得非常迫切和重要。
随着核酸检测技术的发展,越来越多的研究者将这项技术应用到诊断领域。本研究以C.fetus表面蛋白基因sapB2为靶基因,设计特异性引物,建立C.fetusPCR检测方法。同源性比对结果显示,sapB2基因在C.fetus不同亚种中的一致性均在82%以上,具有很高的保守性。试验结果也证明,当以空肠弯曲菌、结肠弯曲菌、唾液弯曲菌和豚肠弯曲菌这4个不同的弯曲菌种,以及17种其他细菌如大肠杆菌、屎肠球菌等作为参考菌株时,仅C.fetus能被扩增,说明该PCR方法具有较强的特异性。用本研究建立的PCR方法对C.fetus纯培养物进行检测,最低可检出0.23 pg/μL的DNA,该结果与国内其他细菌PCR检测方法结果相似[11-12]。对模拟污染样品的检测结果显示,污水中C.fetus的最低检测限为0.9 CFU/mL,奶牛粪便样品中为20 CFU/g。该检测结果与何蕊等人的结果基本一致,均具有较高的灵敏度[13]。
临床样品检测过程中,400份奶牛肛门擦拭样品PCR检测结果均为C.fetus阴性,同样传统平板分离方法同步检测结果也均为C.fetus阴性,两者检测结果相符,显示该PCR方法具有良好的实用性。传统平板分离方法同步检测到空肠弯曲菌、唾液弯曲菌和豚肠弯曲菌的存在,但该PCR方法检测结果中未产生非特异性条带,再次表明其具有较好的特异性。400份样品均未分离出C.fetus,这可能与该地区C.fetus的分布和流行情况有关。目前国内未有报道说该地区暴发过C.fetus感染[14]。10份对照组中,PCR检测结果均为C.fetus阳性,平板分离法8份为C.fetus阳性,可能原因与样品的增菌过程有关,肛门擦拭样中含有多种肠道细菌如大肠杆菌、屎肠球菌等,这些细菌均为兼性厌氧菌,在营养丰富的弯曲菌增菌培养液中生长旺盛,增殖活跃,繁殖周期短,使得生长缓慢的弯曲菌失去生长优势而被掩盖,难以被传统的平板分离法检出,而灵敏度较高的PCR方法则只需微量的DNA就能将C.fetus检出[15]。
综上所述,本研究建立的C.fetusPCR检测方法具有特异性强、敏感度高、简便快速等特点,适用于食品和环境中弯曲菌的检测,克服了传统鉴定方法的不足,为C.fetus的快速检测提供技术支持,对于识别该菌株的暴发流行,相关疾病的诊断、控制以及C.fetus分子流行病学研究具有重要意义。
利益冲突:无
