共生菌与口腔扁平苔藓的相关性研究
2019-09-11郑赛巍周杨一帆蔡丽婷李玉婷
郑赛巍, 周杨一帆, 蔡丽婷, 李玉婷, 何 园
(1. 同济大学口腔医学院和同济大学附属口腔医院口腔黏膜病教研室,上海牙修复与再生工程实验中心,上海 200072; 2. 同济大学口腔医学院和同济大学附属口腔医院口腔颌面外科教研室,上海牙修复与再生工程实验中心,上海 200072; 3. 同济大学生命科学与技术学院生物信息学科,上海 200092)
口腔扁平苔藓(oral lichen planus, OLP)是发生于口腔黏膜的慢性炎症性疾病,是口腔黏膜三大常见病之一。该病往往慢性迁延,反复发生糜烂、疼痛,很难彻底根治,严重影响患者的生活质量,部分病损可发展为口腔鳞癌,其病因及发病机制不明[1]。随着微生物组学研究的不断深入,越来越多的证据表明,与人体密切接触的口腔共生菌可能是促进机体发生局部免疫失衡的重要因素[2],共生菌是指与人体生物体共同生存的细菌,共生菌群组成的改变,即有益菌与致病菌的平衡失调,与多种局部与全身性疾病的发生发展密切有关[3],但目前尚未见到口腔共生菌与OLP发病相关性的研究。因此,本研究旨在探索口腔共生菌产黑普氏菌在OLP的发生发展中的作用。
1 材料与方法
1.1 研究对象
收集2015年—2017年于同济大学附属口腔医院就诊的口腔扁平苔藓患者共43例,非糜烂型与糜烂型,所有患者均经临床检查及活检证实。排除标准: (1) 患有全身系统性疾病及肿瘤;(2) 涎腺疾病;(3) 近6个月使用皮质激素、免疫调节剂等药物治疗;近1个月使用抗生素;(4) 女性处于月经期、妊娠期或哺乳期;(5) 药物或银汞合金充填物可能引起苔藓样反应者;(6) 患有除口腔扁平苔藓外其他黏膜病;(7) 吸烟。正常对照组48例为拔牙或外科小手术患者,年龄、性别与实验组相匹配。所有OLP患者及对照组均签署知情同意书,本项目实验计划得到同济大学科学与伦理委员会审核与批准。
1.2 样本收集
OLP颊黏膜病损表面菌群样本: 用无菌黏膜拭子,擦拭OLP病损部位表面10次,-80℃保存备用。
OLP病损组织样本: 用1%碘酊棉球及乙醇棉球常规消毒后,切取OLP 5mm×5mm大小病损部位组织,迅速置于TRIzol A+试剂中,-80℃保存备用。
1.3 试剂
颊拭子DNA提取试剂盒Gentra Buccal Cell Kit购自美国凯杰生物技术有限公司,FastQuant cDNA第一链合成试剂盒,SuperReal荧光定量预混试剂(增强版)购自天根生化科技(北京)有限公司,氯仿、无水乙醇、DEPC水购于生工生物工程(上海)股份有限公司。
1.4 方法
1.4.1 颊拭子基因组DNA提取 取出颊黏膜拭子,用无菌剪剪断颊拭子头部,置于1.5mL离心管,根据试剂盒说明书,加300μL细胞裂解液,加1.5μL蛋白酶K,颠倒混匀25次后置于65℃水浴中至少1h,将棉拭子拿出,尽量去除头部的液体,加1.5μL去RNA溶液,上下颠倒25次,37℃水浴15min,加100μL蛋白沉淀溶液,高速振荡20s,冰浴5min,13000~16000 ×g离心3min。准备一个新的1.5mL离心管,加入300μL异丙醇和0.5μL糖原溶液,离心后吸取上清液加入异丙醇当中,轻柔翻转50次,13000~16000 ×g离心5min,去上清液,用70%乙醇洗涤沉淀,13000~16000 ×g离心1min,加30μL DNA溶解液65℃水浴1h溶解DNA,盖紧管盖,室温轻摇过夜,测DNA浓度,-20℃保存备用。
1.4.2 颊拭子基因组16S rRNA扩增 针对细菌16S rRNA V4可变区设计引物,引物序列见表1。为区分样本,每个样本设计其独特的条码序列,连接在正向引物上。最终测序产物为: 条码序列+正向引物+barcode+目的序列+反向引物。PCR扩增程序: 98℃,2min,1个循环;98℃,10s,55℃,20s,72℃ 30s 32循环;72℃ 5min;4℃结束。
1.4.3 高通量测序及生物信息学分析 测序平台为Illumina Hiseq(PE250),用Trimmomatic和QIIME(version 1.8)对序列进行处理和分析,过滤序列测序质量分数低于20,无法成对拼接以及序列长度低于200bp的序列。用UCLUST进行OTU聚类,以相似度97%划分操作分类单元(operational taxonomic units, OTUs),Greengenes数据库进行比对,用RDP分类器进行物种分类注释。运用QIIME计算稀释曲线和多样性指数,并应用Unweighted UniFrac方法计算样本差异矩阵距离,然后进行主成分分析(PCoA)。
1.4.4 总RNA提取及反转录 按照氯仿法提取组织中总RNA,将组织剪碎加入预离心的PLG管,每1mL TRIzol A+加入200μL氯仿,剧烈振荡15s,室温放置2~3min,4℃ 12000 ×g离心15min,将上层水相转移至另一RNAse-free的离心管,加入等体积异丙醇,彻底混匀,室温放置10min,4℃ 12000 ×g离心10min,弃上清液,75%乙醇清洗沉淀,4℃ 7500 ×g离心5min,DEPC水溶解RNA。按照反转录试剂盒说明书反转RNA,调整终浓度为25ng/μL。
1.4.5 qPCR方法 检测OLP颊黏膜病损表面菌群中产黑普氏菌含量的qPCR反应体系: 2×SuperReal 5μL,50×ROX 0.2μL,上下游引物各0.3μL基因组DNA(10ng/μL)2μL,dd H2O 2.2μL。反应条件: 95℃ 5min 1个循环;95℃ 10s,60℃ 32s,40个循环。2-ΔΔCt法分析基因相对表达情况。
OLP病损组织中产黑普氏菌及细胞炎症因子含量的qPCR反应体系: 2×Super Real 10μL,50×ROX 2μL,上下游引物各0.6μL,cDNA 2μL,dd H2O 4.8μL。反应条件: 95℃ 5min;95℃ 10s,60℃ 20s,72℃ 27s;共40个循环。并用2-ΔΔCt法分析基因相对表达情况,引物见表1。

表1 引物序列表

(续表1)
F为正义链,R为反义链;F/R为高通量测序引物,Pmg-F/R为产黑普氏菌基因组DNA qPCR引物,Pmc-F/R为产黑普氏菌cDNA qPCR引物
1.5 统计学处理
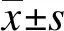
2 结果
2.1 一般资料
采集OLP颊黏膜病损表面菌群样本共43例,其中非糜烂型23例,糜烂型20例,正常对照组48例,两组患者年龄、性别构成比差异无统计学意义,见表2。

表2 研究对象基本信息
*检验方法为χ2检验,#检验方法为单因素方差分析
2.2 口腔扁平苔藓颊黏膜病损表面菌群高通量测序及生物信息学分析结果
经质控后得3242615条测序数据,平均每个样本测序条数为35600条,平均测序长度为428bp。样品稀释度如图1A,可见随着样本测序条数增加,样品稀释度指数趋近于1,提示样本测序深度足够,结果可信。糜烂型、非糜烂型OLP颊黏膜菌群Shannon多样性均高于对照组,且具有统计学意义(图1B),提示OLP颊黏膜表面菌群的种类更为丰富。主坐标分析显示糜烂型OLP与非糜烂型OLP颊黏膜表面菌群结构均能与正常对照明显分开,提示OLP颊黏膜表面菌群结构发生了显著性改变(图1C);而糜烂型OLP组与非糜烂型OLP组交叉较多。本课题组通过宏基因组学与最新生物信息学方法成功将细菌的识别度延伸至种水平,发现产黑普氏菌在OLP颊黏膜表面构成比显著增加,且在门、科、属、种各层次上的差异均有统计学意义(图1D),提示该菌可能在OLP发生发展过程中起到重要作用。
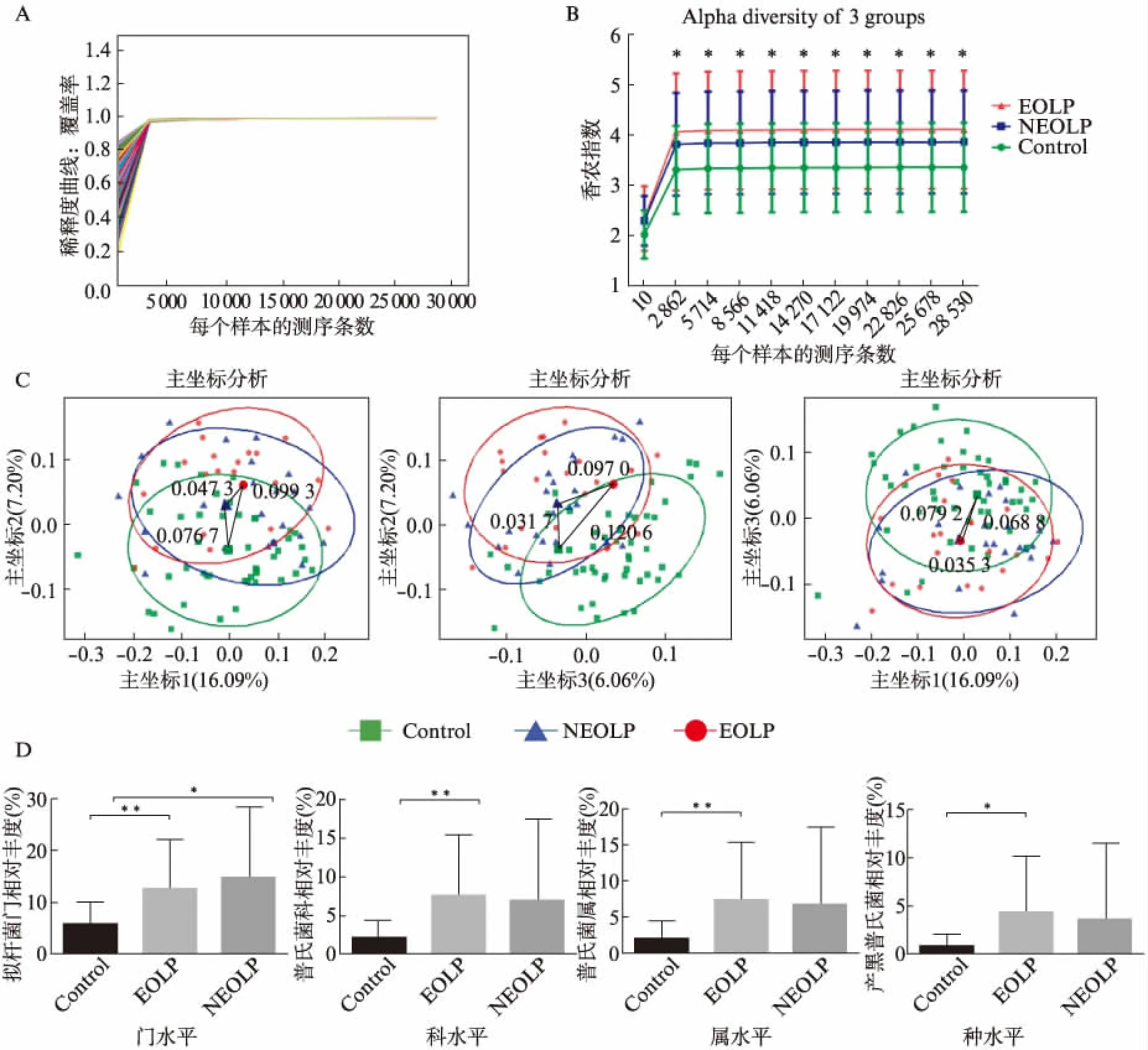
图1 口腔扁平苔藓颊黏膜病损表面菌群分析Fig.1 Bacterial flora analysis of OLP buccal mucosa lesion surfaceA: 样品稀释度曲线,接近于1,提示测序深度足够,样本可信;B: α多样性,糜烂型和非糜烂型OLP的Shannon多样性指数大于正常对照,差异有统计学意义;C: 主坐标分析显示糜烂型OLP与非糜烂型OLP颊黏膜表面菌群均能与正常对照明显分开,提示OLP颊黏膜表面菌群结构发生了显著性改变;D: 基于不同分类单元的门、科、属、种水平差异菌;*P<0.05;**P<0.01 ;***P<0.001;Control:正常对照;NEOLP:非糜烂型口腔扁平苔藓;EOLP:糜烂型口腔扁平苔藓
2.3 采用qPCR进一步验证高通量测序获得的结果
进一步采用qPCR检测OLP颊黏膜病损表面菌群中产黑普氏菌的含量。OLP患者颊黏膜表面产黑普氏菌含量(NEOLP: 5.801,EOLP: 2.61)高于正常对照(1.051),非糜烂型OLP(P=0.0001)和糜烂型OLP患者(P=0.00316)颊黏膜表面产黑普氏菌含量均高于正常对照,差异有统计学意义,与高通量测序所获得的结果一致。
2.4 口腔扁平苔藓病损组织中产黑普氏菌及细胞炎症因子含量的变化
qPCR检测OLP病损组织中产黑普氏菌以及细胞炎症因子的含量变化,可见OLP病损组织中产黑普氏菌含量高于正常组织(P=0.0074),同时IL-6含量也高于正常组织(P=0.0243),且二者间有相关性,提示产黑普氏菌可能通过激活炎症信号通路在OLP的致病过程中起到一定作用,见图2。

图2 口腔扁平苔藓病损组织中产黑普氏菌 及细胞炎症因子含量的变化Fig.2 Changes in the contents of Prevotellamelaninogenica and inflammatory cytokines in OLP lesionsA: qPCR检测组织中产黑普氏菌及细胞因子含量;B: 产黑普氏菌与IL-6相关性;*P<0.05;**P<0.01
3 讨 论
OLP是发生在口腔的慢性炎症性疾病,全球发病率约为0.1%~2%,好发于中年女性,临床表现分为糜烂型和非糜烂型,疼痛迁延不愈影响患者生活且部分可发展为口腔鳞癌,被WHO列为癌前状态。目前国内外学者公认的观点是免疫失调在OLP发病过程中起到重要的作用[1]。随着微生物组学研究的不断深入,人们发现,微生物和人体共同进化,与全身健康与疾病的易感性密切相关,被誉为人体的“共生功能体”[4]。细菌是黏膜免疫反应的关键驱动因素,可诱导上皮角质细胞基因表达和功能的改变[5]。当发生微生态失衡时,可导致T细胞活化而促发免疫功能失调,与多种局部和系统性疾病相关[2]。目前尚不清楚何种因素诱发了OLP的免疫失调,但越来越多的证据表明,与人体密切接触的口腔共生菌可能是促进该病理过程的重要因素。
本课题组前期研究发现OLP颊黏膜表面微生物群落多样性增加,其菌落结构与正常相比发生显著性改变[6]。多个来自不同研究者的研究支持本课题组的研究结果,发现OLP病损黏膜表面及唾液中存在菌群结构的改变[7-10],且牙周致病菌在菌群中的构成比升高[9],提示牙周致病菌在OLP发病过程中起到直接或间接的作用[10]。
随着近年来测序技术的长足进步,本课题进一步通过Illumina Miseq高通量测序,扩大样本量,加深测序深度(平均35600每次测序的读长/样本),进一步验证了前期研究结果,并采用最新生物信息学方法成功将细菌的识别度精确至种水平(目前多数研究的细菌识别度仅能达到属水平),发现产黑普氏菌(Prevotellamelaninogenica)在OLP颊黏膜表面构成比显著增加,且在目、科、属、种各层次上的差异均有统计学意义,采用qPCR方法进一步验证了产黑普氏菌在OLP颊黏膜表面菌群的构成比增加,提示产黑普氏菌可能在OLP发病过程中起到重要作用。
主坐标分析显示,糜烂型OLP与非糜烂型OLP颊黏膜表面菌群结构均能与正常对照明显分开,提示OLP颊黏膜表面菌群结构发生了显著性改变;而糜烂型OLP组与非糜烂型OLP组交叉较多。既往研究也提示糜烂型与非糜烂型OLP病损表面微生物群落组成差别不大[6]。产黑普氏菌在糜烂型与非糜烂型OLP中的相对构成比差异并无统计学意义(P=0.3810),推测该菌可能在健康向OLP进展过程中发挥作用,而与OLP的类型无关,提示不同类型的OLP发病机制相似,仅为同一种疾病的不同状态。
普氏菌(Prevotellaspecies)是黏膜部位如口腔、呼吸道、肠道等的共生菌[11],是口腔唾液核心菌群之一[12]。产黑普氏菌属于普氏菌中的一个种,是革兰阴性厌氧球杆菌,在血平板上可产生黑色素,是与牙周炎[13]、根管内及根尖周感染[14]密切相关的致病菌。越来越多的研究表明,在一些局部及系统性疾病如牙周炎、细菌性阴道炎、类风湿性关节炎、代谢紊乱及轻度系统性炎症中,普氏菌在菌群中的相对丰度增加,且与Th17介导的黏膜炎症相关[15]。普氏菌能够通过刺激上皮角质细胞产生IL-8,IL-6及CCL20,从而促进黏膜Th17免疫反应[16]。小鼠体内定植实验表明,普氏菌与炎症性疾病具有因果关系[17]。与其他共生菌相比,普氏菌显现出明确的刺激细胞炎症因子释放的促炎效应[15,18]。产黑普氏菌在子宫内膜炎中检出占主导地位,达30%,被认为是子宫内膜炎的致病菌[19]。该菌的LPS具有细胞因子诱导活性[20],并可能通过T9SS分泌毒力因子致病[21]。
本实验检测了OLP活检组织中产黑普氏菌的含量以及局部细胞炎症因子的表达情况,结果显示与正常对照相比,OLP病损组织中该菌含量显著增加且与IL-6表达水平成正相关,提示该菌可能是潜在致病菌,参与促进了OLP局部免疫失衡。推测产黑普氏菌可能通过以下机制促进OLP发病: 产黑普氏菌通过T6SS分泌蛋白酶[21],破坏上皮屏障,在上皮屏障功能受损与上皮表面菌群失调的共同影响下,产黑普氏菌侵入到上皮基底层及固有层;侵入到细胞中的细菌作为靶抗原,被固有免疫细胞及上皮角质细胞识别,激活NF-κB等通路,导致下游多种细胞因子、趋化因子的表达,CD4+、CD8+T淋巴细胞募集、浸润并攻击上皮角质细胞,导致基底细胞层液化变性,上皮屏障功能进一步受损,这一恶性循环最终导致感染与慢性炎症状态的持续发生。
综上所述,共生菌可能在促进口腔扁平苔藓免疫失衡中发挥重要作用,其具体机制值得深入研究。
