野生油茶根围土壤的AM真菌多样性调查
2019-09-10周光荣尚昆江龙
周光荣 尚昆 江龙

摘 要:为探明野生油茶根围土壤AM真菌的种类组成与多样性。对野生油茶根围土壤AM真菌进行分离与形态学鉴定,同时提取土壤DNA,进行高通量测序,通过形态学鉴定出3属6种AM真菌,分别为台湾硬囊霉、悬钩子硬囊霉、黄孢球囊霉、长孢球囊霉、蜜色无梗囊霉和柯氏无梗囊霉;通过高通量测序鉴定出球囊霉属、原囊霉属、近明囊霉属等6属42种AM真菌,其中有36个VT种;VTX00166和球囊霉属分别为野生油茶根围土壤AM真菌的优势种和优势属;与形态学鉴定相比,高通量测序能检测出更多的AM真菌种类。
关键词:油茶;AM真菌;高通量测序;多样性
中图分类号:Q939.5
文献标识码: A
油茶( Camellia oleifera) 为山茶科山茶属的灌木或小乔木, 是我国特有的木本油料树种[1],主要分布在江西、湖南、广西、广东、贵州、云南、四川等省份[2]。从油茶籽中提取的油茶籽油富含不饱和脂肪酸,与橄榄油相似,被称为“东方橄榄油” ,长期食用,具有降低胆固醇、预防心血管疾病的作用[3-4]。AM真菌作为一类分布极为广泛的土壤微生物,能与陆地生态系统中80%以上的高等植物形成菌根结构,促进植物群落的构建,调控营养元素循环,维持生态系统稳定性[5]。野生油茶能与丛枝菌根(Arbuscular Mycorrhiza,AM)真菌共生形成菌根结构,但野生油茶根围土壤AM真菌的种类组成与多样性相关研究报道鲜见。目前,植物共生AM真菌多样性研究主要通过AM真菌孢子的形态学鉴定,但由于受产孢时间及鉴定者辨识能力的影响,造成鉴定种类远远低于实际共生种类[6]。高通量测序具有分辨率高,测序耗时短,测序结果准确率高等特点用于自然环境中AM真菌多样性研究[7-9]。本文通过土壤AM真菌高通量测序技术与孢子形态学鉴定相结合,摸清野生油茶根围土壤AM真菌的种类组成与多样性特征,探究野生油茶在自然环境中的共生状况。
1 材料与方法
1.1 样品的采集及预处理
在贵州省贵阳市花溪区野生油茶林下设置3个采样点(样点a、b、c),每个采样点随机选取15株长势相似的野生油茶,采用抖落法[10]收集其根围土壤,然后过2 mm土壤筛子,充分混匀。将样品均分,1份装入10 mL的无菌离心管中于冰盒保存,进行高通量测序,1份用于AM真功形态学鉴定。
1.2 形态学鉴定
称取20 g土样,采用湿筛倾析-蔗糖离心法[11]分离AM真菌孢子,将分离得到的孢子于体式显微镜下观察,根据孢子的大小、形状、颜色,连孢菌丝等进行初步分类统计,挑取孢子于载玻片上,在光学显微镜下观察孢子果及孢子的大小、形状、颜色、表面纹饰,Melzer′s试剂反应等特征并进行拍照。根据AM真菌分类专业网站(http://www.amf ̄phylogeny.com/)和相关INVAM网站(http://invam.wvu.edu/home)、波兰农业大学(http://www.zor.zut.edu.pl/)、Mycobank Database(http://mycobank.org/)的种类描述,参阅本实验室的AM真菌资源进行种属鉴定。
1.3 总DNA提取、18S rDNA序列扩增及高通量测序
根据Fast DNA SPIN Kit for Soil(MP Biomedical,USA)的使用说明进行总DNA的提取。DNA 浓度和纯度利用NanoDrop2000 进行检测,利用1%琼脂糖凝胶电泳检测DNA 提取质量。用两对特异性引物AML1/AML2(5′-ATCAACTTTCGATGGTAGGATAGA-3′;5′-GAACCCAAACACTTTGG-TTTCC-3′)和AMV4-5NF/AMDGR(5′-AAGCTCGTAGTTGAATT-TCG-3′;5′-CCCAACTAT-CCCTATTAATCAT-3′)进行巢式PCR扩增[12]。第一次扩增程序为:95 ℃ 预变性3 min,32个循环(95 ℃ 变性30 s,55 ℃ 退火30 s, 72 ℃ 延伸45 s),最后72 ℃延伸10 min;扩增体系为20 μL,4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu 聚合酶;0.2 μL BSA,10 ng DNA 模板,补ddH2O至20 μL。第二次PCR反应以第一次PCR扩增产物为模板,扩增程序为:95 ℃ 预变性3 min,30 个循环(95 ℃ 变性30 s,55 ℃ 退火30 s, 72 ℃ 延伸30 s),最后72 ℃延伸10 min (PCR 仪:ABI GeneAmp 9700 型);扩增体系与第一次相同。PCR产物由上海美吉生物医药科技有限公司Illumina Miseq平台进行高通量测序。
1.4 高通量测序数据处理
原始测序序列经Trimmomatic软件进行质控,去除低质量的序列,FLASH 软件进行拼接,得到优化后的序列。再使用Usearch軟件(vsesion 7.0 http://drive5.com/usearch/),根据97%的相似度对序列进行OTU 聚类,并在聚类的过程中去除单序列和嵌合体。从每个OTU中选择代表序列与MaarjAM数据库(https://www.maarjam.botany.ut.ee/)进行比对,将序列相似度≥97%、查询序列的对齐长度≥95%、e值<1e-50视为虚拟分子种(virtual taxa;VTs),与MaarjAM数据库不匹配的序列进一步基于INSDC数据库,在序列相似度90%和查询序列的对齐长度90%的基础上选出疑似球囊菌亚门的序列[13]。
1.5 数据分析
使用I-Sanger生物信息分析云平台(https://www.i ̄sanger.com/)绘制稀释曲线。使用RStudio与R语言(3.6.0)进行统计分析,vegan包计算α多样性指数,pheatmap包绘制热图,statnet包和circlize包绘制弦状图。使用MEGA7软件进行序列比对和构建Neighbor ̄Joinning系统发育树。
2 结果与分析
2.1 测序质量
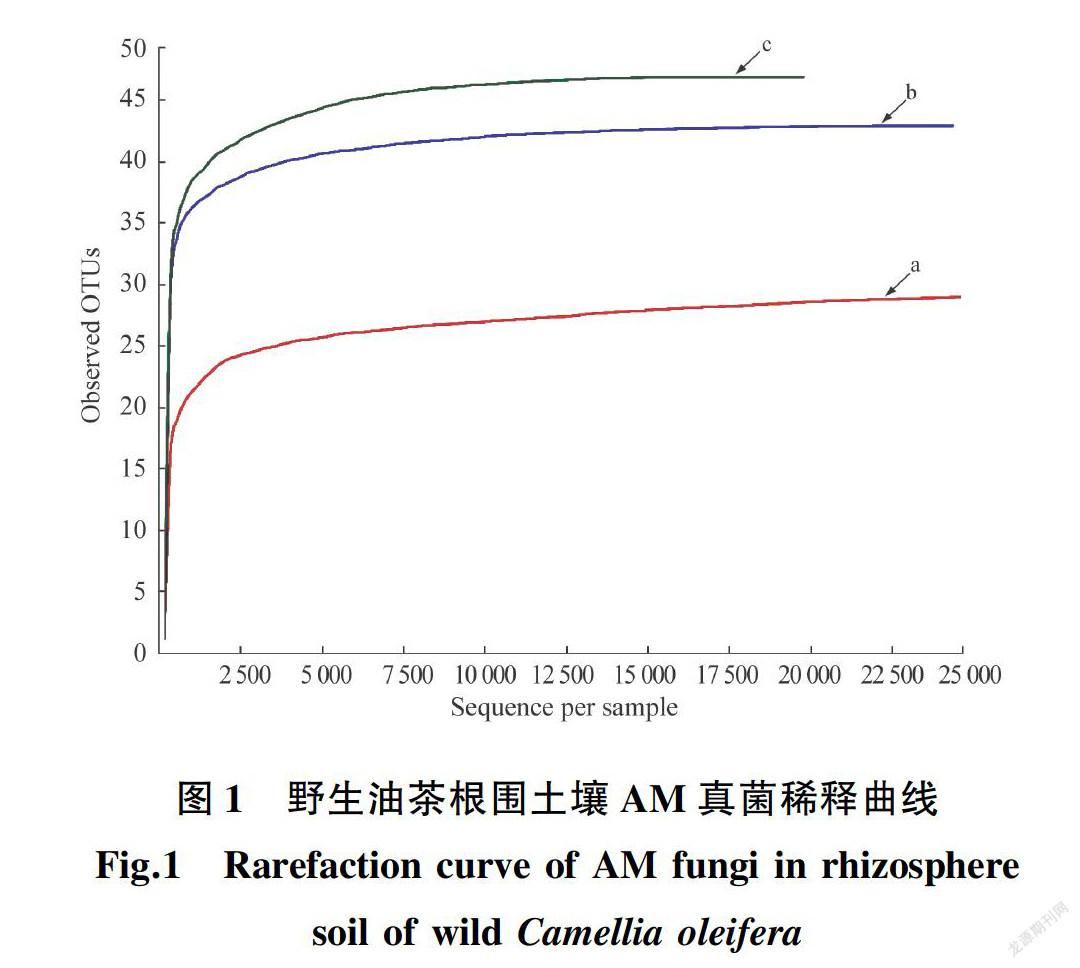
通过高通量测序,从样点a、样点b、样点c分别获得24 790,24 828,20 866条有效序列;OTUs数分别为29,43,47个,共67个。由图1可知,3个样点的稀释曲线均已趋于平坦,说明测序深度可以反映野生油茶根围AM真菌的基本信息。
2.2 AM真菌的系统发育分析
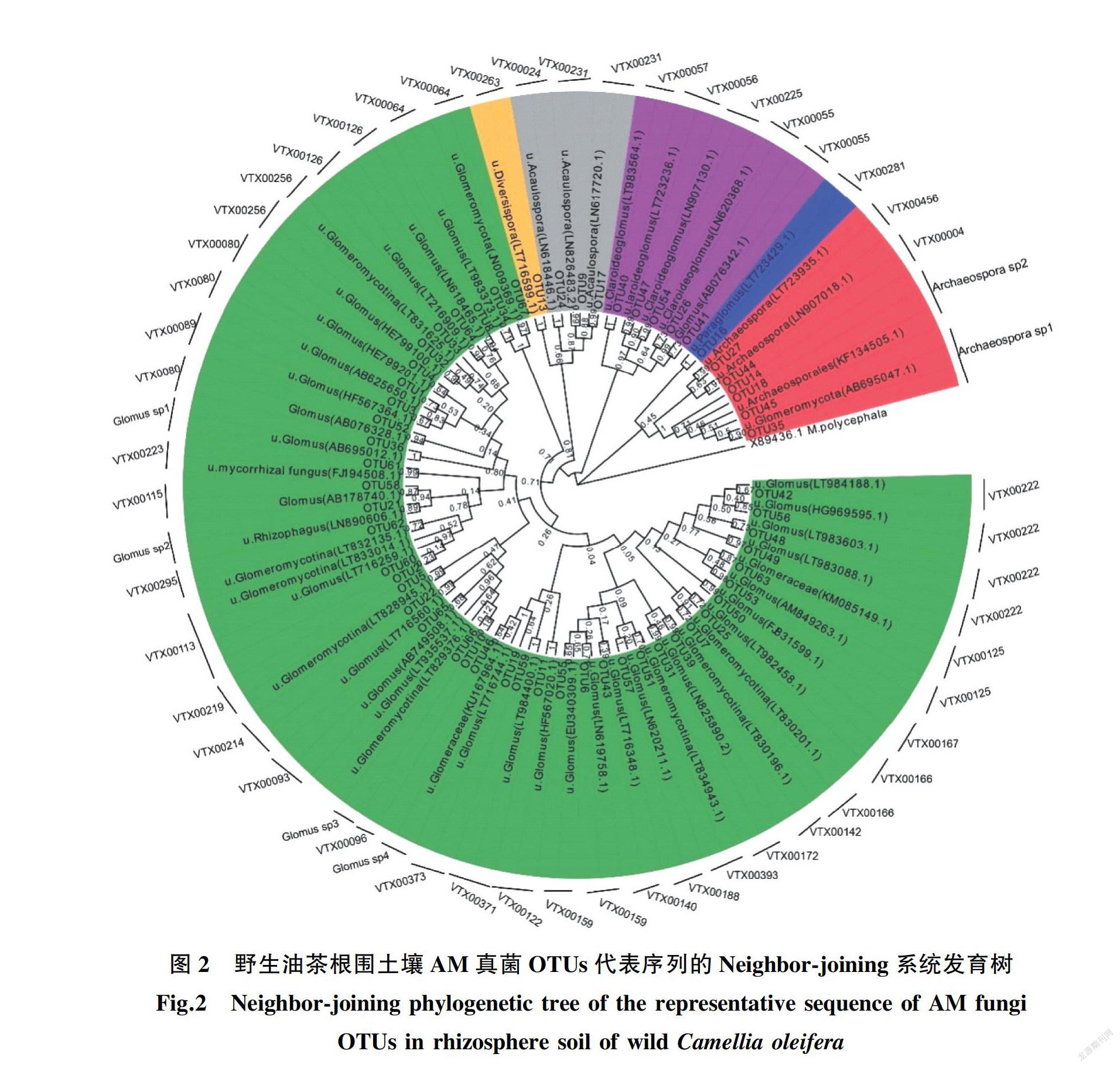
将67个OTUs的代表序列与MaarjAM数据库和INSDC数据库进行比对,发现58个OTUs属于AM真菌。采用邻接法(Neighbor ̄joining)对58个OTUs的代表序列进行系统发育分析,58个OTUs分属于6属42种,其中包含36个VT种(图2)。6个属分别为球囊霉属(Glomus)、原囊霉属(Archaeospora)、近明囊霉属(Claroideoglomus)、无梗囊霉属(Acaulospora)、类球囊霉属(Paraglomus)、多孢囊霉属(Diversispora);在6个属中,球囊霉属有26个VT种,原囊霉属有2个VT种,近明囊霉属有4个VT种,无梗囊霉属有2个VT种,类球囊霉属和多孢囊霉属分别有1个VT种。
2.3 AM真菌属水平的相对丰度分析
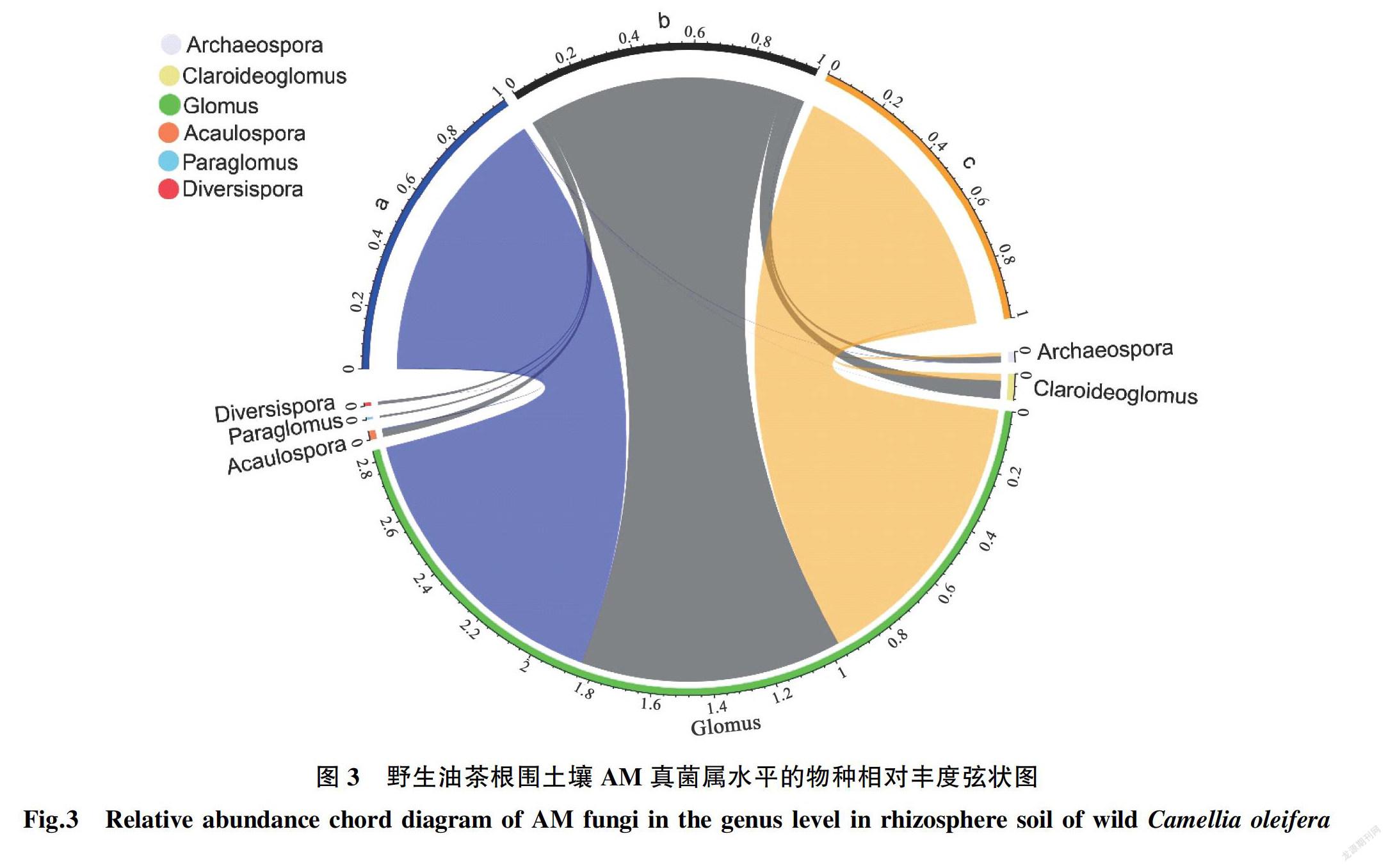
从属水平上来看(图3),样点a共检测到球囊霉属(Glomus)、原囊霉属(Archaeospora)、近明囊霉属(Claroideoglomus)、无梗囊霉属(Acaulospora)、多孢囊霉属(Diversispora)这5个属,其相对丰度分别为99.44%、0.16%、0.02%、0.33%、0.05%。样点b共检测到球囊霉属(Glomus)、原囊霉属(Archaeospora)、近明囊霉属(Claroideoglomus)、无梗囊霉属
(Acaulospora)、类球囊霉属(Paraglomus)、多孢囊霉属(Diversispora)这6个属,其相对丰度分别为87.63%、1.99%、6.17%、2.49%、0.71%、1.01%。样点c共检测到球囊霉属(Glomus)、原囊霉属(Archaeospora)和近明囊霉属(Claroideoglomus)3个属,其相对丰度分别为96.54%、1.17%和2.29%。其中球囊霉属(Glomus)的总相对丰度为94.54%,远高于其他5个属,为野生油茶根围AM的优势属。
2.4 AM真菌的种丰度分析
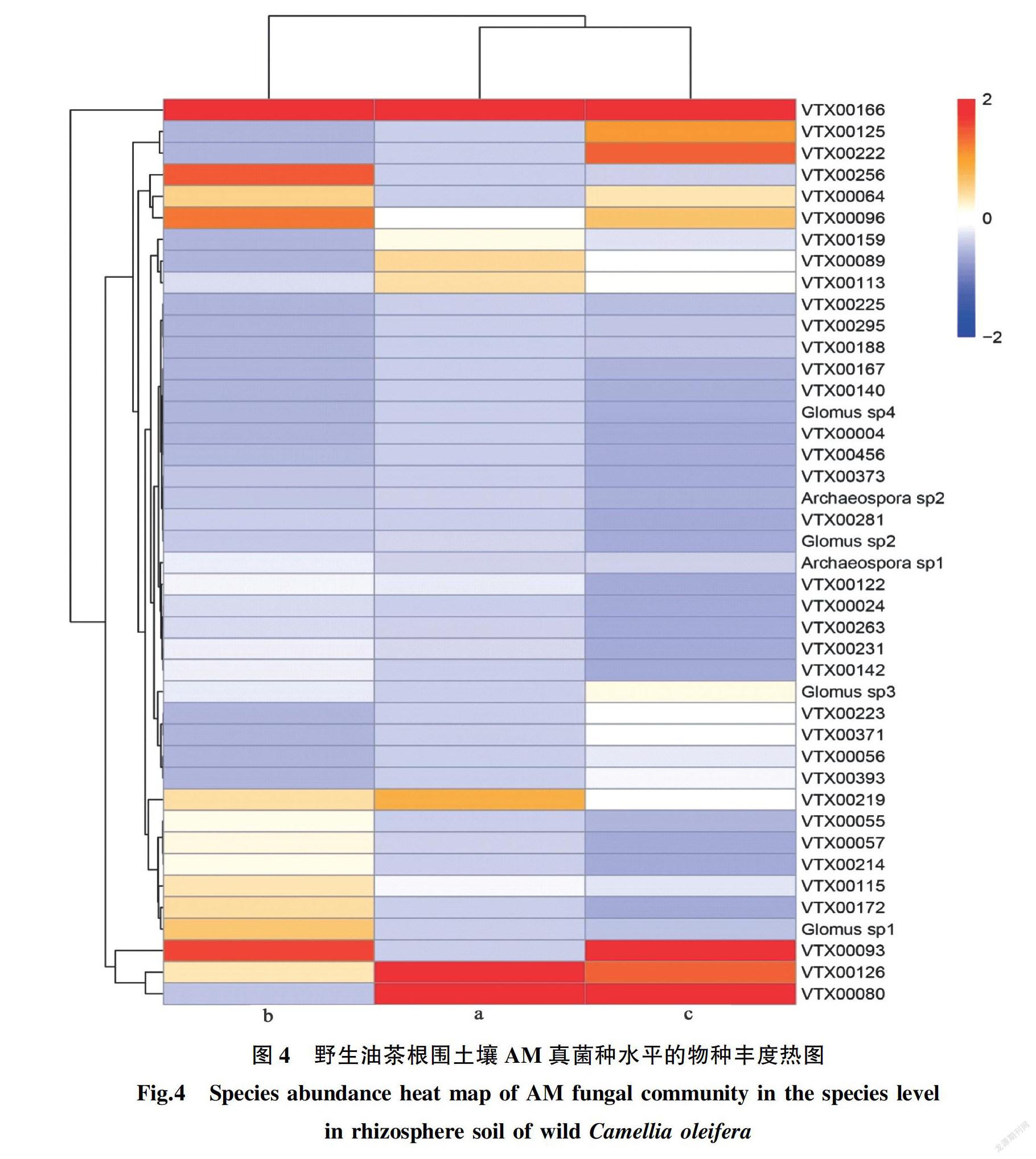
将所有种的相对丰度经过标准化处理后,绘制种水平的丰度热图(图4)。图中越偏红表示其丰度越高,越偏蓝表示其丰度越低。样点a丰度较高的种有VTX00166、VTX00126、VTX00080、VTX00219;样点b丰度较高的种有VTX00166、VTX00093、VTX00096、VTX00256;样点c丰度较高的种有VTX00093、VTX00126、VTX00080、VTX00166。VTX00166在3个样点都被检测到,且丰度最高,为野生油茶根围AM真菌的优势种。
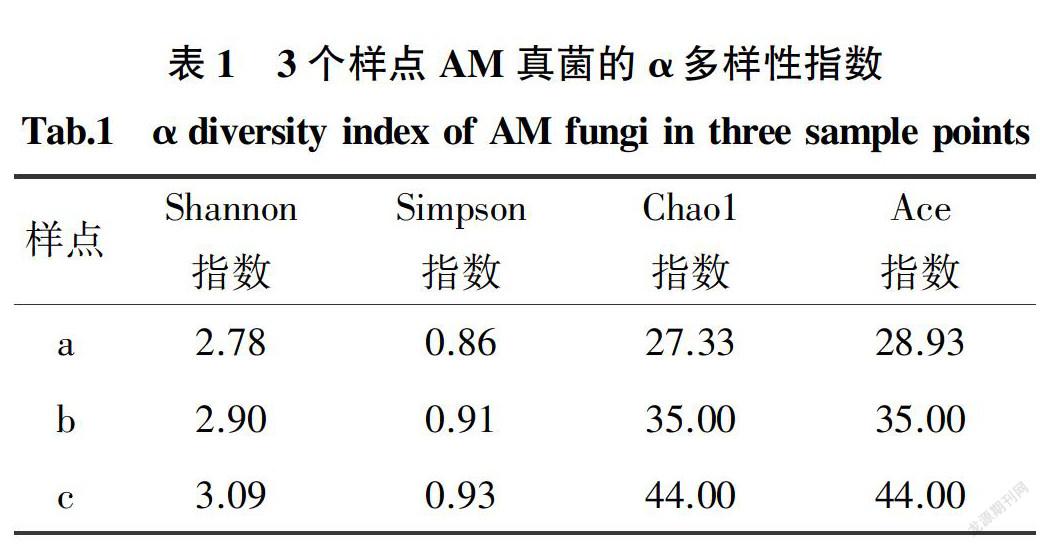
2.5 野生油茶根围AM真菌的α多样性指数
利用R语言中vegan包对58个AM真菌的OTUs进行分析,得到3个样点的AM真菌多样性指数(表1)。野生油茶根围AM真菌的Shannon指数在2.78~3.09,Simpson指数在0.86~0.93,Chao1指数在27.33~44.00,Ace指数在28.93~44.00。
2.6 野生油茶根围AM真菌的形态学鉴定
通过形态学鉴定出3属6种AM真菌(图5)。分别为硬囊霉属2种:台湾硬囊霉(Sclercystis Taiwanensis)和悬钩子硬囊霉(Sclercystis rubiforme);球囊霉属2种:黄孢球囊霉(Glomus flavisporum)和长孢球囊霉(Glomus dolichosporum);无梗囊霉属2种:蜜色无梗囊霉(Acaulospora mellea)和柯氏无梗囊霉(Acaulospora koskei)。
3 讨论
本研究采用高通量测序技术对野生油茶根围土壤AM真菌多样性进行调查,分析了野生油茶根围土壤AM真菌在属和种分类水平上的优势类群,共检测出球囊霉属、原囊霉属、近明囊霉属等6属42种,其中球囊霉属为优势属,优势种VTX00166亦属于球囊霉属,与WU等[14]在柑橘根围土壤发现的优势属结果一致。但覃晓娟等[15]在广西红壤区甘蔗根围土壤中发现的优势属为根生囊霉属,说明了不同宿主植物根围土壤的AM真菌存在不同的优势类群。
本研究通过形态学鉴定出6种AM真菌,分別为台湾硬囊霉、悬钩子硬囊霉、黄孢球囊霉、长孢球囊霉、蜜色无梗囊霉、柯氏无梗囊霉。其中部分AM真菌在其他植物根围也有发现,分布广泛;如王幼珊等[16]在小叶青冈根围发现了台湾硬囊霉,罗协等[17]在铁仔根围发现了悬钩子硬囊霉和黄孢球囊霉。依靠形态学鉴定往往丢失了不产孢的种类,从而低估了AM真菌的物种多样性[18];因此,与高通量测序相比,形态学鉴定可识别的AM真菌物种数相对较少;高通量测序更能反映野生油茶根围AM真菌多样性的真实情况。但目前通过高通量测序技术还无法分离AM真菌,只有通过孢子形态来分离鉴定AM真菌,所以保存AM真菌资源还离不开孢子形态学鉴定方法。
参考文献:
[1]王瑞,陈隆升,王湘南,等. 氮素形态对油茶苗木生长及生理指标的影响[J]. 南京林业大学学报(自然科学版),2019,43(4):26-32.
[2]徐煲铧,罗丽君,李永泉,等. 粤北小坑镇油茶林土壤养分状况调查与评价[J].林业与环境科学, 2018,34(6):44-50.
[3]黄鑫,张利军,张保艳.油茶籽油提取方法对比分析[J].中国油脂, 2019,44(6):9-13.
[4]陈劲松,赖琼玮,黄闺,等.霉变油茶籽对压榨油茶籽油的影响研究[J].中国油脂,2019,44(3):99-101.
[5]柴宇星.祁连山阴阳坡丛枝菌根真菌多样性及群落构建机制研究[D].兰州:兰州大学,2018.
[6]成斌,许伟,胡从从,等. 比较形态学、聚丙酰胺凝胶电泳与二代测序在AM真菌群落研究中的应用[J].菌物学报, 2018,37(9):1170-1178.
[7]王艳云,郭笃发.黄河三角洲盐碱地AM真菌多样性[J].分子植物育种,2016,14(8):2232-2238.
[8]成斌. 塞北荒漠羊柴AM真菌群落结构和物种多样性研究[D].保定:河北大学,2017.
[9]张晓晓. 典型喀斯特地区土壤AM真菌多样性及其影响因素研究[D]. 桂林:广西师范大学,2018.
[10]RILEY D, BARBER S A. Bicarbonate Accumulation and pH Changes at the Soybean (Glycine max (L.) Merr.) Root ̄Soil Interface1 [J]. Soil Science Society of America Journal,1969, 33(6):905-908.
[11]袁腾,陶光耀,江龙.梵净山4种林型的土壤丛枝菌根真菌多样性[J].东北林业大学学报, 2018,46(3):83-86.
[12]VAN GEEL M, BUSSCHAERT P, HONNAY O, et al. Evaluation of six primer pairs targeting the nuclear rRNA operon for characterization of arbuscular mycorrhizal fungal (AMF) communities using 454 pyrosequencing[J]. Journal of Microbiological Methods, 2014,106: 93-100.
[13 ]蒋胜竞.几种环境因子对高寒草甸AM真菌群落结构与功能的影响研究[D].兰州:兰州大学, 2018.
[14]WU Q, SUN P, Srivastava A K. AMF diversity in citrus rhizosphere[J]. Indian Journal of Agricultural Sciences, 2017,87(5): 653-656.
[15]覃晓娟,廖楠,张金莲,等. 广西红壤区甘蔗根际土壤丛枝菌根真菌种类的18S rDNA基因序列分析鉴定及多样性分析[J].热带作物学报, 2018,39(11):2241-2249.
[16]王幼珊,张美庆,邢礼军,等. 我国东南沿海地区的VA菌根真菌 Ⅰ.四种硬囊霉[J].真菌学报, 1996,15(3):161-165.
[17]罗协,娄娅,崔菁苗,等. 三峡库区消落带常见野生植物AM真菌[J].菌物学报, 2016,35(7):822-832.
[18]劉润进,焦惠,李岩,等. 丛枝菌根真菌物种多样性研究进展[J].应用生态学报, 2009,20(9):2301-2307.
(责任编辑:周晓南)
Diversity Survey of AM Fungi in Rhizosphere
Soil of Wild Camellia oleifera
ZHOU Guangrong, SHANG Kun, JIANG Long*
(College of Life Sciences/ Key laboratory of Plant Resource Conservation and Germplasm Innovation
in Mountainous Region (Ministry of Education), Guizhou University, Guiyang 550025, China)
Abstract:
In order to explore the species compositionand diversity of AM fungi in rhizosphere soil of wild Camellia oleifera, three wild Camellia oleifera rhizosphere soils were collected for the isolation and morphological identification of AM fungi, and the soil DNAs were extracted and sequenced by high ̄throughput sequencing. The results show that six AM fungal species belonging to 3 genera were identified by morphology, including Sclercystis Taiwanensis, Sclercystis rubiforme, Glomusflavisporum, Glomus dolichosporum, Acaulospora mellea and Acaulospora koskei. High ̄throughput sequencing identified 42 species of AM fungal from 6 genera including Glomus, Archaeospora, Claroideoglomus, Acaulospora, Paraglomus, Diversispora, among which 36 VT species. VTX00166 and Glomus were the dominant species and dominant genus of AM fungi in rhizosphere soil of wild Camellia oleifera.High ̄throughput sequencing can detect more AM fungal species than morphological identification.
Key words:
Camellia oleifera; AM fungi; high ̄throughput sequencing; diversity
