不同抑郁模型大鼠行为学及神经营养因子表达的对比研究
2019-09-10赵洪庆杜青柳卓向韵刘林孟盼王宇红
赵洪庆 杜青 柳卓 向韵 刘林 孟盼 王宇红

〔摘要〕 目的 對比分析不同抑郁模型大鼠的生物学特点,为抑郁模型研究提供实验依据。方法 40只SD大鼠随机分为空白对照组、溶媒对照组、束缚应激组、慢性不可预见性温和应激(chronic unpredictable mild stress, CUMS)组,皮质酮注射组,每组8只。除对照组外,各组分别进行造模,时间均为21 d,造模结束后采用Morris水迷宫测试、旷场实验、强迫游泳实验检测大鼠的抑郁样行为,蛋白印迹法检测大鼠海马和前额叶皮质区脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)、神经生长因子(nerve growth factor, NGF)的含量。结果 与对照组比较,3种模型组大鼠逃避潜伏期时间均显著增加(P<0.01),但只有皮质酮组大鼠进入目标象限潜伏期时间增加(P<0.05);旷场测试中活动次数显著下降,其中CUMS组和皮质酮组对比束缚组有显著差异(P<0.01);同时,3种模型组大鼠强迫游泳中的不动时间均显著增加(P<0.01);此外,与对照组比较,各模型组大鼠海马和前额叶皮质区BDNF、NGF表达均显著下降(P<0.01或P<0.05),但各模型组之间相互比较,差异无统计学意义(P>0.05)。结论 慢性束缚应激、CUMS、慢性皮质酮注射均能使大鼠产生明显的抑郁样行为,且在脑内神经营养表达上差异无统计学意义。
〔关键词〕 抑郁模型;慢性不可预见性温和应激;束缚应激;皮质酮注射;神经营养因子
〔中图分类号〕R965.1;R749.4 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.07.007
〔Abstract〕 Objective To compare and analyze the biological characteristics of different depression model rats, and to provide experimental basis for the study of depression models. Methods A total of 40 SD rats were randomly divided into a blank control group, a vehicle control group, a restraint stress group, a chronic unpredictable mild stress (CUMS) group and a corticosterone injection group, with 8 rats in each group. Except for the control groups, each group was modeled separately for 21 days. Morris water maze test, open-field test and forced swimming test were used to test the rats' depression-like behaviors. The protein expressions of brain-derived neurotrophic factors (BDNF) and nerve growth factors (NGF) in the hippocampal and prefrontal cortex were detected by Western blotting. Results Compared with the control groups, the escape latency time of the 3 model groups was significantly increased (P<0.01), but only the target quadrant time of rats in the corticosterone injection group was increased (P<0.05). The number of activities in the open-field test was decreased significantly, and the numbers in the CUMS group and the corticosterone injection group were significantly different from that in the restraint stress group (P<0.01). Meanwhile, the immobility time of rats in the 3 model groups was significantly increased (P<0.01). In addition, compared with the control groups, the expressions of BDNF and NGF in hippocampal and prefrontal cortex in each model group were significantly decreased (P<0.01 or P<0.05), but there was no significant difference between each 2 model groups (P>0.05). Conclusion Chronic restraint stress, CUMS and chronic corticosterone injection can produce significant depressive behaviors in rats, and there is no statistically significant difference in the neurotrophic expression of the brain.
〔Keywords〕 depressive model; chronic unpredictable mild stress; restraint stress; corticosterone injection; neurotrophic factor
抑郁症是一种以心境低落、思维迟钝、语言行动减少等为主要特征的情感障碍性疾病[1]。据统计,抑郁症已成为给人类造成严重负担的第2位致病因素[2]。虽然目前关于抑郁症的研究十分广泛,然而,其确切的发病机制仍未有完全阐明。客观、规范、重复性好的动物模型是研究疾病发病机制的重要基础,目前,关于抑郁模型造模方法的相关报道较多,公认的造模方法包括慢性不可遇见性温和应激(chronic unpredictable mild stress, CUMS)、嗅球摘除、皮质酮注射、社会挫败模型、慢性束缚应激、基因敲除等[3-4]。本研究中,主要对比3种公认的抑郁模型,包括国内外广泛使用的CUMS模型、国际上广泛使用的慢性皮质酮注射模型以及操作简便、中医证候研究常用的慢性束缚应激模型,分析各模型大鼠行为学特点以及海马、前额叶皮质部位的脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、神经生长因子(nerve growth factor,NGF)表达情况,为抑郁模型研究提供实验依据。
1 材料与方法
1.1 实验动物
SPF级SD大鼠40只,雄性,体质量为200~220 g,购于湖南斯莱克景达实验动物有限公司,生产许可证号为SCXK(湘) 2016-0002,饲养于湖南中医药大学第一附属医院动物中心,使用许可证号为SYXK(湘)2015-0003。
1.2 主要试剂与仪器
皮质酮(索莱宝,北京);生理盐水、水合氯醛(中杉金桥,北京);兔抗鼠BDNF、NGF、GAPDH多克隆抗体(Abcam,英国);RIPA裂解液、羊抗兔IgG-HRP二抗(博士德,武汉)。Morris水迷宫(泰盟,成都);超微量蛋白核酸分析仪(BioDrop,英国);凝胶成像分析仪(Bio-Rad,美国);多功能酶标仪(Thermo,美国);万分之一天平(梅特勒-托利多,瑞士)。
1.3 分组与造模
大鼠适应性喂养5 d后,将40只SD大鼠随机分为5组,包括空白对照组、溶媒对照组、束缚应激组、CUMS组、皮质酮注射组,每组8只。空白对照组大鼠正常饲养,溶媒对照组大鼠每天皮下注射生理盐水(2 mL/kg)。除对照组外,各模型组大鼠均孤笼饲养,具体造模方法如下。
1.3.1 束缚应激组[5] 采用特制束缚器固定大鼠,每天束缚6 h,时间段为9:00-15:00,共21 d。 1.3.2 CUMS组[6] 应激方法包括禁食禁水、冰水浴、50 V电击、倾笼、噪音、昼夜颠倒、潮湿垫料、夹尾,每天随机采用1~2種,且同种应激不连续出现,持续21 d。
1.3.3 皮质酮注射组[7] 给予大鼠皮下注射皮质酮(40 mg/kg),持续21 d。
造模结束后,各组大鼠均进行行为学测试,评价抑郁样行为,测试完成后腹腔注射水合氯醛(10 mL/kg)麻醉大鼠,断头取脑,冰上剥离海马和前额叶皮质区用于组织蛋白检测。
1.4 行为学测试
1.4.1 Morris水迷宫实验 (1)定位航行实验:于应激造模第17天开始进行航行训练,将大鼠从平台正对象限处面向池壁放入水中,自由寻找平台,若在60 s内未找到,则将其牵引至平台并停留15 s,每天训练1次,持续4 d。训练完成后,开始正式实验,记录大鼠爬上平台的时间,记为大鼠的逃避潜伏期时间(escape latency),若60 s内未找到平台,则记为60 s。(2)空间探索实验:于造模第21天撤去平台,仍将大鼠从同一位置放入水中,记录大鼠60 s内穿越原平台所在象限的次数(crossing target)和进入原平台所在象限的潜伏时间(latency time)。
1.4.2 旷场测试 于测试前30 min将大鼠放入测试房间中适应,测试时,每只大鼠均从敞箱同一位置放入,分别记录大鼠4 min内的水平和垂直活动次数,并计算总和为大鼠的自主活动能力评分,整个测试过程保持绝对安静。
1.4.3 强迫游泳实验 将大鼠放入圆柱形强迫游泳测试仪中,水深距离仪器顶端约10 cm,水温保持在室温。实验时间共计5 min,其中前1 min为适应时间,让大鼠自由活动,适应结束后记录后4 min内大鼠的不动时间(immobility time),大鼠不动的标准为两前爪不动且身体呈漂浮状态。
1.5 Western-blotting法检测BDNF、NGF蛋白含量
取冷冻保存的海马及前额叶皮质组织,按1∶5比例加入RIPA裂解液,冰上匀浆,在4 ℃、12 000 r/min条件下离心15 min,取上清液制备组织蛋白提取液,BCA试剂盒法测定总蛋白含量。制备分离胶和浓缩胶,蛋白上样,SDS-PAGE凝胶电泳至溴酚蓝跑出分离胶后,将蛋白转移至PVDF膜上,5%脱脂奶粉室温下封闭1 h,根据目的蛋白分子量裁剪条带,分别加入稀释后的一抗(BDNF,1∶1 000;NGF,1∶1 000;GAPDH,1∶1 000),4 ℃孵育过夜。次日用TBST液洗涤条带4次,每次10 min,加入二抗(按1∶2 000稀释),室温下孵育4 h,TBST液洗4次,每次10 min,之后进行ECL显影。应用Image J软件分析条带灰度值,以GAPDH为内参,根据目的蛋白和内参蛋白对应灰度值的比值计算目的蛋白的相对表达量。
1.6 统计学分析
采用SPSS 19.0软件对实验数据进行分析统计,计量数据以“x±s”表示,组间比较采用单因素方差分析,两两比较方差齐者采用LSD法,方差不齐者用Dunnett's T3法。本研究涉及的与对照组比较中,束缚应激组和CUMS组均是与空白对照组比较,皮质酮组与溶媒对照组比较,以P<0.05表示差异有统计学意义,P<0.01表示差异有显著统计学意义。
2 结果
2.1 行为学测试
2.1.1 Morris水迷宫测试 与空白对照组比较,各抑郁模型组大鼠的逃避潜伏期时间均显著上升(P<0.01),穿越目标次数显著下降(P<0.05或P<0.01);同时,皮质酮组大鼠进入目标象限潜伏期时间显著上升(P<0.05),而其余两模型组差异无统计学意义,结果见表1。
2.1.2 旷场测试 与空白对照组比较,各模型组大鼠自主活动次数均显著下降(P<0.05或P<0.01),但是,CUMS组和皮质酮组大鼠活动次数下降的更为显著,同时与束缚组比较有显著差异(P<0.05),而CUMS组与皮质酮组之间比较差异无统计学意义。结果见表2。
2.1.3 强迫游泳实验 与对照组比较,各模型组大鼠不动时间均显著增加(P<0.01),与束缚组比较,皮质酮组不动时间显著增加(P<0.05),与CUMS组比较,则差异无统计学意义。结果见表2。
2.2 BDNF、NGF蛋白表达情况
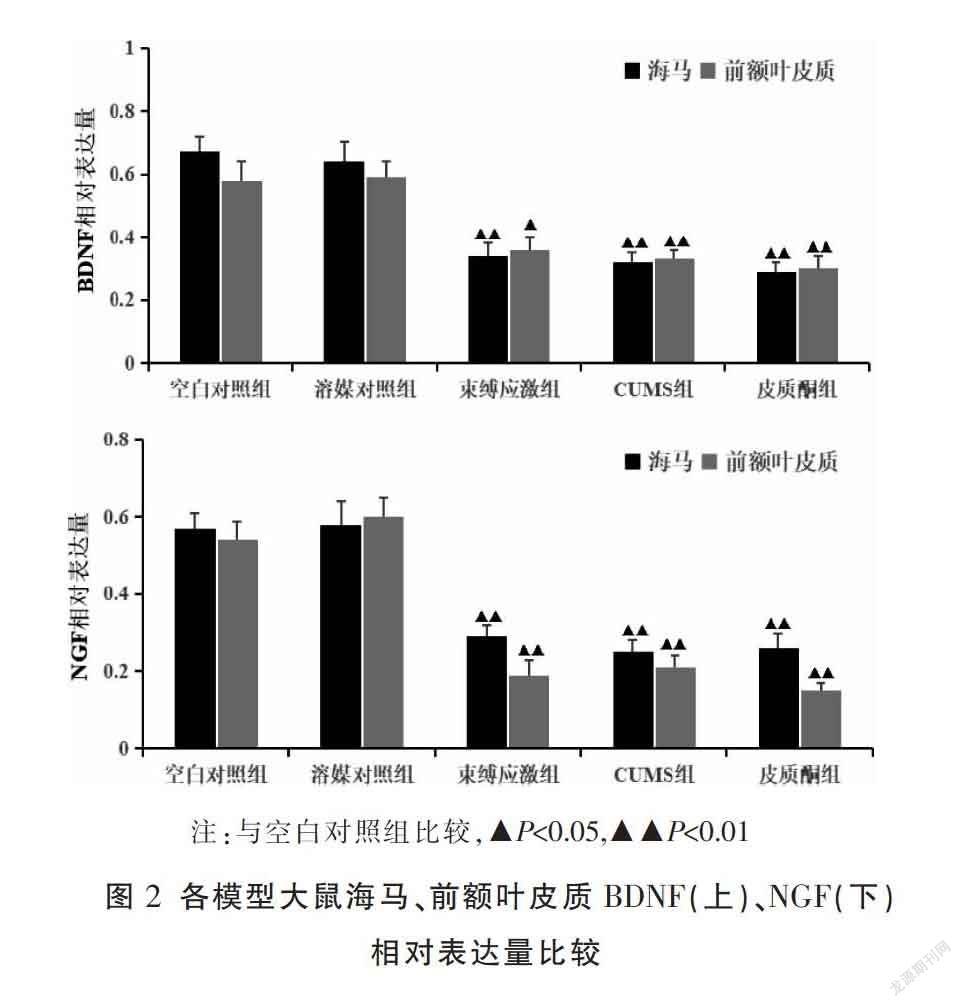
与空白对照组比较,各模型组大鼠海马、前额叶皮质区BDNF、NGF含量均显著降低(P<0.05或P<0.01),且各模型组之间比较差异均无统计学意义。结果见图1-2。
3 讨论
抑郁症是一种严重的神经精神疾病,患者表现出思维迟缓、学习记忆下降、活动不能、行为绝望等特征,严重者有自杀念头及行为,严重威胁人类身心健康。据报道,2016年抑郁症全球发病率为3.2%,且有逐年提升的趋势,预测到2020年,将成为仅次于心脏病的人类第二大疾患[8]。慢性应激是导致抑郁症发生的关键原因之一,同时也是基础研究用于建立抑郁动物模型的经典方法。本实验通过对比3类不同的抑郁动物模型应激方法,从动物行为学及脑内神经营养两方面,探讨各抑郁模型的特点,为抑郁动物模型的对比提供实验依据。
Morris水迷宫是一种空间辨别性学习记忆的经典检测方法,广泛用于神经科学领域的基础研究[9]。本研究通过Morris水迷宫测试模拟抑郁患者的思维迟缓、学习记忆下降等特点,结果表明,3种抑郁模型方法均能导致大鼠逃避潜伏期时间延长,说明均能使大鼠产生学习能力障碍,然而,只有慢性皮质酮注射组大鼠进入目标象限时间显著增加,说明3种模型中,只有皮质酮注射会导致大鼠产生明显的记忆功能障碍。
旷场实验又称为敞箱实验,是评价动物在新环境中发挥探索本能的一种行为學测试方法,主要用于评价动物的焦虑或抑郁样情绪[10]。强迫游泳实验是使动物处于绝望环境下,反映动物即时的表征变化,是筛选抗抑郁药物的经典实验方法[11]。本研究通过旷场实验和强迫游泳实验模拟抑郁患者的运动不能及行为绝望等特点,结果表明,3种模型大鼠活动次数均降低,不动时间均增加,显示明显的抑郁样行为,同时,对比慢性束缚大鼠,CUMS组和皮质酮注射组大鼠抑郁样行为更为显著,上述结果表明CUMS组和皮质酮组大鼠较束缚应激组具备更典型的抑郁特征。
海马和前额叶皮质是大脑边缘系统的重要组成部分,海马主要调控机体的学习与记忆,而前额叶皮质则主要负责感觉认知[12]。虽然海马和前额叶皮质区在大脑不同的部位且掌管的功能各有不同,然海马与前额叶皮质之间有着错综复杂的直接生理结构联系,可相互影响共同调节情绪行为、学习记忆等心理活动,与抑郁症的产生紧密相关[13]。因此,本研究以海马和前额叶皮质为关键靶区,对比各抑郁模型大鼠脑内神经营养的表达水平,分析各模型的特点。
神经营养假说是近年来抑郁症发病机制研究的一大热点,该假说认为神经营养因子的减少是诱发抑郁症发生发展的重要因素。神经营养因子家族是一类由神经所支配的组织和星形胶质细胞产生的且为神经元生长与存活所必需的蛋白质分子,具有保护神经元、促进轴突再生等多重作用[14]。BDNF、NGF是神经营养因子家族的代表性成员,在调节神经元生长分化,降低神经元凋亡等方面有重要作用[15]。研究发现,BDNF和NGF的表达降低可引起海马、皮质中的神经元形态、功能损伤而参与抑郁症的发病[16]。本研究发现,各抑郁模型大鼠海马和前额叶皮质的BDNF、NGF表达均明显下调,但各模型组之间比较无明显差异,提示此3种抑郁模型大鼠均存在明显的神经营养缺失情况,在该发病机制下均无显著差异。
综上所述,本研究通过对比慢性束缚应激、CUMS、慢性皮质酮注射3种常用的抑郁模型,行为学分析发现慢性皮质酮注射大鼠抑郁特征最为显著,同时,各模型大鼠海马和前额叶皮质部位的BDNF、NGF含量均有明显的改变,但相互间比较并无统计学意义,说明脑内神经营养缺失现象存在,也说明3种抑郁模型均符合抑郁症发病特点,能为抑郁症发病机制研究及治疗药物筛选提供稳定的模型基础。
参考文献
[1] 吴志国,吴 彦,方贻儒.从“焦虑性抑郁症”概念解析抑郁障碍的复杂性[J].上海交通大学学报(医学版),2014,34(4):450-454.
[2] IONESCU D F, NICIU M J, MATHEWS D C, et al. Neurobiology of anxious depression: a review[J]. Depress Anxiety, 2013, 30(4):374-385.
[3] ROSA S G, QUINES C B, STANGHERLIN E C, et al. Diphenyl
diselenide ameliorates monosodium glutamate induced anxiety-like behavior in rats by modulating hippocampal BDNF-Akt pathway and uptake of GABA and serotonin neurotransmitters[J]. Physiology and Behavior, 2016,155:1-8.
[4] WANG Q S, TIAN J S, CUI Y L, et al. Genipin is active via modulating monoaminergic transmission and levels of brain-derived neurotrophic factor (BDNF) in rat model of depression[J]. Neuroscience, 2014, 275(5):365-373.
[5] 趙宏波,白晓晖,李晓娟.逍遥散治疗慢性束缚应激焦虑模型大鼠行为学评价[J].中华中医药杂志,2014,29(5):1669-1673.
[6] 孟 盼,朱 青,赵洪庆,等.甘麦大枣汤对慢性应激抑郁大鼠HPA轴及海马显微结构的影响[J].湖南中医药大学学报,2017,37(6): 581-585.
[7] 赵洪庆.焦虑性抑郁动物模型及其多层次评价体系的建立[D].长沙:湖南中医药大学,2017.
[8] PODOLECKI T, PUDLO R, MAZUREK M, et al. The incidence, clinical significance, and treatment effects of depression in cardiac resynchronization therapy recipients[J]. Cardiology, 2017, 183(2):115-121.
[9] TEJEDA H A, O'DONNELL P. Amygdala inputs to the prefrontal cortex elicit heterosynaptic suppression of hippocampal inputs[J]. Journal of Neuroscience, 2014,34(43):14365-14374.
[10] PAUL R, ALBERT, LAURA M, et al. Transcriptional Dys-regulation in Anxiety and Major Depression: 5-HT1A Gene Promoter Architecture as a Therapeutic Opportunity[J]. Current Pharmaceutical Design, 2014,20(23): 3738-3750.
[11] MANDYAM C D. The Interplay between the Hippocampus and Amygdala in Regulating Aberrant Hippocampal Neurogenesis during Protracted Abstinence from Alcohol Dependence[J]. Front Psychiatry, 2013,27(4):61-69.
[12] XU J Y, XU H, LIU Y, et al. Vanillin-induced amelioration of depression-like behaviors in rats by modulating monoamine neurotransmitters in the brain[J]. Psychiatry Research, 2015,225(3):509-514.
[13] 赵洪庆,韩远山,柳 卓,等.焦虑性抑郁模型大鼠脑区单胺递质含量与神经因子表达的变化[J].中国实验动物学报,2017,25(4): 373-379.
[14] SINISCALCO D, GIORDANO C, ROSSI F, et al. Role of Neurotrophins in Neuropathic Pain[J]. Current Neuropharmacology, 2011, 9(4): 523-529.
[15] 王建平,刘 聪,杨直堂,等.白藜芦醇对脑缺血小鼠BDNF及NT-3表达的影响[J].中国药理学通报,2012,28(4):531-535.
[16] JIANG P, DANG R L, LI H D, et al. The Impacts of Swimming Exercise on Hippocampal Expression of Neurotrophic Factors in Rats Exposed to Chronic Unpredictable Mild Stress[J]. Evidence-based Complementary and Alternative Medicine, 2014, 2014: 729827.
