夏枯草PvDXS基因的克隆和表达分析
2019-09-10李璐董诚明张梦佳朱畇昊
李璐 董诚明 张梦佳 朱畇昊

摘要: 该研究在夏枯草转录组测序的基础上设计特异引物,采用逆转录PCR技术获得该基因的全长核苷酸序列,并进行生物信息学分析,采用qRT-PCR法分析PvDXS在夏枯草不同组织及不同外源性物质诱导下的表达量。结果表明:克隆得到的PvDXS基因开放阅读框2 181 bp,编码726个氨基酸,理论分子量为78 040.47 D,等电点为6.75,PvDXS蛋白具有Transketolase_C结构域和Transket_pyr结构域,系统进化树结果表明,PvDXS蛋白与丹参、长春花的DXS(SmDXS2、CrDXS2)亲缘关系较近,推测PvDXS屬于第Ⅱ类DXS蛋白。qRT-PCR分析表明,PvDXS基因在叶中表达量高于果穗及茎。对果穗施加7种外源性物质处理24 h后,GA3处理组该基因表达量升高,其他6种外源性物质处理后表达量均降低,其中CaCl2、SNP、SA处理后该基因的表达量显著降低。PvDXS基因在不同组织中表达量差异较大,且受外源物质诱导表达。这为进一步研究PvDXS基因对夏枯草萜类成分合成途径中的功能及表达调控奠定基础。
关键词: 夏枯草, PvDXS基因, 基因克隆, 表达分析
中图分类号: Q943.2文献标识码: A文章编号: 1000-3142(2019)12-1619-09
作者简介: 李璐(1993-),女,硕士研究生,研究方向为中药资源的开发利用,(E-mail)15039087195@163. com。
Abstract: Specific primers were designed on the basis of transcriptome sequencing of Prunella vulgaris. The full-length nucleotide sequence of PvDXS was obtained by reverse transcription PCR and the bioinformatics analysis of the gene was conducted. The expression levels of PvDXS in different tissues and exogenous substances were detected by real-time quantitative PCR. The results showed the cDNA sequence of PvDXS contained the open reading frame which had 2 181 bp and encoded a predicted protein of 726 amino acids with a theoretical molecular weight of 78 040.47 D and a isoelectric point of 6.75. The protein had Transketolase_C domain and Transket_pyr domain. Phylogenetic tree results showed that PvDXS protein was closely related to DXS (SmDXS2, CrDXS2) from Salvia miltiorrhiza and Catharanthus roseus, and it was inferred that PvDXS belonged to the Class Ⅱ DXS protein type. Tissue expression pattern analysis revealed that PvDXS gene in leaves was higher than that in ears and stems. After treated with seven exogenous substances for 24 h, the expression of the gene increased in GA3 treatment group and decreased after treatment with the others. The expression level of the gene decreased significantly after CaCl2, SNP and SA treatments. The expressions of PvDXS were variant in different tissues and varied greatly after treatment of exogenous substances, which laid a foundation for further study on the function and expression regulation of PvDXS in the synthesis pathway of terpenoid components of Prunella vulgaris.
Key words: Prunella vulgaris, 1-deoxy-D-xylulose 5-phosphate synthase gene, gene clone, expression analysis
DXS是一种转酮酶可催化非甲羟戊酸途径(DXP途径),在硫胺素焦磷酸(thiamin pyrophosphate, TPP)作用下,该酶使丙酮酸脱羧后,与磷酸甘油醛缩合形成DXP(王凌健等,2013)。Rodriguez-Concepcion & Boronat(2015)的研究结果表明,DXS 定位于植物质体的类囊体。该酶具有3个功能结构域:TPP 结合结构域、转酮醇酶结构域和嘧啶结合结构域,且在其N端有一段质体转运肽(Jadaun et al., 2017)。Querol et al.(2001)报道了在酸性介质中采用高效液相色谱法测定DXS酶活性。作为萜类化合物合成的重要限速酶,克隆得到DXS基因,对于研究萜类化合物生物合成途径具有重要意义。目前,其他植物中DXS 基因表达、调控和遗传转化等方面已有部分研究(张浩宇等,2018;陈迪等,2018),而关于夏枯草DXS基因的研究报道比较少。
夏枯草(Prunella vulgaris)为唇形科草本植物,以其干燥果穗入药,具有清肝明目、消肿散结等功效,其中萜类化合物是其重要的活性成分。Sun et al.(2014)发现熊胆草中DXS的组织表达模式与二萜物质苦蒿素的组织积累模式呈正相关,暗示过表达DXS基因可能会增加熊胆草中二萜物质苦蒿素的合成。Gong et al.(2006)研究发现银杏DXS基因受到MeJA和ASA等外源物质调控。因此基于前期获得的夏枯草转录数据库基础上,本研究采用RT-PCR技术从夏枯草中克隆得到DXS基因,并对其进行生物信息学、组织表达模式及诱导表达分析,以期为进一步揭示该基因在夏枯草萜类代谢机制中的作用奠定基础。
1材料与方法
1.1 材料和试剂
材料:夏枯草样品采自河南省确山县夏枯草GAP种植基地,河南中医药大学董诚明教授鉴定为夏枯草(Prunella vulgaris, PVL)。试剂:总RNA提取试剂盒(北京康为世纪生物科技有限公司),反转录试剂盒(Thermo公司),荧光定量试劑盒(QIAGEN),DNAMarker(TaKaRa公司),PCR产物回收试剂盒(上海生工),PCR仪(美国 Bio-Rad 公司C1000 Touch Thermal Cycler),荧光定量PCR仪(美国 Applied Biosystems公司 Step One Plus)。
1.2 总RNA 提取与cDNA第一条链的合成
利用康为世纪植物RNA 提取试剂盒提取夏枯草不同组织的总RNA,1%琼脂糖凝胶电泳确定RNA完整性。cDNA 的合成步骤按照Thermo Scientific RevertAid First Strand cDNA Synthesis Kit进行操作,置于-20 ℃备用。
1.3 cDNA 全长克隆
从转录组数据库中得到的夏枯草DXS基因序列两端非编码区设计一对特异性引物(DXR-F,DXR-R)(表1),以夏枯草叶片cDNA 为模板,进行扩增:cDNA 2.0 μL,2 × Es Taq mix 10.0 μL,10.0 μmol·L-1正反向引物各1.0 μL,加dd H2O 6.0 μL至体积为20.0 μL。反应程序:95 ℃预变性1 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1.5 min,35个循环;72 ℃延伸5 min。1%琼脂糖凝胶电泳检测PCR产物,将扩增的目的条带切胶回收纯化,并连接到pMD19-T载体上,蓝白斑筛选,菌落经PCR检测后的阳性克隆送往三博远志生物技术有限公司测序进行测序。组成型表达的actin基因(KJ010818)作为内参。
1.4 生物信息学分析
运用在线工具对PvDXS 基因及编码蛋白进行生物信息学分析。利用ORF finder (http://www.
bioinformatics.org/sms2/orf_find.html) 在线软件分析开放阅读框;运用DNAMAN软件翻译目的基因氨基酸序列,比对同源蛋白的序列;利用ExPASy Proteomics Server Protparam (http://www.expasy. ch/ tools/ protparam.html) 分析目的蛋白的理化性质;利用SinalP4.1 Server (http://www.cbs.dtu.dk/services/SignalP/) 预测信号肽;利用SMART (http://smart.emb-heidelberg.de/) 分析目的蛋白功能域;利用NPSA server (http://npsa-pbil.ibcp.fr/cgi-bin/secpred_sop ma.pl) 预测蛋白质二级结构;利用Swiss-Model (http://swissmodel.expasy.org/interactive) 预测蛋白质三级结构;利用BaCeIlo (http://gpcr.biocomp.unibo.it/bacello/) 和ChloroP (http://www.cbs.dtu.dk/services/ChloroP/) 预测细胞定位和叶绿体转运肽切割位点;运用MEGA5.1软件对目的基因及同源基因的氨基酸序列构建进化树分析。
1.5 夏枯草DXS基因的特异性表达分析
夏枯草生长旺盛期,对生长状态一致的夏枯草果穗进行处理,分别喷洒50 μmol·L-1 茉莉酸甲酯(MeJA)、17.14 μmol·L-1吲哚乙酸(IAA)、100 μmol·L-1乙烯利(ETH)、100 μmol·L-1硝普钠(SNP)、1 mmol·L-1无水氯化钙(CaCl2)、10 μmol·L-1水杨酸(SA)、2.88 μmol·L-1赤霉素(GA3)。以喷洒前(0 h)的果穗为对照,24 h后采集处理组样品。
对夏枯草果穗、茎、叶及喷施7种外源物质的果穗中PvDXS基因相对表达量进行实时荧光定量PCR (quantitative real-time PCR,qPCR) 检测,qPCR 检测的反应体系:2× SYBR Green PCR Master Mix 10.0 μL,QN Rox Reference Dye 0.1 μL,正反向引物均为0.4 μL,模板cDNA 2.0 μL,加RNase-Free Water 7.1 μL至终体积为20.0 μL。反应程序:95 ℃预变性20 s后,进行40个循环(95 ℃,1 s;56 ℃,20 s;95 ℃,1 s),60 ℃,20 s,95 ℃,1 s。actin基因(KJ010818)作为内参,设计序列引物(表1)。扩增完成后进行溶解曲线测定,2-ΔΔCt法分析PvDXS相对表达量。
2结果与分析
2.1 PvDXS基因克隆
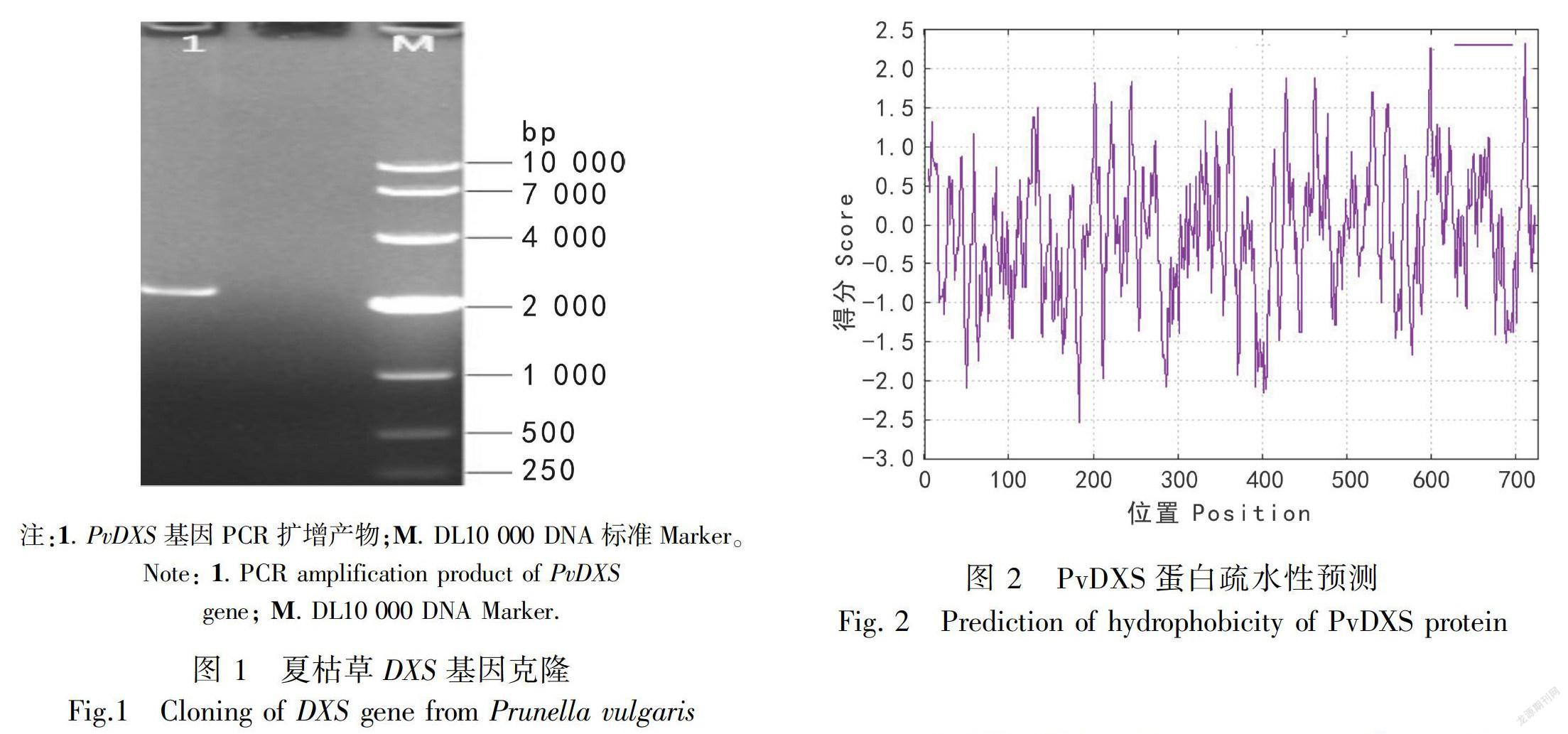
据夏枯草转录组测序数据设计引物,夏枯草RNA 逆转录得到的cDNA 为模板,PCR扩增得到1条2 000 bp 左右的片段。ORF Finder软件分析克隆测序拼接所得序列的开放阅读框,结果所得序列含有1个大小为2 181 bp的完整开放阅读框,命名为PvDXS(图1)。
2.2 PvDXS基因编码蛋白的生物信息学分析
2.2.1理化性质ExPASy Proteomics ServerProtparam在线软件分析编码蛋白的理化性质。推测该蛋白编码726个氨基酸,理论分子量为78 040.47 D,等电点(pI)为6.75。总原子数为11 002,原子组成:C3457H5521N959O1035S30。总负电荷残基数(Asp + Glu)有77个,总正电荷残基数(Arg + Lys)有73个,推测为酸性蛋白质。该蛋白中丙氨酸(Ala)含量最多(占氨基酸总数9.5%),其次是甘氨酸(Gly)(占氨基酸总数9.2%),半胱氨酸(Cys)的含量最少,為1.2%。通过对PvDXS蛋白进行疏水性预测,结果显示:PvDXS蛋白疏水性表明多肽链第183位具有最低分值-2.522,第710位具有最高分值2.332,疏水氨基酸的数量小于亲水氨基酸的数量,推测其为亲水性蛋白(图2)。
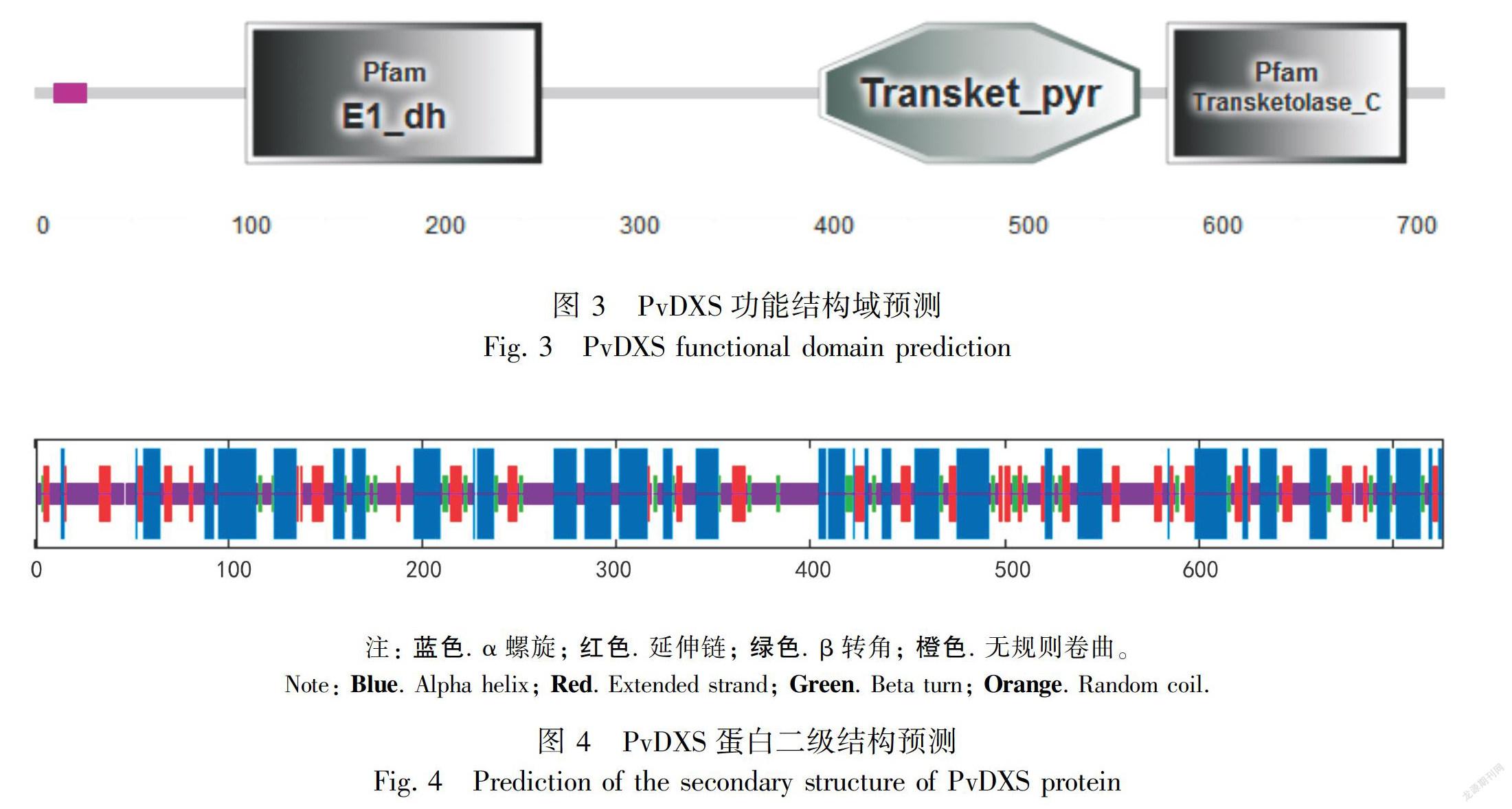
2.2.2 亚细胞定位和功能域通过亚细胞定位预测软件分析发现PvDXS定位在叶绿体中。SMART在线软件对PvDXS蛋白进行功能域预测,图3结果显示PvDXS蛋白具有 Transketolase_C结构域和Transket_pyr结构域,分别位于第583位到第706位、第404位到第569位,该蛋白功能域预测其含有与IPP结合的保守结构域(DXP_synthase_N),这一结构与转酮酶及丙酮酸脱氢酶的E1亚基(E1_dh家族)结构相似(Newman & Chappell,1999),分别位于第82位到第367位、第109位到第261位。
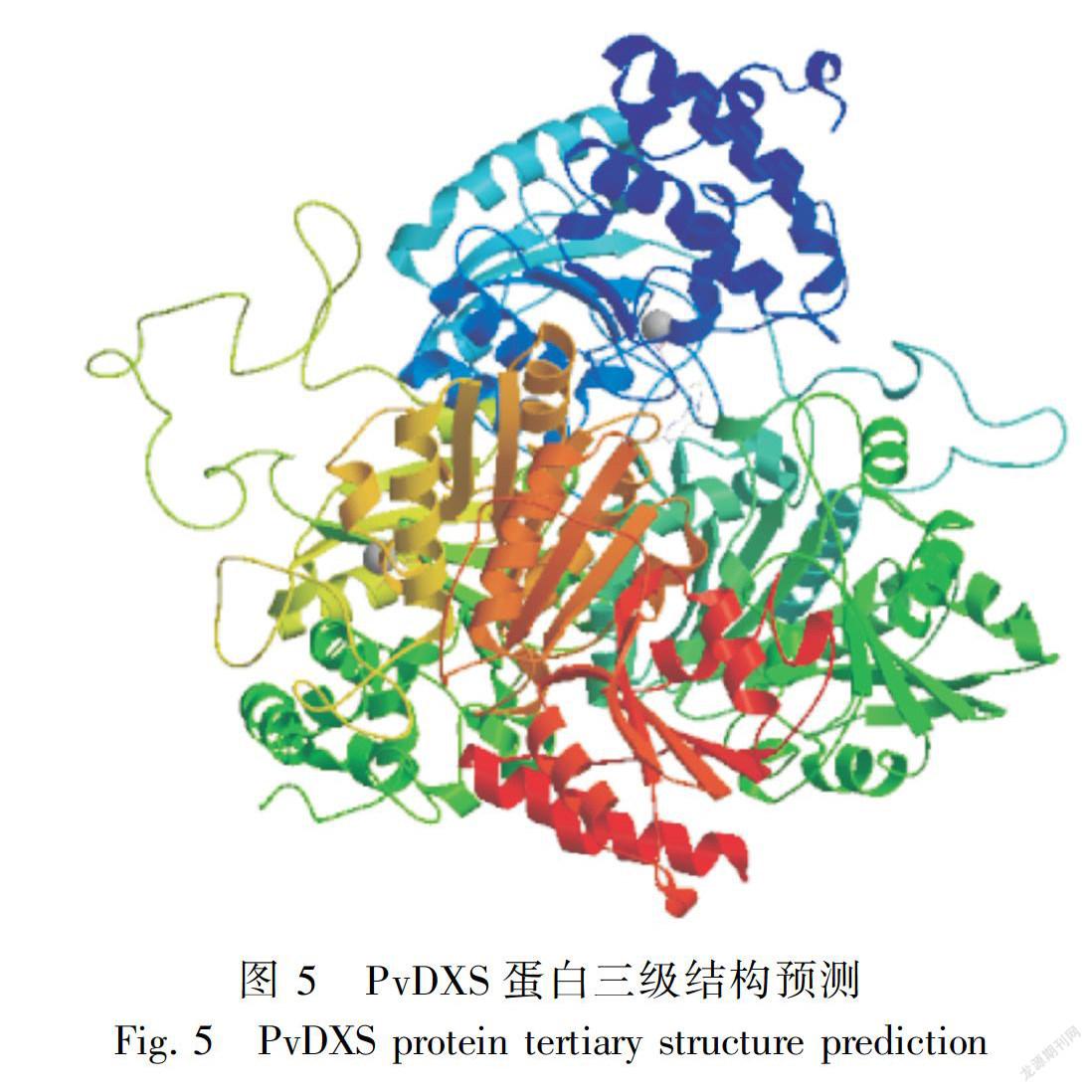
2.2.3 PvDXS蛋白的二级、三级结构预测利用NPSA server在线软件对PvDXS编码的蛋白进行二级结构分析,图4结果表明,该蛋白预测由36.91%的α-螺旋、19.7%的延伸链、10.33%的β-转角和33.06%的不规则卷曲组成混合型蛋白。Swiss-Model在线软件预测蛋白三级结构(图5)结果显示,PvDXS与大肠杆菌DXS蛋白(2o1s.1.A)相似度达到49.11%。
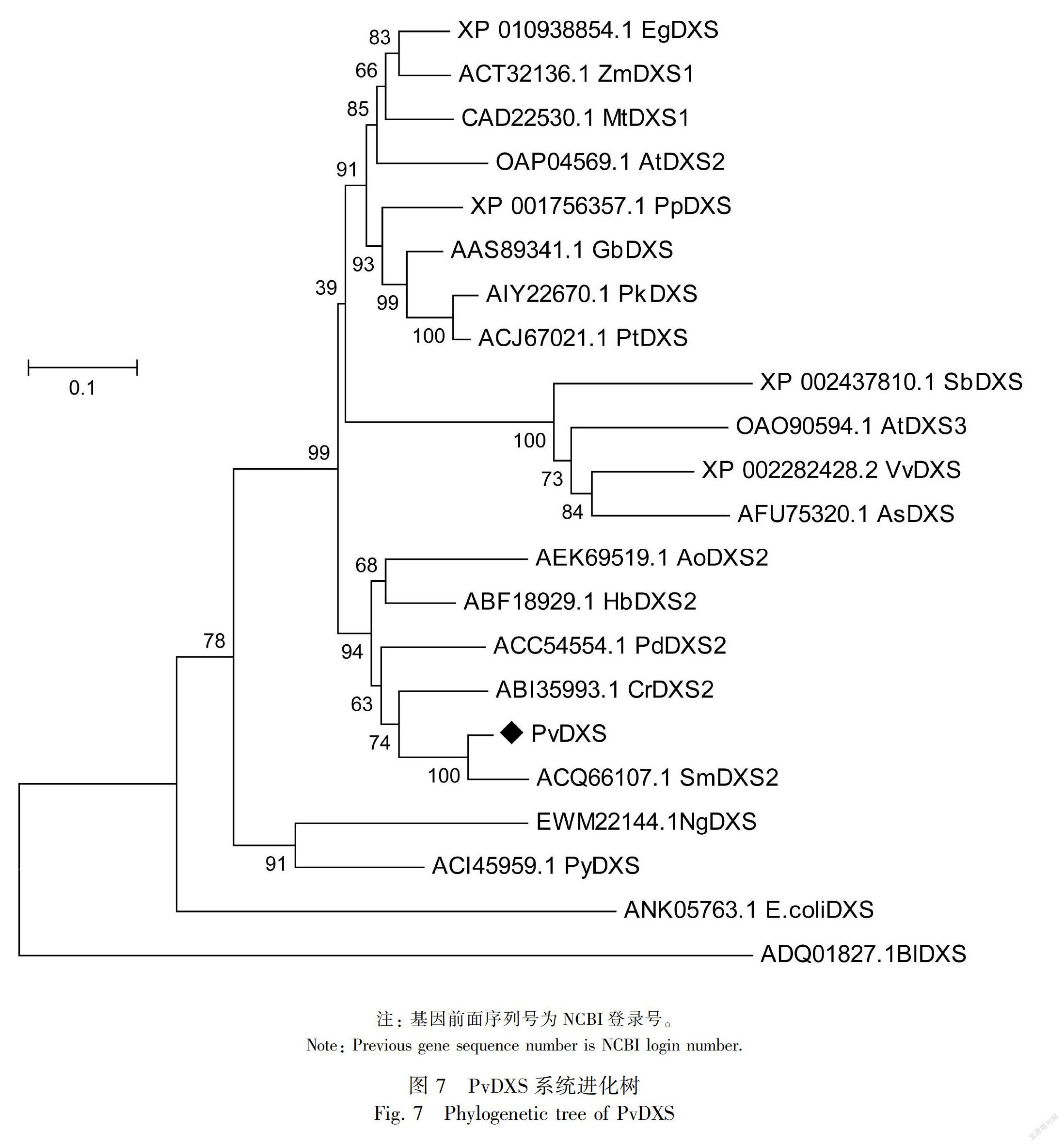
2.2.4 系统进化树构建和多序列比对通过BLAST序列比对,从NCBI数据库中下载拟南芥(Arabidopsis thaliala,AtDXS)、丹参(Salvia miltiorrhiza,SmDXS)、长春花(Catharanthus roseus,CrDXS)、橡胶树(Hevea brasiliensis,HbDXS)、苜蓿(Medicago truncatula,MtDXS)、玉米(Zea mays,ZmDXS)、土沉香(Aquilaria sinensis ,AsDXS)、葡萄(Vitis vinifera,VvDXS)、高粱(Sorghum bicolo,SbDXS)、高良姜(Alpinia officinarum,AoDXS)、银杏(Ginkgo biloba,GbDXS)、小立碗藓(Physcomitrella patens,PpDXS)、野生条斑紫菜(Pyropia yezoensis,PvDXS)、油棕(Elaeis guineensis,EgDXS)、赤松(Pinus densiflora,PdDXS)、火炬松(Pinus taeda,PtDXS)、思茅松(Pinus kesiya var. langbianensis,PkDXS)、双歧杆菌(Bifidobacterium longum subsp. longum BBMN68,BlDXS)和大肠杆菌(Escherichia coli,图 3PvDXS功能结构域预测coliDXS)的DXS蛋白序列,与PvDXS蛋白的氨基酸序列通过MEGA5.1软件采用邻近法(N-J法)构建系统进化树,并选取部分植物的氨基酸序列利用DNAMAN软件进行多序列比对分析。
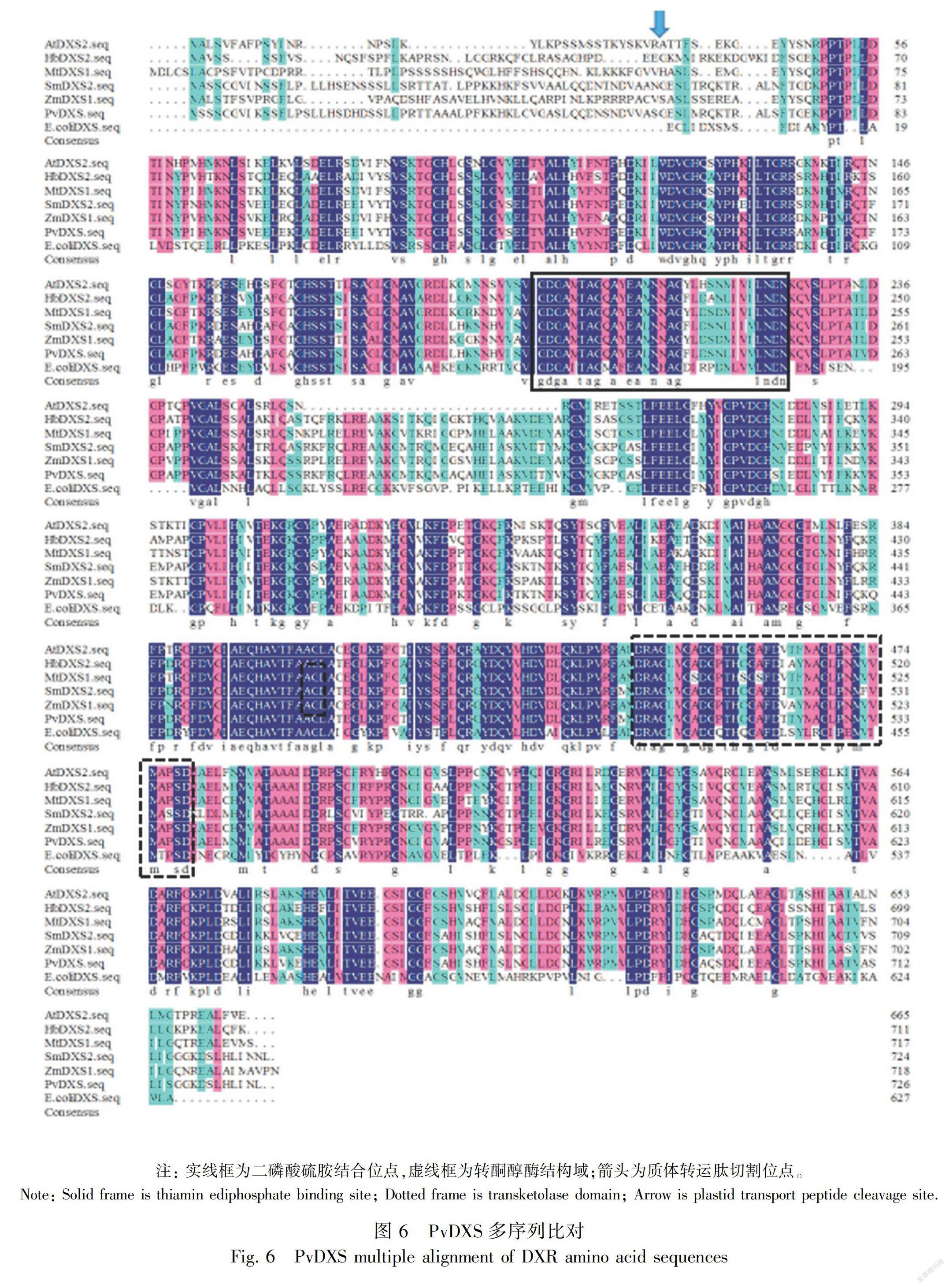
多序列比对显示PvDXS蛋白与HbDXS蛋白具有较高的相似性,序列一致性达73.76%,PvDXS蛋白包含1个硫胺素焦磷酸结合位点:GDG (X)8E(X) 4A(X)11NDN和1个转酮醇酶结构域:DRAGX28PXD;该蛋白存在于叶绿体中,N端存在1段由56个氨基酸残基构成的质体转运肽(图6)。系统进化树结果(图7)表明,PvDXS蛋白与丹参、长春花DXS(SmDXS2、CrDXS2)亲缘关系较近,推测属于第II类DXS蛋白类型,此类型的DXS蛋白参与次级代谢产物萜类物质的生物合成(Miziorko,2011)。PvDXS与SmDXS相似性非常高,说明同一科植物基因在进化关系上具有高度保守性。
2.3 组织特异性及外源性物质诱导后表达
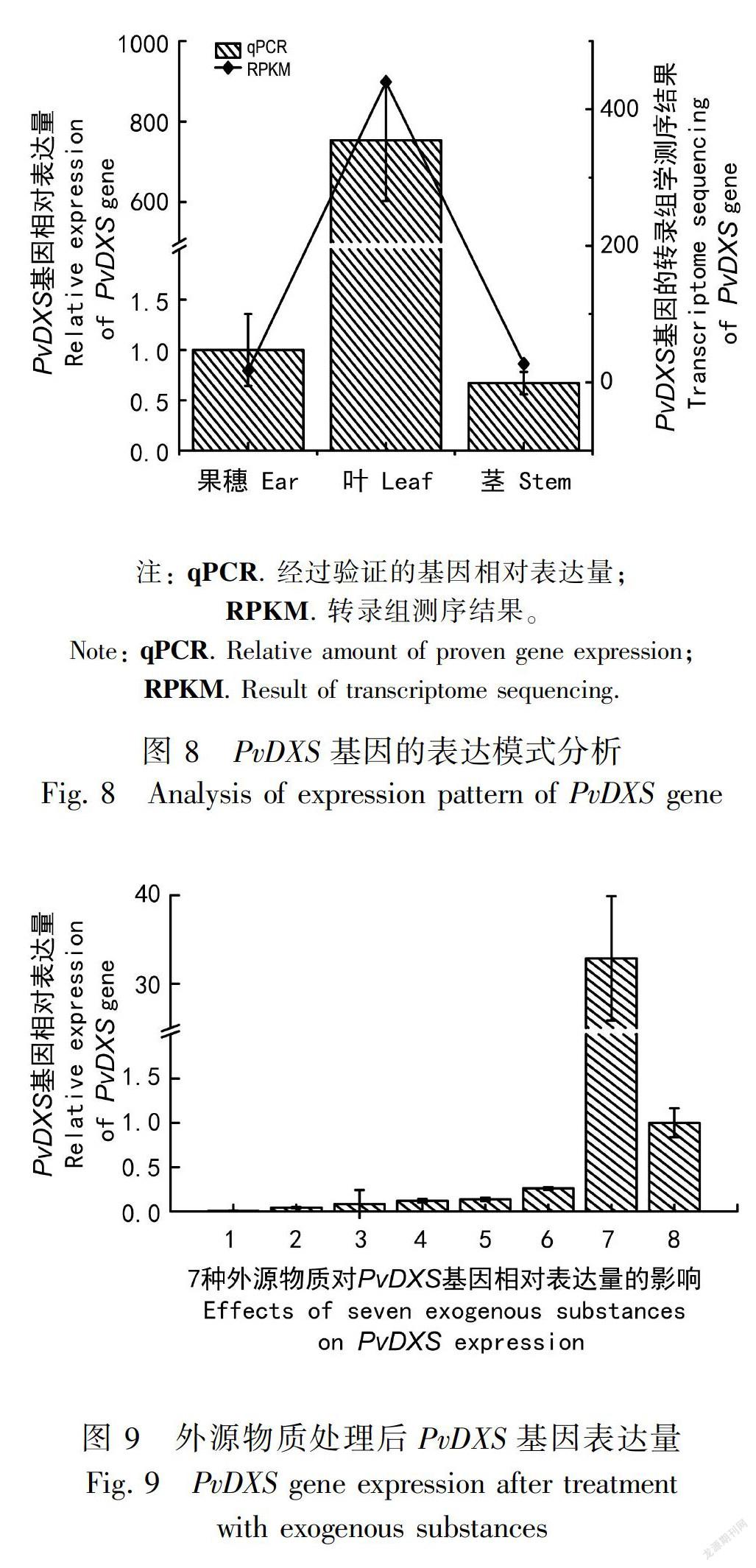
利用qRT-PCR方法检测PvDXS基因在夏枯草果穗、叶和茎中的表达量,以果穗为对照样品。图8结果显示PvDXS基因在3个样本中的表达量范围为0.671~753.296。PvDXS基因在叶中高表达,其次是果穗,茎中的表达量最低。PvDXS基因在叶中的相对表达量是在果穗中的753.2倍,与课题组前期夏枯草转录组测序结果一致。
7种外源性物质处理后分析夏枯草果穗中PvDXS基因的表达趋势。图9结果表明,GA3处理后PvDXS的表达量显著增高,为对照组的32.8倍。其他6种外源性物质处理后PvDXS表达量范围为0.005~0.260,其中CaCl2、SNP及SA处理后对该基注: 实线框为二磷酸硫胺结合位点,虚线框为转酮醇酶结构域;箭头为质体转运肽切割位点。
3讨论
萜类化合物是一种广泛存在于植物中的次生代谢产物,包括甾体类、醌类、胡萝卜素类和植物激素等,其参与多种植物生理代谢活动如光合和呼吸作用(Xiang et al., 2007)。DXS 在萜类化合物合成2-C-甲基-D-赤藻糖醇-4-磷(2-C-methyl-D-erythritol 4-phosphate,MEP) 途径中发挥关键作用,催化丙酮酸和3-磷酸-甘油醛发生缩合反应形成途径中的重要中间体DXP (Krushkal et al., 2003)。Zhou et al. (2016)发现丹参毛状根中过表达丹参Sm DXS1 和 Sm DXS2,丹参酮的含量显著提高;穿心莲细胞5 μmol·L-1 MeJA的悬浮体系培养24 h后产生的穿心莲内酯含量增加5.25倍,与DXS基因的表达水平成正相关(Sharma et al., 2015)。拟南芥过量表达马铃薯St DXS1基因后植株叶片中叶綠素和胡萝卜素明显增加(Henriquez et al., 2016)。这表明DXS是萜类化合物代谢途径的重要调节酶且利用其表达可改变萜类化合物的含量。
DXS基因的表达具有组织特异性,通常DXS基因在叶、茎的绿色细胞中表达较强,其他的组织器官表达较弱(Sawitri & Wallie, 2005)。本研究利用qPCR技术对夏枯草叶、茎、果穗组织器官中PvDXS的表达特征进行分析,结果表明PvDXS基因在不同组织中均有表达, 但表达量差异较大。PvDXS基因在叶中的表达水平最高,为果穗中表达量的753.2倍。
根据序列进化关系可将DXS基因分为DXS I、DXS Ⅱ和DXSⅢ三类(张浩宇等,2018),系统进化树分析显示PvDXS蛋白与丹参、长春花中的的第Ⅱ类DXS蛋白(SmDXS2、CrDXS2)亲缘关系较近,据此推测PvDXS属于第Ⅱ类DXS蛋白。DXSⅡ蛋白可编码植物特定的次生代谢产物,说明PvDXS与夏枯草活性成分(如萜类化合物)含量有关。DXS基因的表达量与其次生代谢产物含量成正相关,如Munoz-Bertomeu et al.(2016)报道在薰衣草中过量表达拟南芥DXS基因显著增加转基因植株叶片和花中精油的含量。GA3处理后PvDXS的表达量显著增高,为对照组的32.8倍。其他6种外源性物质处理后PvDXS对该基因的表达具明显的抑制作用。Gong et al.(2006)发现施加MeJA和ASA 等外源物质后,银杏内酯的合成与GbDXS表达呈正相关。研究发现对葡萄喷施GA3后其糖分及萜类化合物显著增加(Murcia et al., 2016;程大伟等,2018),推测GA3可提高夏枯草中的次生代谢产物,如萜类化合物。此外,孙君等(2014)发现双瓣茉莉JsDXS的表达量受生物钟的调控,具有昼夜节律性。其他6种外源物质对PvDXS表现出一定抑制作用可能与此有关。本研究丰富了MEP途径中DXS基因的种类,为后期的基因功能研究奠定了基础。
参考文献:
CHEN D, WANG PJ, ZHENG YC, et al.,2018. Cloning and expression analysis of phosphomevalonate kinase gene from Jasminum sambac(L.)Ait \[J\]. J S Agric, 49(10):1909-1916. \[ 陈笛, 王鹏杰, 郑玉成, 等, 2018. 茉莉花磷酸甲羟戊酸激酶基因克隆及表达分析\[J\]. 南方农业学报, 49(10):1909-1916. \]
CHENG DW, CHEN JY, GU H, et al.,2018. Effects of GA3 and TDZ combination on bitter and astringent taste compounds of Vitis vinifera × V. labrusca\[J\]. J S Agric, 49(5):922-929.\[ 程大伟, 陈锦永, 顾红, 等, 2018. GA3与TDZ组合对巨玫瑰葡萄果实理化指标和苦涩味物质含量的影响南方农业学报, 49(5):922-929. \]
GONG YF, LIAO ZH, GUO BH, et al., 2006. Molecular cloning and expression profile analysis of Ginkgo biloba DXS gene encoding 1-deoxy-D-xylulose 5-phosphate synthase the first committed enzyme of the 2-C-methyl-D-erythritol 4-phosphate pathway [J]. Planta Med, 72: 329-335.
HENRIQUEZ MA, SOLIMAN A, LI G, et al., 2016. Molecular cloning, functional characterizationand expression of potato (Solanum tuberosum) 1-deoxy-D-xylulose 5-phosphate synthase 1 (StDXS1) in response to Phytophthora infestans [J]. Plant Sci, 243:71-83.
JADAUM JS, SANGWAN NS, NAMOLIYA LK, et al., 2017. Over-expression of DXS gene enhances terpenoidal secondary metabolite accumulation in rose-scented geranium and withania somnifera: Active involvement of plastid isoprenogenic pathway in their biosynthesis [J]. Physiol Plant, 159(4):381-400.
KRUSHKAL J, PISTILLI M, FERRELL KM, et al., 2003. Computational analysis of the evolution of the structure and function of 1-deoxy-D-xylulose-5-phosphate synthase, a key regulator of the mevalonate-independent pathway in plants [J]. Gene, 313(12): 127-138.
MIZIORKO HM, 2011. Enzymes of the mevalonate pathway of isoprenoid biosythesis [J]. Arch Biochem Biophys, 505(2):131-143.
MUNOZ-BERTOMEU J, ARRILLAGA I, ROS R, et al., 2006. Up-regulation of 1-deoxy-D-xylulose-5-phosphate synthase enhances production of essential oils in transgenic spike lavender [J]. Plant Physiol, 142: 890-900
MURCIA G, FONTANA A, PONTIN M, et al., 2016. ABA and GA3 regulate the synthesis of primary and secondary metabolites related to alleviation from biotic and abiotic stresses in grapevine [J]. Phytochem, 135:34-52.
NEWMAN JD, CHAPPELL J, 1999. Isopernoid biosythesis in Plant: Carbon partitioning within the cytoplasmic pathway [J]. Crit Rev Biochem Mol Biol, 34(2): 95-106.
QUEROL J, BESUMBES O, LOIS LM, et al., 2001. A fluorometric assay for the determination of 1-deoxy-D-xylulose-5-phosphate synthase activity [J]. Anal Biochem, 296(1):101-105.
RODRIGUEZ-CONCEPCION M, BORONAT A, 2015. Breaking new ground in the regulation of the early steps of plant isoprenoid biosynthesis [J]. Curr Opin Plant Biol, 25:17-22.
SAWITRI K, WALLIE S, 2005. Molecular cloning and expression of a cDNA encoding 1-deoxy-D-xylulose-5-phosphate synthase from oil palm Elaeis guineensis Jacq [J]. Plant Sci, 169: 571-578.
SHARMA SN, JHZ Z, SINHA RK, et al., 2015. Jasmonate-induced biosynthesis of andrographolide in Andrographis paniculata [J]. Physiol Plant, 153: 221-229.
SUN J, CHEN GX, YE NX, et al., 2014. Cloning and expression analysis of deoxyoxylulose-5-phosphate synthase gene related to aroma from Jasminum sambac and isolation of its promoter [J]. Acta Hortic Sin, 41(6): 1236-1244. [孫君, 陈桂信, 叶乃兴, 等, 2014. 茉莉花香气相关基因及其启动子的克隆与表达分析 [J]. 园艺学报, 41(6): 1236-1244.]
SUN R, LIU S, GAO JL, et al., 2014. Cloning and expression analysis of 1-deoxy-D-xylulose-5-phosphate synthase gene from the medicinal plant Conyza blinii H. Lev [J]. Turk J Biol, 38:664-670.
WANG LJ, FANG X, YANG CQ, et al., 2013. Terpene secondary metabolism and its regulation in plants [J]. Chin Sci: Life Sci, 43 (12): 1030-1046. [王凌健, 方欣, 杨长青, 等, 2013. 植物萜类次生代谢及其调控 [J]. 中国科学: 生命科学, 43(12) :1030-1046.]
XIANG S, USUNOW G, LANGE G, et al., 2007. Crystal structure of 1-deoxy-D-xylulose 5-phosphate synthase, a crucial enzyme for isoprenoids biosynthesis [J]. J Biol Chem, 282(4): 2676-2682.
ZHANG HY, FAN JM, WANG T, et al., 2018. Advances on key gene DXS involved in the terpenoid biosynthesis in plants [J]. Biotechnol Bull, 34(3):1-8. [张浩宇, 樊俊苗, 王婷, 等, 2018. 植物萜类合成关键基因DXS研究进展 [J]. 生物技术通报, 34(3):1-8.]
ZHOU W, HUANG FF, LI S, et al., 2016. Molecular cloning and characterization of two 1-deoxy-D-xylulose-5-phosphate synthase genes involved in tanshinone biosynthesis in Salvia miltiorrhiza [J]. Mol Breed, 36 (9) :124-136.
