速生白榆的组织培养与快速繁殖
2019-09-10孙红英辛全伟罗海凌马志慧严少娟
孙红英 辛全伟 罗海凌 马志慧 严少娟
摘要: 该文以速生白榆半木质化枝条为外植体,使用75%的酒精和0.1%HgCl2消毒处理,外植体经过启动培养后,在增殖培养基中进行丛生芽诱导,将丛生芽切成单株进行生根诱导,最终建立起成熟的速生白榆组培快繁体系。结果表明:外植体最佳消毒处理组合为75%的酒精处理50 s+0.1% HgCl2处理8 min,外植体污染率为17.3%,成活率为78%;将消毒处理过的外植体接种到启动培养基中,培养25 d,最終筛选出最适白榆外植体启动的培养基为MS + 1.0 mg·L-1 6-BA + 0.1 mg·L-1 IBA + 30 g·L-1蔗糖 + 6.5 g·L-1琼脂,启动率高达87.5%;将经过启动培养后的外植体腋芽切下,接种到增殖培养基中进行丛生芽诱导,最终筛选出最佳增殖培养基为MS + 0.5 mg·L-1 6-BA + 0.1 mg·L-1 KT + 0.1 mg·L-1 IBA + 30 g·L-1蔗糖+6.5 g·L-1琼脂,继代周期25 d,增殖系数达6.2;将丛生芽切成单株,接种到生根诱导培养基中,筛选出最佳生根培养基为1/2 MS + 0.1 mg·L-1 IBA + 0.1 mg·L-1 IAA+30 g·L-1蔗糖+6.5 g·L-1琼脂,生根诱导30 d,生根率达97%。将生根苗在室外炼苗后,移栽到珍珠岩∶蛭石∶泥炭土体积比为1∶1∶1的混合基质中,成活率在90%以上。较高的增殖系数、生根率和移栽成活率可以降低生产成本,进而实现工厂化育苗。
关键词: 速生白榆, 组织培养, 最佳培养基, 快速繁殖
中图分类号: Q943.1文献标识码: A文章编号: 1000-3142(2019)12-1593-06
作者简介: 孙红英(1983-),女,山东潍坊人,博士,助理研究员,主要从事生物多样性与生态系统功能、植物生理生态、植物组织培养技术的研究、推广与教学,(E-mail) shy198319@126.com。
Abstract: The semi-lignified branches of fast-growing Ulmus pumila were used as explants, 75% alcohol and 0.1% HgCl2 were used for disinfection. After initiation culture, the multiple shoots were first induced in the enrichment medium, and then cut into individual plants for rooting induction, and finally a tissue culture and rapid propagation system was established. The results showed that the optimal disinfection treatment combination of explants was 75% alcohol treatment for 50 s + 0.1% HgCl2 treatment for 8 min, the contamination rate of explants was 17.3% and the survival rate was 78%. The sterilized explants were inoculated into the initiation medium and cultured for 25 d, and the most suitable medium for start-up of the explants was found to be MS + 1.0 mg L-1 6-BA + 0.1 mg L-1 IBA + 30 g L-1 sucrose + 6.5 g L-1 AGAR, with initiation rate up to 87.5%. After the initial culture, axillary buds of the explants were cut off and inoculated into the enrichment medium for multiple shoots induction. Finally, the optimal enrichment medium was selected as MS + 0.5 mg·L-1 6-BA + 0.1 mg·L-1 KT + 0.1 mg·L-1 IBA + 30 g·L-1 sucrose + 6.5 g·L-1 AGAR, and the subculture cycle was 25 d with the increment coefficient as high as 6.2. The best rooting medium was 1/2 MS + 0.1 mg·L-1 IBA + 0.1 mg·L-1 IAA+ 30 g·L-1 sucrose + 6.5 g·L-1 AGAR, and rooting was induced for 30 d with a rooting rate of 97%. After seedling adaptation, the tissue culture seedlings of U. pumila were transplanted to mixed matrix with perlite∶vermiculite∶peat (volume ratio 1∶1∶1), and the survival rate reached above 90%. Higher increment coefficient, rooting rate and transplant survival rate can reduce production cost and realize factory seedling breeding.
Key words: fast-growing Ulmus pumila, tissue culture, optimal medium, rapid propagation
白榆(Ulmus pumila)是榆科榆属落叶乔木,也是我国分布最广的榆属树种,具有重要的生态和经济价值(王静华等,2009a,b)。白榆具有树干通直、树形高大、绿荫较浓、适应性强、生长快等特点, 在林业上是用于城市绿化、营造防风林、水土保持林和盐碱地造林的主要树种之一(傅立国,1980;苏丹等,2017)。普通白榆一年生实生苗生长高度约1.5 m,而速生白榆一年生长高度可达3 m(朱建峰等,2016)。种植速生白榆丰产林,年胸径生长量在3.5 cm以上,6年生胸径平均为22 cm,最大胸径可达28 cm(朱建峰等,2016)。
近年来,对白榆的研究注重种质资源保存、杂交育种及实生苗选育、种源变异、分子遗传和非常规育种等方面。针对白榆繁殖方面,嫁接技术较为成熟,将白榆接穗嫁接到圆冠榆、实生白榆苗和榆树上,获得完整的植株(蒋生平和高延林,2018);白榆的扦插繁殖,使用不同生根剂处理当年生嫩枝条,促进白榆生根(刘启虎等,2016),但仅在试验中成功,并未生产应用。在白榆的组织培养研究方面有较少的报道,王静华等(2009b)以白榆叶片诱导再生植株,但还存在再生芽诱导率低、玻璃化、组培苗生根困难等一系列问题尚未解决。针对上述问题,本研究以提高诱导率和生根率为目标,建立较为成熟的速生白榆组培快繁体系,为白榆工厂化育苗提供理论依据。
1材料与方法
1.1 材料
白榆(Ulmus pumila)采自山东东营苗圃基地。优选无病虫害、健壮的植株作为采穗母株,选取芽点饱满、均匀、细长、半木质化的枝条作为外植体材料,带回组培室。
1.2 方法
1.2.1 外植体消毒将带有腋芽的枝条切成0.5~1.5 cm,去掉叶片和叶柄,在流水中冲洗30 min,用柔软毛刷清洗外植体表面后,拿到超净工作台上,先用2%的次氯酸钠溶液浸泡2 min,再用75%的酒精处理30 s和50 s两个梯度,最后用0.1%的HgCl2消毒4、8、12 min ,无菌水冲洗4~5遍后用无菌滤纸吸去外植体表面的水分,装入无菌瓶中备用。每个处理105个茎段,重复3次。比较不同消毒时间的灭菌效果,统计污染率和成活率。
1.2.2 启动培养采用以下6种培养基进行腋芽诱导:(1) MS + 0.5 mg·L-1 6-BA + 0.1 mg·L-1 IBA;(2) MS + 0.5 mg·L-1 6-BA + 0.2 mg·L-1 IBA;(3) MS + 0.5 mg·L-1 6-BA + 0.3 mg·L-1 IBA;(4) MS + 1.0 mg·L-1 6-BA + 0.1 mg·L-1 IBA;(5) MS + 1.5 mg·L-1 6-BA + 0.1 mg·L-1 IBA;(6) MS + 2.0 mg·L-1 6-BA + 0.1 mg·L-1 IBA;以上各培养基均添加30 g·L-1蔗糖和6 g·L-1琼脂,pH 5.8。每瓶接种1个外植体,每个处理75瓶,重复3次。培养条件:培养温度 (25 ± 3) ℃,光照时间12 h·d-1,光照强度3 500 lx,25 d后,观察腋芽的生長情况,统计腋芽启动率。
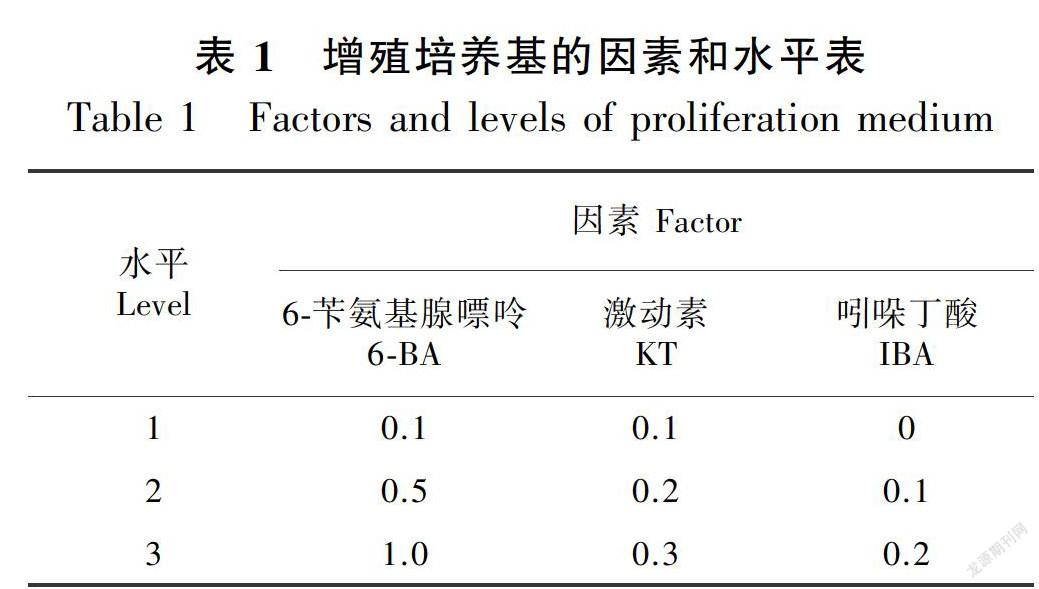
1.2.3 增殖培养以MS为基本培养基,采用L9 (34) 正交试验设计,添加6-BA(0.1、0.5、1.0 mg·L-1)、IBA (0.1、0.2、0.3 mg·L-1)和IAA(0、0.1、0.2 mg·L-1)(表1)。接种25 d后统计增殖系数。
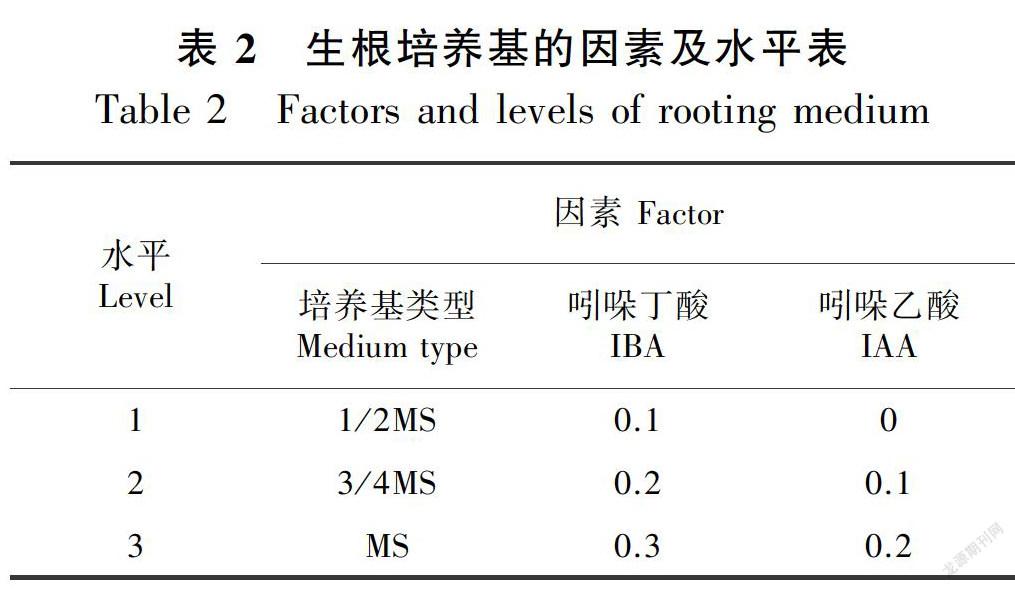
1.2.4 生根培养用L9(34)正交试验设计生根培养基(表2),所用基本培养基为1/2 MS、3/4 MS、MS,所用促生根激素为IBA(0.1、0.2、0.3 mg·L-1)和IAA(0、0.1、0.2 mg·L-1)。选取经过继代培养后生长健壮、株高2 cm以上的无根苗,将其接种到上述培养基中,30 d后统计生根情况,计算生根率。
1.2.5 炼苗移栽首先,将生根培养30 d后的生根苗放到自然环境条件下,放置3~5 d,拧开组培瓶瓶盖,放置2 d,定时进行叶片喷水保湿,保证叶片伸展无卷叶焦叶,促使组培苗适应自然环境条件。然后,将组培苗从瓶中取出,在清水中洗掉培养基,置于5‰ 的高锰酸钾溶液中消毒3 min。最后,用自来水清洗干净,移栽到珍珠岩∶蛭石∶泥炭土体积比为1∶1∶1的基质中,定时淋水,30 d后统计移栽成活率,移栽成活率=存活苗数/移栽苗数×100%。
1.3 数据处理分析
外植体污染率=污染个数/接种个数×100%;成活率=成活个数/接种个数×100%;启动率=茎段萌芽数/接种后无菌茎段总数×100%;增殖系数=诱导后不定芽总数/原接种茎段总数;生根率=生根个数/接种个数×100%。采用SPASS16.0和Excel软件进行数据统计分析。
2结果与分析
2.1 外植体消毒
从表3可以看出,使用75%的酒精和0.1% HgCl2组合对白榆外植体进行消毒处理,随着消毒时间的延长,污染率逐渐降低(P<0.05)。其中,处理1消毒时间最短,处理6消毒时间最长,两组消毒处理间的外植体污染率达到显著差异(P<0.05)。处理6污染率最低,但消毒时间长对外植体的伤害较大,外植体的成活率仅有65.7%。因此,综合白榆外植体的污染率和成活率,处理5(75%的酒精50 s + 0.1% HgCl2 8 min)具有较低的外植体污染率,较高的外植体成活率,为白榆外植体最佳消毒处理组合。
2.2 启动培养
从表4可以看出,培养基(1)、(2)和(3)诱导的白榆外植体腋芽细弱且生长缓慢,这三种培养基不适合白榆外植体的启动培养。培养基(5)和(6)诱导的腋芽虽然生长快,但玻璃化严重,叶片卷曲,并且外植体基部愈伤组织较大,因此,这两种培养基不适合白榆外植体的腋芽诱导。培养基(4)对外植体的启动率较高,且腋芽粗壮,生长较快。可见,最适合白榆外植体启动为(4)号培养基,其外植体启动率为87.5%,最终筛选出适合白榆外植体启动的培养基为(4) MS + 1.0 mg·L-1 6-BA + 0.1 mg·L-1 IBA。
2.3 增殖培养
将启动培养所获得的腋芽切下,接种到增殖培养基中进行丛生芽的诱导。表5结果显示,9个处理对白榆增殖有不同程度的影响,增殖系数在1.5~6.5之间。根据表5中的R值分析结果,6-BA在白榆增殖过程中作用最大,R值为3.5;之后依次是KT和IBA。从表6方差分析可以看出,在白榆继代过程中,细胞分裂素6-BA对增殖系数影响最大,其F值171.438,在0.01水平达到显著;其次为激动素KT,其F值为24.813,在0.05水平达到显著;生长素IBA对白榆增殖系数无显著影响。在所有不同的处理组合中, 4号培养基增殖系数最大,增殖系数6.2。因此,筛选出白榆苗继代培养的最佳培养基为MS + 0.5 mg·L-1 6-BA + 0.1 mg·L-1 + 0.1 mg·L-1 IBA。
2.4 生根培养
由表7极差分析可以得出,影响白榆组培苗生根的三个因素中,培养基类型最为重要,生长素IBA对白榆组培苗生根的作用次之,IAA的作用较小;由表8方差分析可知,培养基类型对白榆组培苗生根在0.01水平显著,其F值847.459,在三因素中,对白榆组培苗生根起到重要作用;生长素IBA对白榆组培苗生根在0.05水平显著,其F值为41.703;生长素IAA对白榆组培苗生根无显著影响。综合表7和表8的结果,最终筛选出白榆组培苗生根的最佳培养基为 (7) 1/2 MS + 0.1 mg·L-1 IBA + 0.1 mg·L-1 IAA,生根率达到97%。
2.5 炼苗移栽
移栽30 d后统计,白榆组培苗的移栽成活率在90%以上。移栽50 d左右,白榆组培苗叶片舒展变大,叶片深绿色,顶芽有新叶长出。
3讨论
污染是组织培养过程中最先遇到的问题,能否成功获得一定数量的无菌材料是植物组织培养成败的第一步(李健等,2010)。消毒过程中使用单一的消毒剂虽然对外植体伤害较小,但消毒效果较差,通常多个消毒剂组合使用,会明显降低外植体的污染率(谢羽等,2017)。本研究使用75%的酒精50 s + 0.1% HgCl2 8 min的组合,达到较好的消毒效果。下一步,可以针对白榆外植体消毒,使用2种及以上的消毒剂进行正交组合,筛选更优的消毒剂组合。
在植物离体快繁中,植物生长调节剂是培养基中的外源添加物(椰汁、香蕉、马铃薯等),细胞分裂素、生长素及组合对培养物的诱导分化起重要作用(吴秀燕和张鸽香,2017)。本研究通过研究不同浓度和激素组合(6-BA、KT和IBA)对白榆组培快繁的影响,其中 6-BA对白榆丛生芽诱导影响最大,低浓度虽然能诱导出丛生芽,但植株生长缓慢,增殖系数低;较高浓度6-BA诱导的丛生芽数量较多,但玻璃化较为严重,最终优选6-BA使用浓度为0.5 mg·L-1。本研究在白榆增殖过程中,所使用6-BA出现的上述结果与王静华等(2009b)结果一致。本研究进一步印证了植物激素的两重性,低浓度促进生长,高浓度抑制生长。
在植物快速繁殖中, 培养基中添加一定质量浓度的生长素有利于诱导生根 (Huang & Murashige, 1983)。生长素IBA对白榆组培苗生根诱导影响较大,最佳生根组合为1/2 MS + 0.1 mg·L-1 IBA + 0.1 mg·L-1 IAA,生根率达97%。在白榆生根过程中,本实验以MS为基本培养基,优选出最佳生根配方。下一步研究,可以对比不同培养基类型,对白榆组培苗生根诱导,达到更高的生根率,优化目前的生根配方。
综上所述,本研究建立了成熟的速生白榆离体快繁体系,为白榆产业化快速育苗提供了理论基础和技术支撑,对速生白榆造林育苗提供一条高效的育苗手段,为苗木市场提供优质的白榆种苗。
参考文献:
FU GL, 1980. Study of Chinese Elms [J]. J NE For Inst, 3: 1-40. [傅立国, 1980. 中国榆属的研究 [J]. 东北林学院学报, 3: 1-40.
HUANG LC, MURASHIGE T, 1983. Tissue culture investigations of bamboo. I. Callus cultures of Bambusa, Phyllostachys and Sasa [J]. Bot Bull Acad Sin, (24): 31-52.
JIANG SP, GAO YL, 2018. Technique of grafting crown for white elm [J]. For Sci Technol, 3: 84-85. [蒋生平, 高延林, 2018. 白榆嫁接圆冠榆技术 [J]. 林业科技, 3: 84-85. ]
LIU QH, BAO ZG, TAN HG, et al., 2016. Study on cutting cutting propagation of five species of Ulmus pumila [J]. Shandong For Sci Technol, 3: 46-47. [刘启虎, 包志刚, 谭好国, 等, 2016. 5份白榆种质资源嫩枝扦插繁殖技术研究简报 [J]. 山东林业科技, 3: 46-47.]
LI J, LI JJ, WU CZ, et al., 2010. Selection and sterilization of explant of Tripterygium wilfordii in tissue culture [J]. J Centr S Univ For Technol, 30 (8): 18-21. [李健, 李建娟, 吳承帧, 等, 2010. 雷公藤组织培养外植体消毒和选择 [J]. 中南林业科技大学学报, 30 (8): 18-21.]
WANG JH, HOU JS, LIU GL, 2009a. Study on tissue culture and leaf regeneration of two kinds of different provenances Siberian elm [J]. Chin Agric Sci Bull, 25(5): 110-115. [王静华, 侯建生, 刘桂林, 等, 2009a. 两种不同种源地白榆的组织培养与叶片再生研究 [J]. 中国农学通报, 25(5): 110-115.]
WANG JH, HOU JS, LIU GL, et al., 2009b. Tissue culture and plant regeneration from leaf of Siberian elm [J]. J NW For Univ, 24 (5): 74-77. [王靜华, 侯建生, 刘桂林, 等, 2009b. 白榆的组织培养与叶片再生研究 [J]. 西北林学院学报, 24 (5): 74-77.]
SU D, YIN XL, DONG Z, et al., 2017. Response in growth and ionic distribution of elm clones under NaCl stress [J]. J Beijing For Univ, 39 (5): 48-57. [苏 丹, 殷小琳, 董智, 等, 2017. 白榆无性系生长特性及离子分布对NaCl胁迫的响应 [J]. 北京林业大学学报, 39 (5): 48-57.]
WU XY, ZHANG GX, 2017. Study on embryo culture and rapid propagation in vitro of Chionanthus virginicus [J]. Plant Physiol J, 53 (2): 227-233. [吴秀燕,张鸽香, 2017. 美国流苏离体胚的组织培养与快速繁殖 [J]. 植物生理学报, 53 (2): 227-233.]
XIE Y, XIA K, LI M, et al., 2017. Effects of different angiosperms on callus induction and sterilization methods research [J]. Mol Plant Breed, 15 (3) : 1029-1034. [谢羽, 夏凯, 黎敏, 等, 2017. 不同类被子植物组培快繁及其消毒方式的影响 [J]. 分子植物育种, 15(3) : 1029-1034.]
ZHANG JF, LONG ZR, LIANG YT, 1991. Study on regenerated plants of new Ulmus pumila variety 74009 in vitro [J]. Shandong For Sci Technol, 4: 18-21. [张建锋, 龙庄如, 梁玉堂, 1991. 白榆新品种74009离体培养再生植株的研究 [J]. 山东林业科技, 4: 18-21.]
ZHU JF, QIAO LQ, ZHANG HX, 2016. Research and utilization of Ulmus pumila and discussion and prospect on its variety improvement in China [J]. World For Res, 29 (3): 46-51. [朱建峰, 乔来秋, 张华新, 2016. 白榆研究利用现状及我国白榆良种化探讨与展望 [J]. 世界林业研究, 29 (3): 46-51.]
