湿地生境下土壤砷形态转化与微环境因子的关系
2019-09-10任伟赵蓉刘云根杨桂英赵立君张慧娟李梦莹王妍
任伟 赵蓉 刘云根 杨桂英 赵立君 张慧娟 李梦莹 王妍




摘要:通过持续淹水种植典型挺水植物香蒲(Typha angustifolia L.)的模拟湿地生境盆栽试验,探究外源砷(As)污染土壤在不同时间内微环境因子[溶解氧含量(DO)、氧化还原电位(E)、电导率(EC)和pH值]的变化规律及砷形态转化的过程和影响因素,并评估对应的环境风险。结果表明,土壤微环境因子对不同处理时间的响应存在差异,随着试验时间延长土壤DO值、En值均表现出先降低后升高的趋势;土壤酸碱度趋于中性,且不同处理间没有显著差异;土壤电导率逐渐上升。随着淹水时间的延长,非专性吸附态As(F1)及残渣态As(F5)含量均不断减少,晶型铁铝氧化物结合态As(F4)不断增加,由生物有效态向非生物有效态转化,基本趋于稳定。土壤微环境因子对土壤As结合态的影响是多方向的,同一微环境因子对不同结合态具有不同相关性,且存在较大差异,En、DO及pH均对土壤中As的转化具有重要贡献。随着试验时间加长,土壤中As的环境风险表现出先大幅降低后小幅增加的趋势,中后期总体处于中低环境风险状态。
关键词:砷;微环境因子;结合态;环境风险
中图分类号:X53
文献标识码:A
文章编号:1000-4440(2019)02-0321-08
近年来,砷(As)污染给中国湖泊河流、水库等地表水环境安全带来严重威胁[1-3],诸如湘江、批江.大沙河、阳宗海、大屯海、柴石滩等湖泊、河流水体先后因砷污染问题而被广泛关注[4-5]。尽管经过多年治理部分湖泊水体砷污染得到有效控制,但有研究结果表明,湖泊和河流底泥砷的大量累積依然存在不可忽视的二次污染风险[6-7]。挺水植物是湖滨湿地的重要组成部分,在拦截陆源污染、净化湖泊水质等方面发挥着重要作用[8]。湖滨湿地季节性水位涨落和风浪干扰导致其氧化还原电位交替变化频繁[9],其不仅是湿地植物生长及营养吸收分配的主要影响因子[10-11],亦是引发湖滨湿地重金属形态转化的重要因素[12]。外源砷进入土壤后,一小部分溶解在土壤溶液中,一部分吸附在土壤胶体.上,大部分转化为难溶性砷化物[13]。根据生物可利用的难易程度,砷在土壤中的结合形态可分为水溶态砷(溶解在土壤溶液中)、交换态砷(吸附于土壤表面交换点上)和难溶态砷(被土壤胶体吸附,并与铁、铝、钙等离子结合形成难溶性砷酸盐)[14]。一般而言,在土壤酸碱度和氧化还原条件变化影响下,土壤中As会在易溶性和难溶性砷化合物之间相互转化[I5],是一个动态过程。当前沉积物-水界面附近是砷在环境中迁移转化研究的重点区域,研究主要集中在河流湖泊和近海海域原位沉积物As存在的形态及风险评价[16-17]、不同介质对砷生物化学行为的影响[18]及土壤-水稻体系中砷的迁移转化[19]。但针对湿地生境下不同砷污染土壤中As形态动态变化与微环境因子的耦合关系及相应的生态风险,鲜有研究报道。由于湖滨湿地底泥砷的赋存形态直接决定其毒性效应和生态风险,本研究通过盆栽试验模拟湿地生境,探析长期淹水种植典型湿地植物香蒲(Typha angustifolia L.)情况下,不同处理时间土壤微环境因子[溶解氧含量(DO)、氧化还原电位(E,)、电导率(EC)和pH]变化规律及土壤中砷形态转化过程,以期为砷污染湖泊的生态修复提供理论参考。
1 材料与方法
1.1 试验材料
土壤来源于昆明市海拔1900m处的低洼地段表层(0~20em)土壤,土壤类型为红壤。土壤样品采回后自然阴干,敲碎、磨细后过4mm筛备用。土壤基本性质:酸碱度(pH值)3.97,总砷(T-As)含量8.39mg/kg,不同结合态As[非专性吸附态(F1)、专性吸附态(F2)、不定型铁铝氧化物结合态(F3)、晶型铁铝氧化物结合态(F4)和残渣态(F5)[20]含量分别为1.29mg/kg.1.19mg/kg.0.76mg/kg、5.40mg/kg、2.27mg/kg,有机质(TOC)含量1.84g/kg,总磷(T-P)含量0.57g/kg,总钙(T-Ca)含量2.86g/kg。土壤污染物含量限值参考《土壤环境质量农用地土壤污染风险管控标准(试行)》[21](农用地土壤酸碱度(pH值)≤5.5,总砷(T-As)含量限值为40mg/kg)判别。
供试植物为狭叶香蒲,为多年生水生或沼生草本,是典型的湿地挺水植物。狭叶香蒲取自云南省昆明市泛亚苗圃基地,选取当年生高度一致(株高约35em)、长势良好的萌生苗作为供试材料。
1.2 盆栽试验
采用盆栽试验模拟湿生环境。盆栽装置为无盖黑色聚乙烯塑胶桶(高32cm,口径48cm,底径32cm),每桶装入10kg干土和10L纯净水。通过外源添加Na,HAsO4·7H20的方式设置5个不同含量的砷污染处理:0mg/kg(CK)、50mg/kg、100mg/kg.200mg/kg、400mg/kgAs+。每个处理3次重复。加入Na,HAsO4·7H,O溶液,使土壤成黏稠状,充分混匀,自然放置平衡7d后用于试验。
盆栽试验在西南林业大学露天试验区进行,试验区内环境条件为自然状态,无人为干扰。该地区属北亚热带低纬高原山地季风气候,气候温和,年平均气温15C,年降水量1450mm。于2017年4月初移栽香蒲幼苗,每个盆栽装置中等间距移栽6株香蒲幼苗并统一添加等量园林复合基肥(N:P20,:K,0=16:16:16),试验期间保障水肥条件一致,保持试验装置处于相同淹水状态。分别在植株移栽后第50d第100d、第200d采集土壤样品,测定土壤总砷(T-As)及各结合态As含量。
1.3 分析测定方法
于不同时间将每盆土壤自然风干,去除根系,敲碎混匀过149mm筛,密封保存备用。土壤基本理化性质测定采用常规方法[22]:土壤有机质(TOC)含量采用重铬酸钾法测定,总磷含量采用钼梯抗紫外分光光度法测定,总钙含量用FP6410型火焰光度计测定。土壤微环境因子pH值采用酸度计(雷磁PHS-3C)测定(水土质量比2.5:1.0)。溶解氧含量(DO)、氧化还原电位(E)、电导率(EC)利用自制土壤垂直PVC采样管采集土壤鲜样品,剔除植物根系残体后混匀样品,按照水土比3:1(90ml去离子水与30g混匀土壤样品)混合均匀后,及时用HACH便携式仪器(HQ40d)测定。
风干土壤样品砷含量测定:总砷含量采用王水(HNO3和HCl体积比为3:1)消解提取(HJ 680-2013)法测定,结合态砷含量采用Wenzel等[23]报道的连续五步提取法(Sequential extraction procedure,SEP)测定。其中,非专性吸附态、专性吸附态砷在土壤中具有较高的活性,为生物有效态砷;后3种结合态砷的生物可利用性较低,在土壤中较为稳定,为非生物有效态砷。所有样品测定过程中均设置空白对照和重复,所有砷含量均使用AFS-810双道氢化物发生原子荧光分光光度计(北京吉天公司产品)测定。
1.4 数据统计与分析
应用SPSS 21.0软件对土壤微环境因子(溶解氧含量、氧化还原电位、电导率、pH值)、各结合态砷及总砷含量等指标进行单因素方差分析(One-wayANVOA),差异显著性水平设定为a=0.05。用Pearson法对土壤微环境因子与结合态砷和总砷含量进行相关分析,借助Canoco 4.5进行蒙特卡罗置换检验(Monte Carlo permutation test)。采用Origin2018软件绘图。
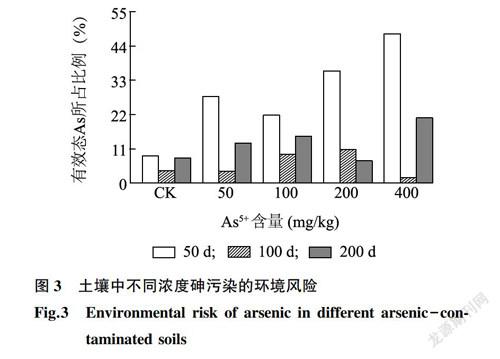
采用风险评价编码法(RAC)对土壤中砷的生态风险进行评价。RAC法中将非专性吸附和专性吸附态砷之和(F1+F2)视为砷的有效部分,通过计算该部分砷总量的比例,评价沉积物中砷的有效性,进而对其环境风险进行评价。根据有效部分所占比例将其环境风险分为5个等级:<1%为无风险;1%~10%为低风险;11%~30%为中等风险;31%~50%为高风险;>50%为极高风险[24]。
2 结果与分析
2.1 不同含量砷污染土壤微环境因子变化特征
从图1可知,砷污染处理50d时土壤DO值随土壤中砷(As+)含量的升高呈下降趋势,氧化还原电位(E)变化不大;随着土壤中外源砷含量的增加,100d时土壤DO值与E值逐渐降低,200d时土壤DO值与E值表现出先增加后降低的趋势。不同处理时间下土壤DO值和氧化还原电位均存在差异,50d时最高;100d时DO值和E,值分别为0d时的35分之一和5分之一,其溶解氧含量较低,土壤处于还原状态;200d时,DO值和E值较100d时平均上升5倍和2倍,土壤由还原状态转变为氧化状态。不同含量砷污染条件下,土壤EC值在处理50d、100d时变化不大;200d时高含量砷(As'+含量≥100mg/kg)污染处理土壤EC值高于低含量(As'+含量≤50mg/kg)处理,且差异显著;随着时间的延长,各处理的土壤EC值均逐渐上升,可电离盐类含量不断增加。不同处理时间下土壤pH值则无明显变化,在7.24至7.54之间波动,土壤酸碱度呈中性。
2.2 不同含量砷污染土壤中各形态砷的分布
不同处理时间土壤总砷(T-As)及各结合态砷含量见表1。随着处理时间的延长,各含量砷污染处理土壤T-As含量均逐渐下降;F1和F5的含量在各含量砷处理中亦均呈下降趋势,200d时较50d时分别减少73%~98%、76%~86%;F2含量在不同处理时间表现出的规律为:50d>200d>100d;F3、F4含量,随着时间的延长,基本呈现先增加后降低的趋势,但400mg/kgAs'+处理下200d时F4含量是100d时的3.8倍。在不同含量砷污染下,不同结合态砷含量间差异显著,不同处理时间各形态占比亦存在差异。50d时除400mg/kg含量处理下F2占比最大达到39%外,其余各含量处理下F5占比均最大(达到38%~98%),F2、F4占比其次(分别为25%、19%),F3及F1最少。100d时同样除400mg/kg含量处理下F3占比达到80%外,其余各处理F4占比均最大(达到45%~68%),F3其次(33%),F5占比较50d时迅速降低,降幅达到71%~84%。200d时,F4占比最大,F2最小;在0~100mg/kg砷处理下F4>F5>F3>F2;在200mg/kg、400mg/kg砷处理下F3小于F4,大于F2及F3。
砷污染土壤中生物有效态与非生物有效態砷分布如图2所示。不同处理时间下对照土壤中生物有效态As所占比例变化不大。随着时间延长,除400mg/kgAs'+处理外,其余各砷含量处理下生物有效态As占比变化基本表现出先降低后趋于稳定的规律,100d、200d时分别比50d时平均降低了70%、60%;400mg/kgAs'+处理下生物有效态As占比则表现出较为明显的先降后升的趋势,非生物有效态As含量则相反,但200d时生物有效态As占比远低于50d时的占比,仅是其50%。总体而言,土壤中As由生物有效态向非生物有效态转化,且基本趋于稳定。
2.3 土壤微环境因子与土壤中As含量的相关性
对土壤微环境因子和各结合态砷含量进行Pearson相关性分析。结果(表2)表明,F5、F4含量与有效态As(F2和F1)含量均呈极显著正相关;F2与F1含量亦呈极显著正相关,相关系数达到0.986。DO值与F2、F1含量呈显著负相关,与F3含量则呈显著正相关;E,值与F3含量呈显著负相关,与F4含量则呈显著正相关;EC值与F4含量呈极显著正相关,与F5含量呈显著负相关性;土壤pH值与F1、F2、F5含量呈极显著正相关。蒙特卡洛检验结果显示,不同土壤微环境因子对土壤中As转化影响的贡献大小顺序为E,>DO>pH>EC,贡献率依次是98.9%、95.5%、81.4%、50.1%。说明E,、DO值及pH均对土壤中As转化具有重要影响,土壤氧化还原状况尤为重要,EC值则作用不明显。
2.4 土壤中砷的生态风险评价
采用风险评价编码法(RAC)对土壤中砷的生态风险进行评价。风险评价编码法主要针对重金属的生物有效性部分,环境风险评价更为直接[[25]0RAC评价结果(图3)表明:不同砷污染水平与不同处理时间下砷的环境风险均达到污染程度,且随着外源砷添加量的增加,其风险等级越高。随着处理时间延长,土壤中有效态砷所占比例呈先迅速降低后略有升高的趋势。50d时,除对照处于低风险外,50mg/kg和100mg/kgAsS+处理下有效态砷所占比例分别为28%、22%,处于中等风险状态;当土壤AsS+含量≥200mg/kg时,土壤中有效态As所占比例均值高达42%,处于高风险状态。100d时土壤中有效态As所占比例降低至10.8%~1.7%,较50d时下降了54%~96%,处于低风险状态;200d时土壤中有效态As所占比例除200mg/kgAs'+处理外,其他处理均较100d时有所提高,但小于50d时土壤中有效态As所占比例,处于中低环境风险状态。
3 讨论
土壤微环境因子(溶解氧含量、氧化还原电位、电导率、pH值)不仅是湿地植物生长及营养吸收分配的重要影响因子[1],亦是引发湖滨湿地矿物元素形态转化的重要因素[12]本研究中土壤氧化还原状况对不同处理时间的响应存在差异,可能是由于淹水状态切断了土壤的氧气供应,且随着时间推移,由于微生物耗氧的生物氧化还原作用,导致土壤中的氧气被逐渐耗竭。但植物根系成熟区皮层细胞在长期淹水后会发生程序性死亡,溶解而形成通气组织(26由地上部向根部输送氧气以完成根系泌氧。在处理50d时植株快速生长,促使其根系孔隙变大,不定根数量增多[10],以提高根系泌氧能力,使土壤中溶解氧含量相对较高。处理100d时滇中地区正处于高温期,有机污染物降解和还原性无机物氧化大量消耗氧[27],使土壤水溶解氧含量降低,土壤处于还原状态。200d时,气温降低,限制了耗氧活动,此外香蒲植株枯黄,营养元素回流,促进地下长出新根,有效地提高了香蒲根系泌氧能力,土壤中氧含量升高,处于氧化状态,E,值回升。不同处理时间下,400mg/kgAs'+处理的土壤溶解氧含量均最低,可能与植株在高含量砷胁迫下生长缓慢、根系欠发达有关;同时香蒲根系难以吸收利用太低含量的溶解氧,进一步延缓了植株生长发育。随着处理时间延长,可电离盐类含量不断增加,出现该现象的原因:一方面可能由于香蒲根系组织不断生长,活化了土壤中矿物元素;另一方面可能与植物生长中后期低水平的土壤E值提高了铁锰氧化物溶解性,使土壤中还原态锰、铁等阳离子和S2-等阴离子含量增加有关。在淹水种植香蒲模拟湿地生境条件下土壤pH呈中性,可能与植物根系调节与土壤淹水状态有关。
有研究结果表明在中性和碱性条件下,微生物的甲基化作用明显[28],可能导致土壤中砷含量减少,使砷对环境的毒害作用减弱。香蒲对As具有一定富集能力[29]。本研究中随着时间的延长土壤T-As不断减少,这可能是微生物甲基化及香蒲对砷吸收积累双重作用的结果。众多学者认为与重金属总量相比,重金属的化学形态能更精确地反映其在环境中的生物有效性[30]。本试验结果表明,不同处理时间下,土壤中砷各结合态变化显著。香蒲对砷的不断吸收积累,使极易被生物吸收利用的非专性吸附态As随处理时间增加不断降低。植物可以通过根系作用钝化或固定土壤中的重金属[31],亦可以通过根际微生物的代谢活化土壤重金属以增强植物对重金属的吸收[32],例如有机酸可酸化土壤微环境促进土壤中重金属的溶解33]。本研究结果表明,残渣态As含量随植物生育期的延长,不断减少,可能与香蒲发达的根系及根系微环境的活化有关。随着处理时间的延长,铁铝氧化物结合态As含量增大,这与Guo等[34]的研究结论相一致。在湿地环境中,外源砷进入土壤后其形態转化是一个复杂的过程,既存在土壤老化作用,又存在植物根系活化吸收,形成降低有效性与稳定性双向效应。富含Fe、Al等氧化物的红壤对砷具有较强的吸附性[35],导致晶型铁铝氧化物结合态砷的含量增加,使砷逐渐向与土壤结合更为紧密的形态转化,由生物有效态向非生物有效态转化,其生物有效性降低。溶解氧含量、氧化还原电位条件不仅是驱动土壤砷释放的原因,而且是影响As形态转变的关键因子。有研究者发现溶解氧含量下降后,土壤处于厌氧状态,砷的溶解度升高[36],有效态As增加。土壤在富氧条件下易形成铁锰氧化物,有利于铁铝氧化物结合态As的形成。氧化还原电位可以通过影响环境中有关化合物的溶解性来影响砷的释放,本研究中通过蒙特卡洛检验发现土壤氧化还原条件对土壤中As转化的贡献尤为重要。在本试验中,晶型铁铝氧化物结合态As与不定型铁铝氧化物结合态As含量随时间延长,呈先增加后降低的趋势,这可能与香蒲根表面铁膜的形成与退化有关。郭伟等[37]研究发现,分蘖期水稻根表铁膜成为根际砷的富集库。杨文弢等[30]指出不同厚度和处于不同老化程度的铁氧化物膜在一定条件下可以改变污染物的活性。在根表铁膜的作用下,香蒲根系对根际土壤砷活性的影响主要发生在生长的中前期,处理100d时香蒲根系铁膜大量形成,促使铁铝氧化物结合态As增多,处理200d时随着植株根表铁膜脱落,铁铝氧化物结合态As含量降低。pH对土壤中As的转化亦具有重要贡献,pH值的变化会影响As的赋存形态,土壤中As存在形式以阴离子为主,土壤pH值的变化会影响土壤中砷的吸附和解吸[15],土壤酸碱度稳定于中性,有效态As处于较低水平,生物有效性亦趋于稳定。Hon-ma等[32]研究结果表明pH值与土壤中As的移动性具有显著正相关性,与本试验中土壤pH值与砷结合态(F1F2)呈极显著正相关的结论相符。本试验仅对影响湿地生境中砷形态变化的主要微环境因子进行了分析,具体机理有待进一步研究。
长期淹水使土壤中的重金属氧化态含量增高,溶解性和移动性增强,生态风险增大。香蒲对有效态砷(F1与F2)的吸收,有效降低了有效态砷含量。处理100d时环境风险基本处于低风险状态,这可能与香蒲根系对养分和砷的吸收较快[8]及土壤老化双重作用有关;处理200d时环境风险.上升至中低风险,这可能由于植物茎叶凋落、营养回流造成的。试验结果表明,随着砷污染程度的增大,其风险等级也越高,说明砷在土壤中的迁移能力和生物有效性与砷的总量及其存在形态有较大的关系[29,这与许仙菊等[39]研究结果相近。因此,研究土壤中As的迁移转化规律需综合考虑各方面影响因子,动态评估可被生物直接利用的部分重金属带来的环境风险,使土壤评价、治理更具科学性。湖滨湿地中以氧化还原电位为代表的微环境因子的频繁变化[40],以及不同物候期湿地植物及其复杂根际的根际作用差异,使湖滨湿地的赋存形态变化过程和机制更加复杂,因此需要精准的因子控制试验和野外验证以厘清湖滨湿地As的赋存形态变化过程和机制。
参考文献:
[1]HE J,CHARLET L. A review of arsenic presence in China drink-ing water[J]. Journal of Hydrology,2013,492(10):79-88.
[2]FENDORF S,MICHAEL H A,GEEN A V. Spatial and temporal variations of groundwater arsenic in South and Southeast Asia[J].Science,2010,328(5982):1123-1127.
[3]史晓凯,马茹茹,颜道浩,等.外源砷胁迫对土壤细菌群落结构的影响[J].江苏农业科学,2018,46(14):242-246,252.
[4]黄维恒,包立,林健,等.沘江流域耕地土壤重金属分布及生态风险评价[J].农业资源与环境学报,2017,34(5):456-465.
[5]吴万富,徐艳,史德强,等.我国河流湖泊砷污染现状及除砷技术研究进展[J].环境科学与技术,2015(s1):190-197.
[6]RESONGLES E,CASIOT C,FREYDIER R,et al. Persisting impact of historical mining activity to metal (Pb,Zn,Cd,TI,Hg)and metalloid (As,Sb)enrichment in sediments of the Gardon River,Southern France[J]. Science of the Total Environment ,2014,481:509-521.
[7]李彦静.大冶湖底泥养分重金属和砷、汞含量及空间分布特征研究[D].武汉:湖北大学,2016.
[8]王启栋,宋金明,李学刚.黄河口湿地有机碳来源及其对碳埋藏提升策略的启示[J].生态学报,2015,35(2):568-576.
[9]李梦莹,郑毅,刘云根,等.阳宗海湖滨湿地沉积物砷和有机质对磷赋存形态的影响[J].农业环境科学学报,2016,35(11):2171-2179.
[10]LI X,XUE Z,GAO J. Environmental influence on vegetation properties of frigid wetlandson the Qinghai-Tibet Plateau,W esternChina[J]. Wetlands,2016,36(5):807-819.
[11]董磊,徐力刚,许加星,等.鄱阳湖典型洲滩湿地土壤环境因子对植被分布影响研究[J].土壤学报,2014,51(3):618-626..
[12]SHAOX,LIANGX,WU M,et al. Influences of sediment properties and macrophytes on phosphorous speciation in the intertidalmarsh[J]. Environmental Science and Pollution Research,2014,21(17):10432-10441.
[13]刘文菊,赵方杰.植物砷吸收与代谢的研究进展[J].环境化学,2011,16(30):56-62.
[14]李思妍,史高玲,娄来清,等.P、Fe及水分对土壤砷有效性和小麦砷吸收的影响[J].农业环境科学学报,2018,37(3):415-422.
[15]钟松雄,尹光彩,陈志良,等.En、pH和铁对水稻土砷释放的影响机制[J].环境科学,2017,38(6):2530-2537.
[16]杨芬,朱晓东,韦朝阳.陆地水环境中砷的迁移转化[J].生态学杂志,2015,34(5):1448-1455.
[17]刘群群,孟范平,王菲菲,等.东营市北部海域沉积物中重金属的分布、来源及生态风险评价[J].环境科学,2017,38(9):3635-3644.
[18]刘雪.抗砷细菌及根系有机酸对砷超富集植物蜈蚣草促生及吸砷机理研究[D].南京:南京大学,2017.
[19]钟松雄,何宏飞,陈志良,等.水淹条件下水稻土中砷的生物化学行为研究进展[J].土壤学报,2018,55(1):1-17.
[20]钟松雄,尹光彩,黄润林,等.利用invitro方法研究不同铁矿对土壤砷生物可给性的影响[J].环境科学,2017,38(3):1201-1208.
[21]国家生态环境部.土壤环境质量农用地土壤污染风险管控标准(试行):GB15618-2018[S].北京:中国环境科学出版社,2018.
[22]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1999.
[23]WENZEL W W,KIRCHBAUMER N,PROHASKA T,et al. Arsenic fractionation in soils using an improved sequential extraction procedure[J]. Analytica Chimica Acta,2001 ,436(2):309-323.
[24]孔明,董增林,晁建穎,等.巢湖表层沉积物重金属生物有效性与生态风险评价[J].中国环境科学,2015,35(4):1223-1229.
[25]ABIKO T,OBARA M. Enhancement of porosity and aerenchyma formation in nitrogen. deficient rice roots.[J]. Plant Science An International Journal of Experimental Plant Biology,2014,215/216(2):76.
[26]杨旭健,傅友强,沈宏,等.水稻根表铁膜及其形成的形态、生理及分子机理综述[J].生态学杂志,2014,33(8):2235-2244.
[27]王旭刚,孙丽蓉,马林娟,等.黄河中下游湿地土壤铁还原氧化过程的温度敏感性[J].土壤学报,2018,55(2):380-389.
[28]苏世鸣,曾希柏,白玲玉,等.微生物对砷的作用机理及利用真菌修复砷污染土壤的可行性[J].应用生态学报,2010,21(12):3266-3272.
[29]WANGZ,HOUL,LIU Y,et al. Metal contamination in a riparian wetland:distribution,fractionation and plant uptake [J ].Chemosphere,2018,200:587.
[30]楊文嫂,王英杰,周航,等.水稻不同生育期根际及非根际土壤砷形态迁移转化规律[J].环境科学,2015(2):694-699.
[31]雷鸣,曾敏,廖柏寒,等.含磷物质对水稻吸收土壤砷的影响[J].环境科学,2014(8):3149-3154.
[32]HONMA T,OHBA H,KANEKOKADOKURA A,et al. Optimal soil En,pH,and water management for simultaneously minimizingarsenic and cadmium concentrations in rice grains[J]. Environ-mental Science & Technology,2016,50(8):4178.
[33]卜贵军,于静,邸慧慧,等.鸡粪堆肥有机物演化对重金属生物有效性影响研究[J].环境科学,2014,35(11):4352-4358.
[34]GUOH,REN Y,LIU Q,et al. Enhancement of arsenic adsorption during mineral transformation from siderite to goethite:Mecha-nism and application [J]. Environmental Science & Technology,2013,47(2):1009- 1016.
[35]王亚男.外源砷在土壤中的老化及其对土壤微生物影响的机理研究[D].北京:中国农业大学,2016.
[36]杨明,许丽英,宋雨,等.厌氧微生物作用下土壤中砷的形态转化及其分配[J].生态毒理学报,2013,8(2):178-185.
[37]郭伟,林咸永,程旺大.不同地区土壤中分蘖期水稻根表铁氧化物的形成及其对砷吸收的影响[J].环境科学,2010,31(2):496-502.
[38]孙瑞波,盛下放,李娅,等.南京栖霞重金属污染区植物富集重金属效应及其根际微生物特性分析[J].土壤学报,2011,48(5):1013-1020.
[39]许仙菊,张永春,沈睿,等.水稻不同生育期土壤砷形态分布特征及其生物有效性研究[J].生态环境学报,2010,19(8):1983-1987.
[40]张慧娟,刘云根,侯磊,等.典型出境河流生态修复区沉积物重金属污染特征及生态风险评估[J].环境科学研究,2017,30(9):1415-1424.
