葡萄籽原花青素对糖尿病小鼠肾脏氧化应激的作用及对HO-1的影响
2019-09-05丁玉松冉珊珊毛磊窦璇李悦
丁玉松,冉珊珊,毛磊,窦璇,李悦
(石河子大学医学院预防医学系,新疆 石河子 832000)
糖尿病(Diabetes mellitus,DM)是一种由于胰岛素不足或机体利用胰岛素不足所引起的慢性疾病[1]。糖尿病的长期高糖高脂环境会引起机体氧化应激、抗氧化能力损伤等反应从而产生糖尿病肾病等多种严重并发症[2]。在I型糖尿病并发症中,糖尿病肾病对机体的危害位于第一。在II型糖尿病中仅次于心、脑血管的影响[3]。
葡萄籽原花青素(Grape seed proanthocyanidinsextract, GSPE)是葡萄籽内一种富含多酚类的提取物,具有清除自由基、提高抗氧化能力、调节血糖血脂的作用[4-6]。近年来,糖尿病在低收入国家患病率增长速度超过高收入国家,本研究就GSPE对小鼠糖尿病肾脏氧化应激的作用进行实验研究,拟为糖尿病肾病的防治寻找价格适中、效果明显的保健品及药品提供实验依据,探讨HO-1在糖尿病发展中的作用以及GSPE是否对HO-1的表达产生影响。
1 材料与方法
1.1 实验动物
90只健康的ICR雄性小鼠,体重(25±2) g。小鼠饲料为标准饲料。
1.2 实验仪器与试剂
实验仪器:卓越精采型-NC罗氏血糖仪(上海罗氏诊断产品有限公司),FA1604电子精密天平(上海浦春计量仪器有限公司),X-mark酶标仪(北京市永光明医疗仪器厂),HH.W21.600型恒温水浴箱(美国 Bio-Rad公司),TG16G高速离心机(新发现科技有限公司),手动玻璃匀浆器(上海垒固生物工程公司),葡萄籽提取物(纯度95.0%,上海化学试剂公司),超氧化物歧化酶、谷胱甘肽过氧化物酶、丙二醛检测试剂盒(上海陆恒生物工程研究所),谷胱甘肽、血红素加氧酶-1检测试剂盒(南京建成生物工程研究所),四氧嘧啶(上海化学试剂公司)。
1.3 糖尿病大鼠模型的建立与分组
取90只健康ICR小鼠,随机选择60只为造模组。剩余30只随机分为正常对照组(正常组、正常+低浓度GSPE组和正常+高浓度GSPE组)。造模组小鼠禁食12 h后,腹腔注射200 mg/kg四氧嘧啶,24 h后采血测血糖,随机血糖>11.0 mmol/L的小鼠为糖尿病成功模型。最终30只进入模型组,并将其按体重随机分为3组(DM组、DM+低浓度GSPE组和DM+高浓度GSPE组)。
1.4 给药剂量及处理
每天同一时间灌胃给药1次,连续6周。根据小鼠体重,给予正常对照组100 mg/kg生理盐水20 mg/kg,给予正常+低浓度GSPE组100 mg/kg GSPE20 mg/kg,给予正常+高浓度GSPE组400 mg/kg GSPE 20 mg/kg,给予DM组100 mg/kg生理盐水20 mg/kg,给予DM+低浓度GSPE组100 mg/kg GSPE 20 mg/kg,给予DM+高浓度GSPE组400 mg/kg GSPE 20 mg/kg。实验中,记录每天饮水量,每周测量1次体重和1次血糖。灌胃6周后处死动物,眼眶取血,将血液3 500 r/min,4 ℃离心15 min,随后取血清,-20 ℃保存备用;同时,制备肾脏匀浆取肝组织入液氮速冻。
1.5 检测指标及测定方法
1.5.1 生化指标检测
每周测1次血糖,试验结束后,取小鼠血清。按照说明测量甘油三酯(TG)、总胆固醇(TC)、尿素氮(BUN)、肌酐(Cre)。
1.5.2 氧化损伤指标检测
容量法检测过氧化氢酶(CAT)活性。按试剂盒说明检测丙二醛(MDA)的含量。用ELISA法检测血红素加氧酶-1(HO-1)的含量。
1.5.3 抗氧化指标检测
用黄嘌呤-黄嘌呤氧化酶-亚硝酸盐法检测超氧化物歧化酶(SOD)活性。用DNTB比色法检测谷胱甘肽过氧化物酶(GSH-Px)活性。用Beutler改良法检测谷胱甘肽(GSH)含量。用用ELISA法检测血红素加氧酶-1(HO-1)的含量。
1.6 统计学分析
各组试验数据均满足正态分布以进行描述。应用SPSS20.0软件分析数据,组间差异分析用F检验和LSD检验。P<0.05表明差异有统计学意义。
2 结果
2.1 一般情况
实验过程中,正常组小鼠一般情况正常、毛发光亮、动作敏捷,糖尿病组小鼠一般情况欠佳,出现反应迟钝、血糖含量变高、饮水量增多、体重增长缓慢、毛发粗糙等症状,GSPE干预的DM小鼠与DM小鼠组相比情况不同程度缓解。
各实验组小鼠体重如图1所示,第1~3周各组小鼠体重增长无显著差异(P>0.05),第4周开始模型组中DM组与GSPE干预组小鼠体重增长缓慢,体重均低于正常对照组(P<0.001),GSPE干预各组与DM组相比体重较高(P<0.05)。
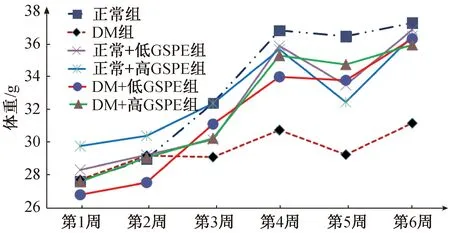
图1 GSPE干预对实验小鼠体重的影响Fig.1 Effects of GSPE intervention on weight in exper imental mice
GSPE干预对实验血糖的影响(图2),1~4周时,与正常对照组比较,模型组血糖浓度较高(P>0.001),5~6周时,模型组比正常对照组血糖高(P<0.001),模型组内GSPE干预组与DM组相比血糖较低(P<0.001),GSPE对正常组影响无差异(P>0.05)。

图2 GSPE干预对实验小鼠血糖的影响Fig.2 Effects of GSPE intervention on blood glucose in exper imental mice
2.2 GSPE干预对实验小鼠TG、TC的影响
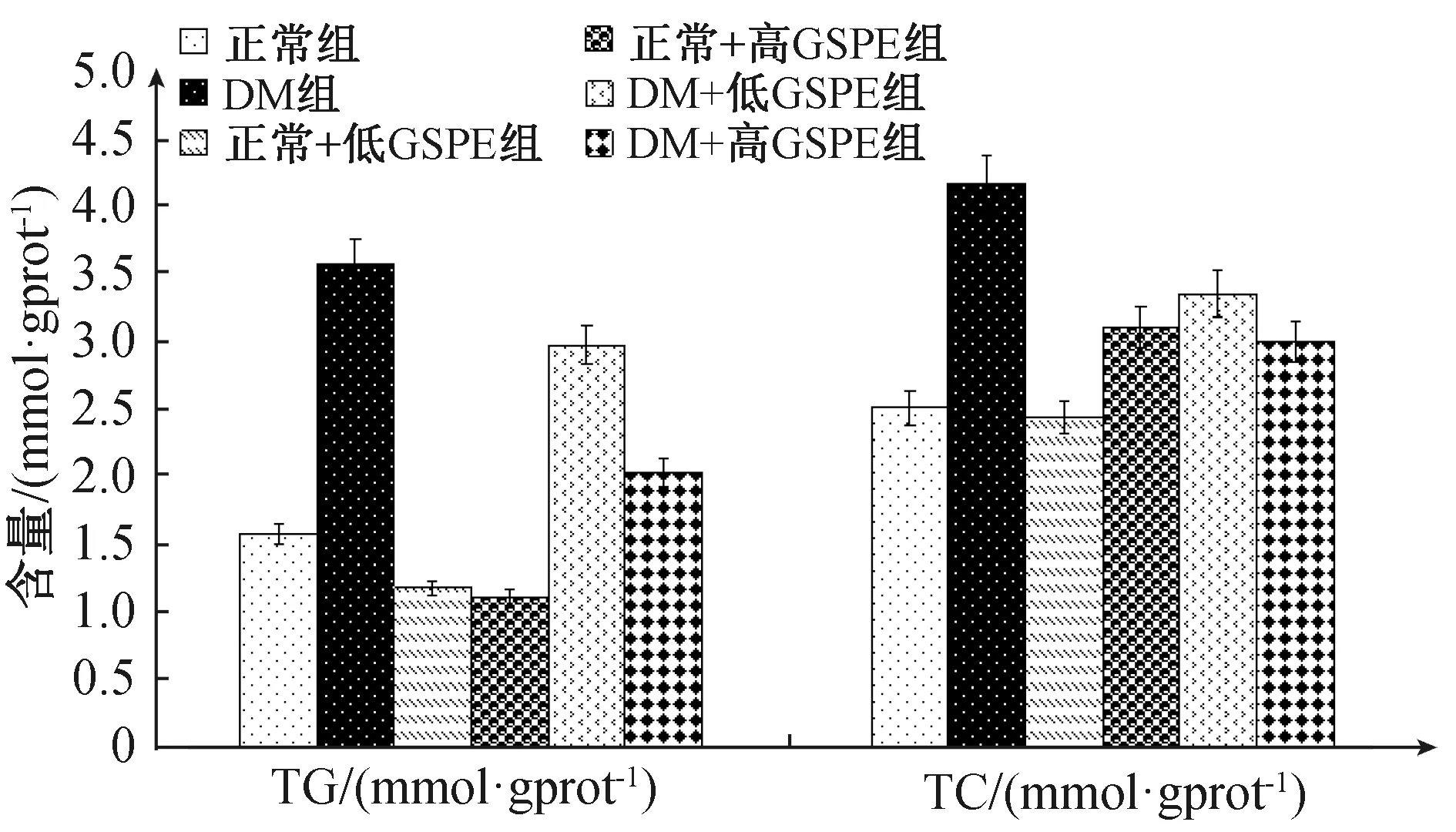
图3 6周后各组实验小鼠总胆固醇、甘油三酯含量Fig.3 Total cholesterol and triglyceride content in each group after 6 weeks
不同组小鼠之间TG与TC存在差异(FTG=37.01,P<0.05;FTC=10.64,P<0.05)。
与正常对照组比较,模型组各组小鼠的TG和TC有所增高(P<0.05);与DM组比较,GSPE干预的各组DM小鼠TG、TC随着GSPE浓度升高有所降低(P<0.05);GSPE对正常组TG和TC影响不明显(P>0.05),(图3)。
2.3 GSPE干预对实验小鼠肾脏功能指标的影响
不同组小鼠体内BUN与CRE存在差异(FBUN=53.13,P<0.05;FCRE=1268.85,P<0.05)。
与正常对照组小鼠比较,模型组的BUN和CRE浓度增高(P<0.05),与DM组比较,GSPE干预的各组DM小鼠BUN、CRE随着GSPE浓度升高有所下降(P<0.05);GSPE对正常组小鼠体内的BUN和CRE影响不明显(P>0.05)(表1)。
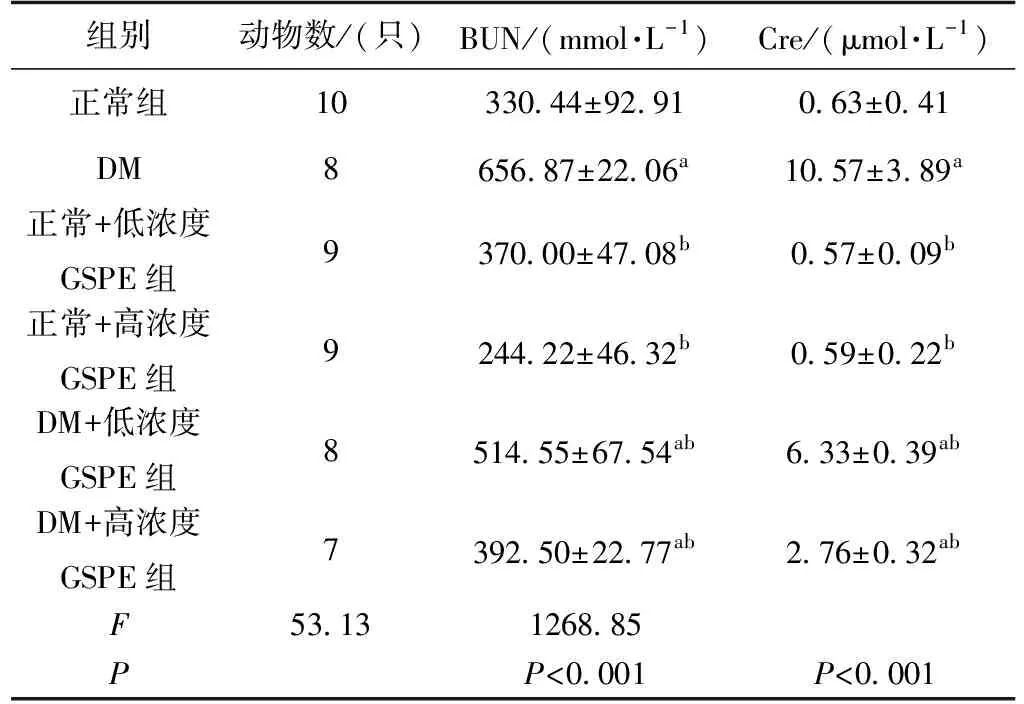
表1 GSPE干预对实验小鼠肾功的影响Tab.1 the effect of GSPE intervention on renal function in experimental mice
注:a:与正常组比较,P<0.05,b:与DM组比较,P<0.05。
2.4 GSPE干预对实验小鼠氧化损伤指标的影响
不同组实验小鼠之间MDA、SOD均存在差异(FMDA=15.40,P<0.05;FSOD=28.08,P<0.05)。
与正常对照组小鼠比较,模型组的SOD有所下降(P<0.05),MDA有所上升(P<0.05);与DM组相比较,GSPE干预的各组DM小鼠SOD随着GSPE浓度升高有所上升(P<0.05),MDA随着GSPE浓度升高有所下降(P<0.05);GSPE干预对正常组小鼠体内的MDA、SOD影响不明显(P>0.05)(表2)。
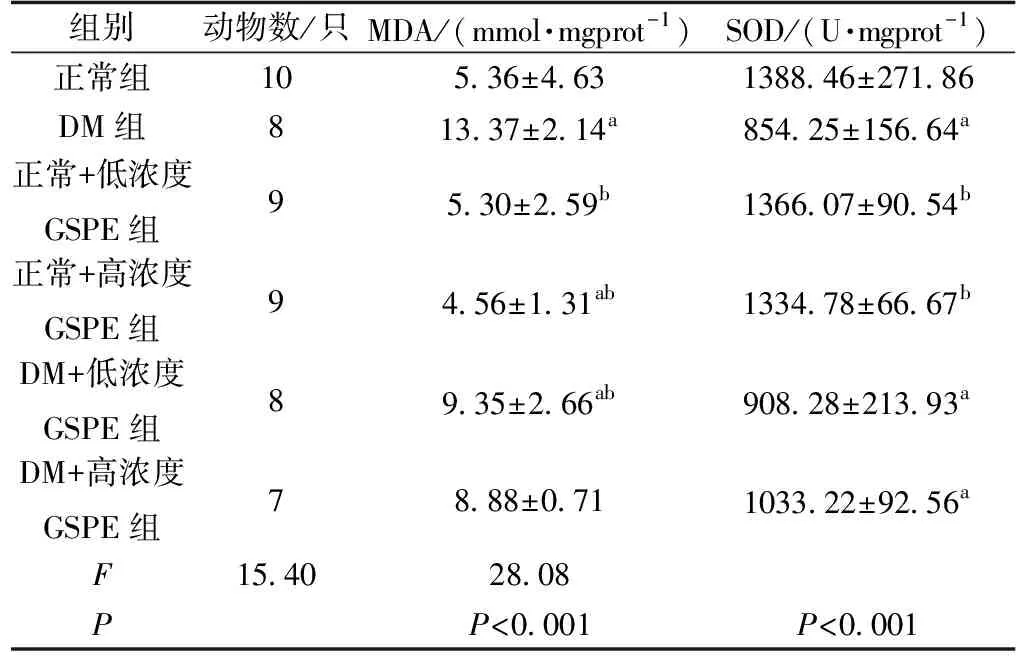
表2 GSPE干预对实验小鼠氧化损伤指标的影响Tab.2 Effect of GSPE intervention on oxidative damage index in experimental mice
注:a:与正常组比较,P<0.05;b:与DM组比较,P<0.05。
2.5 GSPE干预对实验小鼠抗氧化酶系的影响
GSPE干预对实验小鼠抗氧化酶系的影响结果见表3。

表3 GSPE干预对实验小鼠氧化抗氧化酶系的影响Tab.3 effects of GSPE intervention on antioxidant enzyme system in experimental mice
注:a:与正常组比较,P<0.05;b:与DM组比较,P<0.05。
本次实验结果表明不同组实验小鼠之间GSH-Px、GSH、CAT均存在差异(FGSH-Px=75.14,P<0.05;FGSH=27.46,P<0.05;FCAT=24.80,P<0.05);与正常组相比模型组各组的GSH-Px、GSH、CAT均有所下降(P<0.05);与DM组相比较,GSPE干预的DM小鼠的GSH-Px、GSH、CAT均随着GSPE浓度升高有所上升(P<0.05);GSPE干预对正常组小鼠体内的GSH-Px、GSH、CAT影响不明显(P>0.05)(表3)。
2.6 GSPE干预对实验小鼠HO-1的影响
不同组实验小鼠之间HO-1均存在差异(FHO-1=36.7,P<0.05);与正常组小鼠比较,模型组各组的HO-1有所下降(P<0.05);与DM组比较,GSPE干预各组HO-1随着GSPE浓度升高有所上升(P<0.05);GSPE干预对正常组小鼠体内的HO-1影响不明显(P>0.05)(表4)。
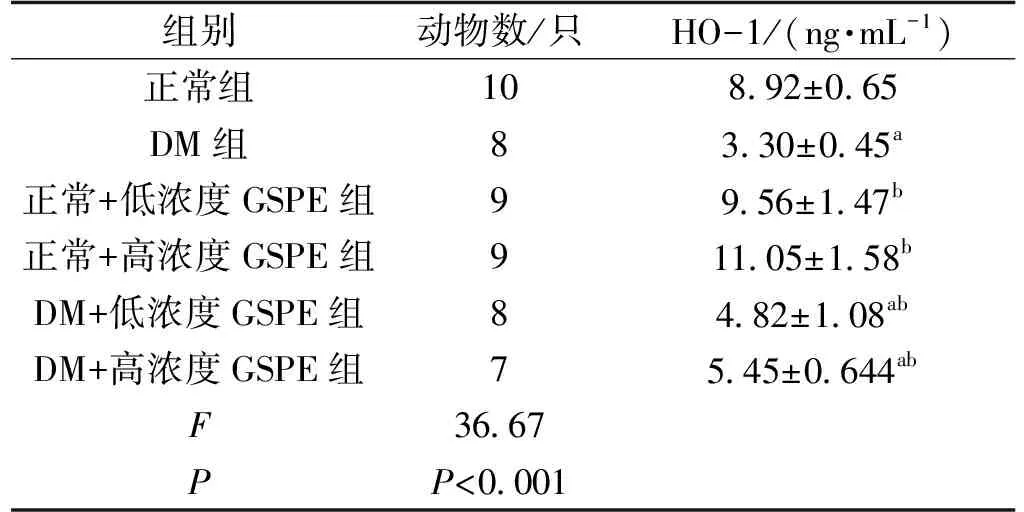
表4 GSPE干预对实验小鼠HO-1的影响Tab.4 the effect of GSPE intervention on HO-1 in experimental mice
注:a:与正常组比较,P<0.05;b:与DM组比较,P<0.05。
3 讨论
DM的发展是一个渐进过程,目前研究表明DM长期的高糖状态会引发氧化应激同时损害抗氧化系统,加速糖尿病的进一步发展[7]。肾脏是对氧化应激损害及其敏感的,过多的活性氧会促进高血糖-AngII I型受体-活性氧的产生形成恶性循环导致肾小球高压,加重肾脏损害。同时肾脏内具有诸多抗氧化酶系,过多的活性氧使抗氧化酶系发生氧化,抗氧化能力下降,从而导致肾脏细胞受损,促进糖尿病肾病的形成[8]。
同时DM高脂状态也会损害胰岛β细胞加速糖尿病进程,引起血清中TG、TC水平升高形成恶性循环,本实验表明GSPE具有降低体内血清中TG和TC水平,改善脂代谢紊乱的作用,与王俊等[9]研究结果相同。GSPE中含有大量酚羟基,所以它对过氧化自由基具有超强的清除力[10],因此GSPE可以增强其抗氧化能力,本实验也证实了GSPE能有效降低糖尿病小鼠体内脂质过氧化物MDA、BUN、Cre的含量,增加GSH-Px、GSH、CAT的浓度,改善肾脏氧化应激状态,提高小鼠抗氧化的能力,与肖俊松等[11]研究结果相同。
HO-1是血红素催化过程中的重要限速酶,也是关键的抗氧化酶。但是在DM的末期,体内HO-1的产生会受到抑制[12]。本实验结果显示,糖尿病小鼠体内HO-1含量低于GSPE干预的糖尿病组,因此GSPE具有升高DM小鼠体内HO-1浓度提高抗氧化能力的作用。Nrf-2具有诱导基因对抗氧化反应的作用[13],Niture等[14]研究表明口服GSPE可以提高组织中Nrf-2蛋白的表达,进而增强肾脏组织抗氧化能力,并且周礼华[15]等研究表明原花青素能够促进Nrf-2诱导HO-1下游基因的表达,从而可以缓解氯氰菊酯引起的氧化损伤。因此我们猜想GSPE是否能够通过Nrf-2信号通路上调HO-1的表达提高肾脏的抗氧化能力,具体机制有待进一步研究。
GSPE广泛存在于食物中,实验表明GSPE对正常机体的影响不大,无明显毒副作用,但对于糖尿病对机体血脂血糖的影响以及对肾脏引起的氧化损伤有明显作用,这暗示GSPE对糖尿病肾脏病变的发生发展可能具有潜在的防治作用,因此GSPE其对糖尿病肾病的影响着广阔的研究前景。
