肿瘤坏死因子-α通过诱导上皮间质转化促进乳头状甲状腺癌细胞的侵袭转移
2019-08-24吕男男高芸单忠艳
吕男男,高芸,单忠艳
(1. 中国医科大学附属第一医院内分泌科,内分泌研究所,沈阳 110001; 2. 沈阳市第四人民医院内分泌科,沈阳 110032)
目前,甲状腺癌已成为全球范围内患病率上升最快的实体肿瘤,美国1974至2013年间甲状腺癌发病率平均每年增加3.6%,主要与乳头状甲状腺癌的增加有关[1]。乳头状甲状腺癌通常分化良好,但伴有侵袭性生长或远处转移者5年生存率仅为40%[1-3]。研究[4-5]发现,上皮间质转化 (epithelial mesenchymal transition,EMT) 参与多种肿瘤的侵袭与转移。EMT是上皮细胞失去其极性结构获得间质细胞特性,进而改变细胞间链接状态,允许细胞运动的过程。其特征性变化为细胞连接的组分E-钙黏蛋白表达的缺失,以及间质细胞成分N-钙黏蛋白的过度表达,从而使细胞获得移动能力。促炎性细胞因子肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α),是肿瘤微环境及自身免疫性疾病中重要的炎症介质,在许多实体肿瘤及肿瘤微环境中高表达[6]。TNF-α能否促进乳头状甲状腺癌侵袭转移目前尚不清楚。因此,本研究拟通过观察TNF-α对乳头状甲状腺癌细胞系TPC-1增殖和转移的影响,探讨EMT在此过程中所发挥的作用。
1 材料与方法
1.1 材料
人 重 组TNF-α购 自 美 国Invitrogen公 司;一 抗(E-cadherin,N-cadherin,Vimentin) 购自美国Santa Cruz生物技术公司;乳头状甲状腺癌细胞株TPC-1系美国科罗拉多大学内分泌、糖尿病与代谢病科HAUGEN博士赠予;DMEM培养液和胎牛血清购自美国GIBCO公司;transwell小室购自美国Corning公司;Matrigel基质胶/基质膜及荧光一抗购自美国BD公司;Alexa Fluor 594标记荧光二抗购自美国Jackson ImmunoResearch公司。
1.2 方法
1.2.1 细胞培养及分组:将TPC-1细胞置于37℃、5%CO2培养箱中,用含10%胎牛血清及青霉素 (100 U/mL) 和链霉素 (100 μg/mL) 的高糖DMEM培养液进行培养,每24 h换液1次。待细胞呈单层贴壁生长,0.25%胰蛋白酶消化传代。将TPC-1细胞随机分为TNF-α处理组和对照组,向TNF-α处理组细胞培养液中加入终浓度为20 ng/mL的TNF-α,36 h后弃除培养液,用于后续实验;对照组则不做任何处理。
1.2.2 细胞体外迁移能力实验:消化TNF-α处理组和对照组细胞,接种至12孔板 (每组6孔),数量以贴壁后铺满板底为宜。用10 μL微量加样器垂直于孔板制造细胞划痕,尽量保证各划痕宽度一致。吸去细胞培养液,用PBS冲洗孔板3次,洗去划痕产生的细胞碎片。加入无血清培养基,拍照记录。将培养板放入培养箱内,每隔4~6 h取出拍照。实验重复3次。
1.2.3 细胞体外侵袭能力实验:用50 mg/L的Matrigel胶1∶7稀释包被transwell小室 (孔径为8.0 μm) 底部的上室面,用DMEM培养液 (不含10%胎牛血清,含1%牛血清白蛋白) 重悬细胞后制成1×105/mL的细胞悬液,按每室0.5 mL接种于transwell侵袭室的上层,继续培养36 h。取出上层的小室,去除基质膜上未侵袭转移细胞,HE染色后显微镜下随机取6个高倍 (×400) 视野,计数穿过基质胶的细胞数。实验重复3次。
1.2.4 实时PCR检测 E-cadherin, N-cadherin,Vimentin mRNA表达水平:按照Trizol试剂盒 (美国Invitrogen公司) 说明书提取细胞总RNA,应用RNA反转录试剂盒 (PrimeScriptTMRT reagent Kit,日本TaKaRa公司)将1 μg总RNA反转录为cDNA,反应体系为20 μL。E-cadherin正义引物序列为5'-TGCCCAGAAAATGA AAAAGG-3',E-cadherin反义引物序列为5'-GTGTAT GTGGCAATGCGTTC-3';N-cadherin正义引物序列为5'-GAGAACTTTGCCGTTGAAGC-3',N-cadherin反义引物序列为5'-GTGTATGTGGCAA TGCGTTC3';Vimentin正义引物序列为5'-GAGAACTTTGCCGTTG AAGC-3',Vimentin反义引物序列为5'-GCTTCCTGT AGGTGGCAATC-3';内参照GAPDH正义引物序列为5'-ACCCAGAAGAC TGTGGATGG-3',GAPDH反义引物序列为5'-TCTAGACGGCAGGTCAGGTC-3'。应用SYBR® Premix Ex TaqTM(Tli RNaseH Plus) 试剂盒 (日本TaKaRa公司),于Light cycle480实时定量PCR仪对反转录产物进行扩增。结果应用LightCycler480 1.5软件进行分析。
1.2.5 Western blotting 检测 E-cadherin、 N-cadherin、Vimentin蛋白表达水平:将处于对数生长期的TNF-α处理组和对照组细胞按1×l06/孔接种于6孔板,培养36 h后弃掉培养液,用预冷的PBS洗2次,蛋白裂解液冰上裂解细胞30 min,提取蛋白,BCA法蛋白定量。按每孔50 μg蛋白上样,SDS-聚丙烯酰胺凝胶电泳分离,80 mV恒压转膜1~3 h,5%脱脂奶粉封闭l h。加入一抗 (1∶750),4 ℃摇床过夜。漂洗后加入碱磷酸酶标记的二抗 (1∶5 000),孵育1 h。化学发光,显影,压片,灰度扫描。
1.2.6 细胞免疫荧光:在铺有细胞爬片的6孔板中培养细胞,培养液中加入终浓度为20 ng/mL的TNF-α处理36 h,待细胞生长融合至95%~100%时,弃除培养液。4%多聚甲醛冰上固定20 min,0.1%TritonX-100覆盖细胞,室温静置5 min,加入1%牛血清白蛋白稀释的一抗 (E-cadherin 1∶200稀释,N-cadherin 1∶200稀释,Vimentin 1∶50稀释),4 ℃孵育过夜,洗涤,加入PBS稀释荧光二抗 (1∶400),室温避光孵育60 min,DAPI覆盖细胞表面,室温避光静置2 min,封片,4 ℃避光保存备用。
1.3 统计学分析
2 结果
2.1 TNF-α处理后乳头状甲状腺癌TPC-1细胞迁移能力变化
TNF-α (20 ng/mL) 作用36 h后行细胞划痕实验,结果显示,经过24 h爬行,TNF-α处理组TPC-1细胞迁移能力与对照组相比提高了约2倍 (P < 0.01),见图1。

图1 TNF-α对TPC-1细胞迁移能力的影响Fig.1 Effect of TNF-α on migration of TPC-1 cells
2.2 TNF-α处理后乳头状甲状腺癌TPC-1细胞侵袭转移能力的变化
transwell侵袭实验结果显示,TNF-α处理组细胞的侵袭能力较对照组显著提高,差异有统计学意义(P < 0.01)。见图2。
2.3 TNF-α对TPC-1细胞EMT标志物mRNA表达

图2 TNF-α对TPC-1细胞侵袭能力的影响 HE染色×200 Fig.2 Effect of TNF-α on invasion of TPC-1 cells HE×200
水平的影响
实时PCR结果显示,TNF-α处理后,EMT上皮标志物E-cadherin mRNA表达水平较对照组下降(P < 0.01),TNF-α处理12 h时其表达水平约下降至60%~70%;间质标志物N-cadherin和Vimentin mRNA表达水平升高 (P < 0.01),N-cadherin表达最高增加约2倍,而Vimentin表达上调并不明显。见图3。
2.4 TNF-α对TPC-1细胞EMT标志物蛋白表达水平的影响
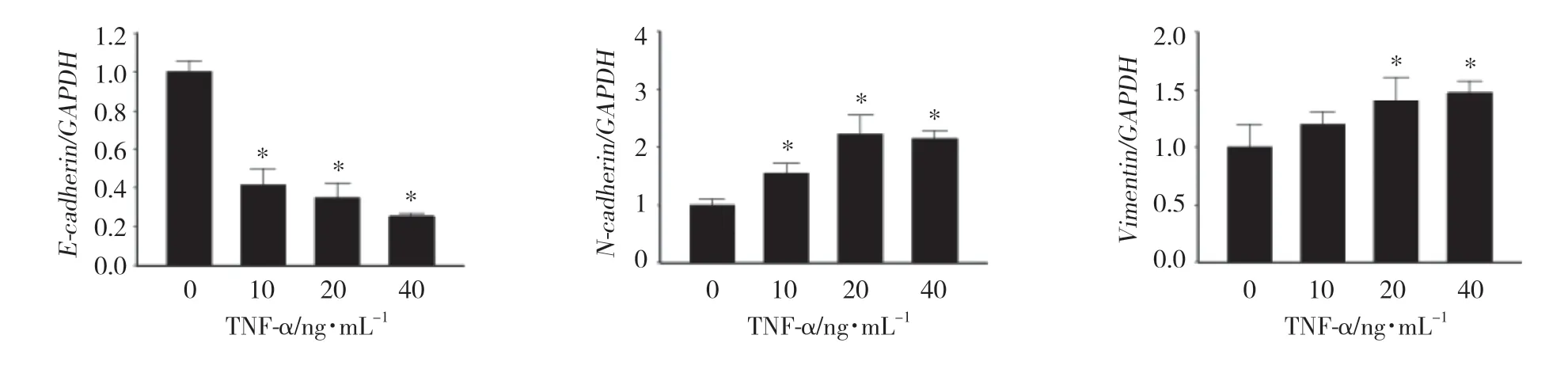
图3 TNF-α对TPC-1细胞EMT标志物mRNA表达的影响Fig.3 Effect of TNF-α on the mRNA expression of EMT marker in TPC-1 cells
Western blotting结果显示,不同浓度TNF-α作用36 h后,TPC-1细胞中E-cadherin蛋白表达水平下调,N-cadherin蛋白表达水平上调。E-cadherin在TNF-α浓度为10 ng/mL时下调幅度最小,约下调10%,20 ng/mL、40 ng/mL分别下调约55%和59%。不同浓度 (10、20、40 ng/mL) TNF-α作用下,N-cadherin上调幅度依次为
1.24、2.26、1.57倍,Vimentin上调幅度依次为1.02、2.12、1.20倍。如图4所示, 20 ng/mL、 40 ng/mL 浓度 TNF-α处理的细胞与对照组相比,差异有统计学意义 (P <0.01)。
2.5 TNF-α处理后TPC-1细胞EMT标志物定位

图4 TNF-α对TPC-1细胞EMT标志物蛋白表达水平的影响Fig.4 Effect of TNF-α on the protein expression of EMT marker in TPC-1 cells
细胞免疫荧光结果显示,浓度20 ng/mL TNF-α处理36 h后,TPC-1细胞中N-cadherin主要定位于细胞膜,而E-cadherin和Vimentin主要定位于细胞质,且E-cadherin表达量减少,N-cadherin和Vimentin表达量增加,与Western blotting结果一致。见图5。
3 讨论
EMT是上皮细胞在某些因素的作用下,失去极性及细胞间紧密连接和黏附连接,获得了浸润性和游走迁移能力,变成具备间质细胞形态和特性的细胞的改变,与肿瘤的转移密切相关。而转移不仅涉及细胞自身的变化,还和肿瘤微环境息息相关。肿瘤细胞和(或)肿瘤相关免疫细胞及炎症细胞都可产生细胞因子,而这些细胞因子可对肿瘤的转移起直接作用[7-8]。细胞因子TNF-α作为一种重要的炎症介质,在炎症、免疫细胞的激活、细胞内稳态、肿瘤进展等方面都发挥着重要作用。临床上,与健康人相比,癌前病变和恶性肿瘤患者通常会出现TNF-α血清浓度和组织表达水平升高[9]。事实上,已有研究发现人类甲状腺组织可表达编码炎症蛋白 的 基 因,如CXCR4,CD44,OPN,CXCL1,CXCL10和SDF-1。甲状腺肿瘤中激活的原癌基因,如RET/PTC,RAS和BRAF,可以启动MAPK级联反应,进而促进细胞自发的促炎症转化。一些细胞因子、趋化因子以及它们的受体表达随之升高,这其中也包括TNF-α[10-11]。通 过SMAD,NF-κB,AKT/GSK-3β,JAK/STAT等信号通路,长期持续的小剂量TNF-α刺激也可诱导其它肿瘤的侵袭和转移[12-13]。

图5 TNF-α处理后EMT标志物蛋白定位情况 细胞免疫荧光染色 ×200
本研究观察了促炎性细胞因子TNF-α对乳头状甲状腺癌TPC-1细胞侵袭转移能力的影响。结果发现,TNF-α不仅增强了TPC-1细胞的迁移和侵袭能力,而且在此过程中出现了EMT的标志性变化,即E-cadherin表达下调,N-cadherin和Vimentin表达上调。未经处理的TPC-1细胞中,E-cadherin呈高表达。LIU等[14]的研究表明,E-cadherin表达于分化良好的甲状腺癌,如乳头状甲状腺癌和滤泡状甲状腺癌中,而在未分化甲状腺癌中则无表达,与本研究结果一致。JENSEN等[15]的研究显示,在TNF-α刺激下,未分化甲状腺癌细胞株WRO中E-cadherin表达下调,而除去TNF-α则使E-cadherin的表达恢复。ROCHA等[16]报道分化良好的甲状腺癌中E-cadherin的下调与不良预后相关。
本研究还观察了另外2个经典的EMT间质标志物N-cadherin和Vimentin的表达情况,二者的mRNA和蛋白表达水平均在TNF-α刺激后呈现一定程度的上调,但Vimentin的上调幅度较小。E-cadherin的缺失和N-cadherin的增加被称为“钙黏蛋白开关”,并在多种实体肿瘤中代表着EMT的发生[17]。Vimentin是EMT的重要调控因子,同时也在乳头状甲状腺腺癌的EMT中发挥关键作用,它可以独立诱导EMT[18]。以上研究结果为Vimentin参与乳头状甲状腺癌的恶性进展提供了直接依据。
综上所述,TNF-α能够在人乳头状甲状腺癌细胞株TPC-1中诱导EMT,并增强人乳头状甲状腺癌的侵袭转移能力。
