高糖环境下成骨细胞通过MCP-1/c-fos/NFATC1通路促进破骨细胞分化
2019-08-24孙骏张磊赵威马洪冬王新栋李海天杨茂伟
孙骏,张磊,赵威,马洪冬,王新栋,李海天,杨茂伟
(1. 中国医科大学附属第一医院骨科,沈阳 110001; 2. 锦州医科大学附属第三医院手足外科,辽宁 锦州 121000)
近年来糖尿病发病率日益升高,对人类的健康产生了严重的威胁。糖尿病可以导致多种并发症,如心血管疾病、神经疾病等,特别是糖尿病导致的糖尿病性骨质疏松,极易出现致残甚至致死的严重后果,带来严重的经济及社会负担[1]。成骨细胞、破骨细胞作为人体内骨代谢系统的重要组成部分,在骨稳态的维持中起到关键作用。已有大量的研究[2-3]证实高糖对于成骨细胞具有抑制作用,然而关于高糖对破骨细胞的作用目前仍然存在争议。有研究[5]表明,高糖降低破骨细胞的分化和功能,但还有研究[6]观察到相反的结果。2种细胞在体内并不是单独存在的,已有研究[7]证实二者间存在多种交流途径,可以相互调控。还有研究[8]证实,成骨细胞可以分泌多种细胞因子,促进破骨细胞的形成。其中单核细胞趋化蛋白-1 (monocyte chemoattractant protein-1,MCP-1) 对破骨细胞的分化、形成至关重要,MCP-1可以加速破骨细胞前体细胞的募集,并促进破骨细胞的分化、成熟,从而发挥骨吸收功能[9]。破骨细胞的分化成熟是一个复杂的调控过程,c-fos/NFATC1通路在此过程中发挥关键作用,c-fos、NFATC1任一缺失将导致破骨细胞前体细胞无法分化为成熟的破骨细胞[10]。本研究旨在证实高糖环境下共培养体系中成骨细胞对破骨细胞分化的影响,并探究MCP-1/c-fos/NFATC1信号通路在破骨细胞分化中的作用。
1 材料与方法
1.1 细胞培养及相关试剂
小鼠成骨样细胞株MC3T3-E1及小鼠单核细胞株Raw264.7购自中国科学院细胞库,分别用含10%胎牛血清的α-MEM、DMEM HG培养基 (美国 Hyclone公司)培养,培养基内加入1%青链霉素 (美国Invitrogen公司),置于37 ℃、5%CO2培养箱中培养,每2 d换液1次。核因子-κB受体活化因子配体 (receptor activator of nuclear factor-κB ligand,RANKL)、巨噬细胞集落刺激因子、小鼠MCP-1 ELISA试剂盒购自美国R&D公司;Bindarit (MCP-1抑制剂) 购自美国MCE公司;抗MCP-1抗体购自美国CST公司;抗c-fos抗体、抗NFATC1抗体购自英国Abcam公司。
1.2 方法
1.2.1 共培养体系的构建以及高糖环境的加载:应用膜孔径为0.4 μm的6孔Transwell共培养系统(美国Corning公司) 构建共培养体系。简而言之,MC3T3-E1细胞密度15 000/cm2,接种于Transwell共培养系统下层。Raw264.7细胞密度3 000/cm2,接种于上层小室。此系统应用α-MEM培养基 (培养基基础糖浓度5.5 mmol/L),补充以10%胎牛血清,1%青链霉素,并加入50 ng/mL RANKL和30 ng/mL巨噬细胞集落刺激因子。为了探究高糖环境对共培养体系的影响,分别设置正常组 (糖浓度5.5 mmol/L)、高糖组(糖浓度20.5 mmol/L) 以及高糖 (糖浓度20.5 mmol/L) +Bindarit (10 ng/mL) 组,共培养4 d后检测相关指标。
1.2.2 成骨细胞MCP-1分泌测定:培养后,提取各组培养基上清液,离心去除残留细胞。应用小鼠MCP-1试剂盒检测上清液中MCP-1含量。具体步骤按照制造商方案进行。
1.2.3 TRAP染色测定:培养后,破骨细胞用4%多聚甲醛固定20 min,并根据试剂盒 (美国Sigma-Aldrich公司) 说明进行染色。含有3个或更多个细胞核的暗红细胞计为TRAP+多核细胞。
1.2.4 Western blotting检测:处理后,4 ℃下在细胞中加入含有蛋白酶和磷酸酶抑制的裂解缓冲液裂解30 min,随后在4 ℃下以12 000 g离心30 min后收集含有总蛋白质的上清液。总蛋白提取后,用BCA法测定蛋白质浓度,通过12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离样品 (50 μg蛋白质),并在60 V下转移到聚偏二氟乙烯膜上2 h。用含有5%脱脂乳的封闭缓冲液封闭膜2 h。然后在4 ℃以1∶100至1∶1 000稀释的一抗孵育过夜。随后,将膜与二抗 (抗小鼠或抗兔) 一起温育。IgG以1∶6 000或1∶10 000稀释并与辣根过氧化物酶偶联,在室温下孵育2 h。用EC3成像系统 (美国UVP公司) 显现条带,使用ImageJ软件测量每个条带的光密度与内参蛋白β-actin的比值。
1.3 统计学分析
2 结果
2.1 高糖环境促进成骨细胞MCP-1的表达与分泌
为了探究高糖环境对成骨细胞-破骨细胞共培养系统中成骨细胞MCP-1表达与分泌的影响,检测成骨细胞MCP-1的表达。结果 (图1A) 显示,与正常组相比,高糖组中成骨细胞的MCP-1表达明显升高。随后检测了MCP-1在本系统培养基上清中的含量。结果 (图1B) 显示,与正常组相比,高糖组培养基上清MCP-1的含量同样明显增加。这些结果表明,高糖环境促进了成骨细胞-破骨细胞共培养系统中成骨细胞MCP-1的表达与分泌。
2.2 MCP-1激活c-fos/NFATC1信号通路促进破骨细胞的分化形成
为了探讨MCP-1/c-fos/NFATC1信号通路对破骨细胞分化的影响,首先检测破骨细胞分化形成指标TRAP染色。结果 (图2A) 显示,与正常组相比,高糖组中TRAP+细胞数量明显增多,而高糖+Bindarit组TRAP+细胞数量显著减少。接下分别检测各组破骨细胞c-fos、NFATC1蛋白的表达。结果 (图2B) 显示,与正常组相比,高糖组中的破骨细胞c-fos、NFATC1的表达明显升高,而高糖+Bindarit组中破骨细胞c-fos、NFATC1的表达明显降低。这些结果表明,高糖环境下成骨细胞可以通过MCP-1/c-fos/NFATC1信号通路调节破骨细胞的分化形成。
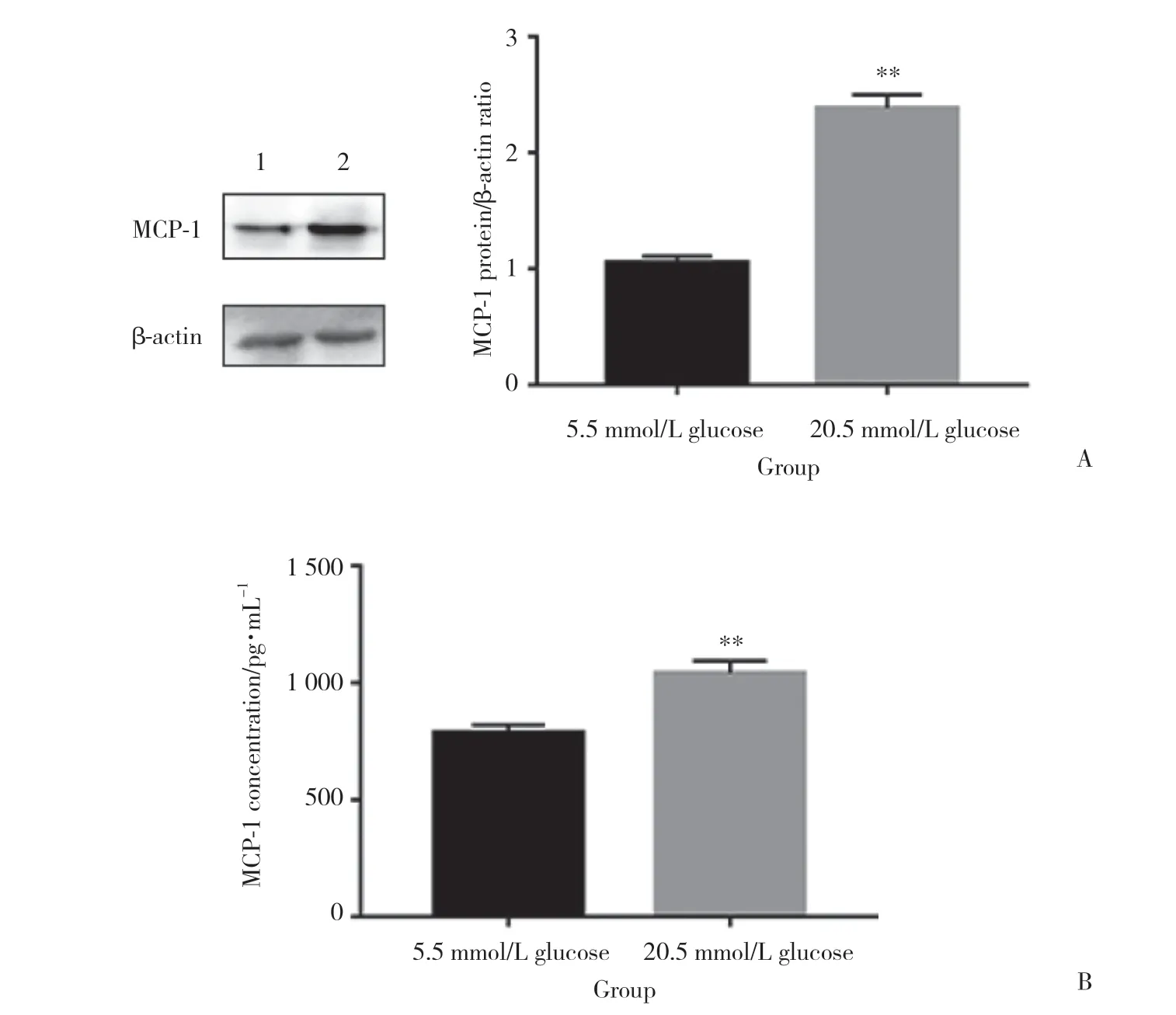
图1 高糖促进成骨细胞MCP-1的表达与分泌Fig.1 High glucose increases the expression and secretion of MCP-1 in osteoblasts
3 讨论
糖尿病性骨质疏松严重影响人类的健康,病理性的葡萄糖水平可以打破骨形成与骨吸收之间的平衡,造成骨质疏松的发生。本课题组前期研究[3-4]发现,糖尿病动物模型中存在严重的骨质疏松,并且体外细胞实验发现高糖对成骨细胞表现为抑制作用。
目前的研究多数局限于高糖对于单独的成骨细胞或破骨细胞的作用,然而在体内,成骨细胞与破骨细胞并非单独存在,关于高糖情况下二者之间是否存在相互作用仍然知之甚少。此外,现有研究对于高糖对破骨细胞的作用仍存在大量争议。已有研究[8]证实,作为高度发达的终末细胞,旁分泌途径是成骨细胞与破骨细胞之间交流的重要途径之一。因此,应用成骨细胞-破骨细胞共培养体系作为模型能够更好的反映生物体内的环境,更有利于探究其中的复杂机制。

图2 MCP-1/c-fos/NFATC1信号通路参与调控破骨细胞的分化Fig.2 MCP-1/c-fos/NFATC1 pathway is involved in osteoclastogenesis
Transwell共培养系统是目前比较成熟且应用广泛的一个系统,是探究2种细胞间相互作用的极佳方式。在本系统中,2种细胞在共同的环境中生长而不相互接触,而细胞分泌的细胞因子在上清液中可以自由交换。本研究采用了透光度良好的、孔径为0.4 μm的PET膜6孔Transwell系统,既往研究[17]证实了该系统中成骨细胞具备相应的活性,并能使破骨细胞前体细胞分化为成熟的破骨细胞并具备骨吸收功能。
MCP-1是一种趋化因子,能大量募集单核细胞并促进单核细胞的融合。有研究[11]显示,关节置换术后假体松动的患者呈现MCP-1阳性,因此MCP-1可能与破骨细胞的形成密切相关。为了进一步明确高糖环境下成骨细胞对破骨细胞分化的影响,本研究首先分析了高糖环境下共培养体系中成骨细胞分泌MCP-1的变化。结果显示,高糖显著促进成骨细胞的MCP-1分泌。有趣的是,本研究发现,高糖环境下单独培养成骨细胞时,上清中MCP-1含量很低,甚至无法测出。这似乎是由于共培养系统中破骨细胞对成骨细胞的分泌同样有重要的调控作用 (数据未显示)。这也表明了共培养系统能够较好的反映体内真实环境。Bindarit能够抑制MCP-1,可以有效的降低培养基中MCP-1的含量[12]。而在本系统内加入Bindarit后,破骨细胞的分化水平显著下降。这些结果提示,成骨细胞可以通过MCP-1的分泌来调控破骨细胞的分化形成。
c-fos/NFATC1信号通路的激活对破骨细胞分化至关重要。研究显示,破骨细胞形成是由MAPK(p38、JNK和ERK) 和NF-κB途径严格调节的多步骤过程,在此过程中诱导c-fos和NFATC1的表达,在破骨细胞分化的过程中这些途径的消除会严重降低破骨细胞的形成和骨吸收功能。还有研究[13-15]表明,c-fos敲除小鼠出现完全缺乏破骨细胞的表型。鉴于此信号通路对破骨细胞分化的关键作用,本研究探究了MCP-1对此信号通路的影响,结果证明了MCP-1能显著促进共培养体系中破骨细胞的分化,而应用Bindarit后c-fos、NFATC1的表达也随之降低,TRAP+细胞数量下调。
总而言之,本研究结果表明,高糖促进成骨细胞-破骨细胞共培养体系中成骨细胞的MCP-1分泌,进而激活MCP-1/c-fos/NFATC1信号通路,促进破骨细胞的分化。这些结论为治疗糖尿病性骨质疏松提供了一些思路。然而,这个共培养模型仍存在一定的不足,其并不能完美还原生物体内骨细胞-成骨细胞-破骨细胞的接触环境。目前新出现了一种3D培养模型[16],通过植入羟基磷灰石模拟骨基质,能更精确的反映骨细胞、成骨细胞、破骨细胞三者在生物体内的真实接触情况,这将成为后续研究的方向。
