食品中氨基糖苷类抗生素快速分析方法研究进展
2019-08-20邵杰韦达理曾昆黄哲杜道林
邵杰 韦达理 曾昆 黄哲 杜道林

摘要:氨基糖苷类抗生素是一类广谱性抗生素,在临床和动物医疗中应用广泛,从而导致它在动物源性食品中广泛残留。目前,各国针对庆大霉素、卡那霉素、新霉素以及链霉素/双氢链霉素设有最高残留限量。由于检测样本数量庞大,并且检测目标物种类众多,因此对简便、快速的分析方法需求愈加强烈。以特异性抗体为基础的免疫分析方法在氨基糖苷类抗生素的快速分析中占有重要地位,同时核酸适配体被筛选出来并被引入到快速分析领域,丰富和发展了快速分析的类型。主要综述基于能够特异性识别氨基糖苷类抗生素抗体和适配体构建的快速分析方法,包括单一药物分析和多残留分析方法,以期对该领域的发展趋势和方向提供参考。
关键词:氨基糖苷类抗生素;抗体;适配体;快速分析方法;ELISA
中图分类号: TS207.3文献标志码: A
文章编号:1002-1302(2019)08-0018-07
氨基糖苷类(aminoglycosides,AGs)抗生素是一类由氨基环醇和氨基糖通过氧桥连接而成的苷类化合物,通过与细菌的沉降系数为70S核糖体的30S亚基部位结合,抑制始动复合物形成,阻碍终止因子的作用,阻碍合成的蛋白质的释放,从而抑制细菌体内的蛋白质合成,使细菌不能生长[1]。常用的AGs包括卡那霉素、新霉素、链霉素、庆大霉素、妥布霉素、小诺米星、西索米星、阿贝卡星、阿司米星和达地米星等。由于其价格低廉且抗菌效果好,在临床上广泛用于革兰氏阴性菌、单胞菌属、葡萄菌属感染和结核病等的治疗[2]。在动物医学领域,AGs主要用于防治牛乳腺炎、肠炎、子宫炎、腹膜炎、败血症等,同时还可以促进动物的生长[3]。
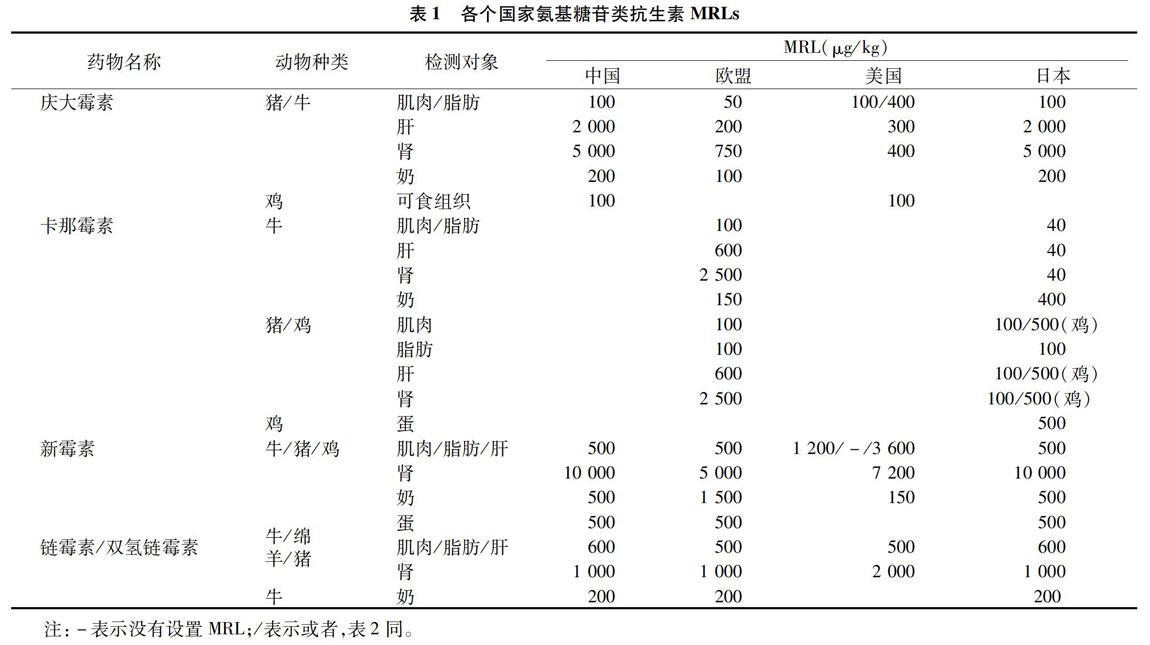
然而AGs具有较明显的肾毒性、耳毒性以及前庭神经功能损害[4],严重时还会致人休克,甚至死亡。我国农业行业标准NY 5045—2008《无公害食品生鲜牛乳》中明确规定,牛奶中“抗生素不得检出”。我国、欧盟、日本以及美国均制定了AGs的最高残留限量(maximum residue limit,MRL)(表1)。目前主要针对庆大霉素、卡那霉素、新霉素以及链霉素/双氢链霉素(表示2种霉素总量,下文同)设有MRLs,具体结构见图1。
鉴于AGs在动物性食品中的广泛残留,对人体和环境造成的巨大危害,发展简便、快速、灵敏的检测方法显得十分重要。仪器分析方法,如高效液相色谱(HPLC)、液相色谱-质谱联用(LC-MS)[8-9]方法,具有较高的灵敏度和准确性,但是仪器昂贵并且前处理复杂,使仪器分析方法在快速分析领域并不占优势。近年来,随着生物技术的发展,基于特异性生物识别元件,如抗体和核酸适配体,构建一系列快速、灵敏的分析方法,并在方法中結合新型纳米材料、荧光信号等,极大地提高了检测的灵敏度,缩短了检测时间。其中抗体制备通常来自于免疫动物以及杂交瘤技术,由于AGs属于小分子半抗原,无法单独刺激机体产生相应的抗体,因此须要对抗原进行设计和改造,要获得高灵敏度的抗体有一定难度。核酸适配体是一小段单链DNA或RNA序列,通过指数富集的配基系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)技术筛选得到[10]。与传统的抗体相比,核酸适配体不仅选择性专一,且具有体外合成周期短、性质稳定、易于修饰和保存、靶标分子种类多等优势。本研究主要综述了基于抗体和适配体的快速分析方法在庆大霉素、卡那霉素、新霉素以及链霉素/双氢链霉素4种AGs快速检测中的应用,旨在为该领域的发展趋势和方向提供参考。
1庆大霉素快速分析方法
1.1基于抗体的免疫分析方法
酶联免疫分析方法(ELISA)是最常见,也是较早建立的免疫分析方法。职爱民等制备了庆大霉素抗体,并建立了间接竞争ELISA,检测限可达0.1 ng/mL[11-14]。郭浩等建立了庆大霉素兽药残留的悬液芯片直接竞争检测法,并同时与常规酶联免疫分析方法进行比较,二者的检测限分别为010、0.27 ng/mL[15]。
可视化检测可以避免使用大型仪器,在现场检测中极具优势,结合纳米金、纳米银、碳纳米管等新型纳米材料极大地拓展了分析方法的类型。王丽哲等研制了庆大霉素半定量胶体金试纸条,对牛奶样品的检测限为20 μg/kg[16]。Jin等建立了免疫层析方法定量和定性检测庆大霉素,检测限为 6 ng/mL[13]。李周敏等采用纳米银标记的二抗(羊抗鼠)及银增强显色剂,建立可视化蛋白芯片检测牛奶中的庆大霉素,经数据分析,该方法庆大霉素的线性检测范围为0.1~200.0 ng/mL,检测限为0.1 ng/mL[17]。笔者所在研究小组获得了一株高灵敏度的庆大霉素单克隆抗体, 并建立了基于碳纳米管的离心定量方法和过滤定性方法,其中前者的检测限为0.048 ng/mL,线性范围为0.080~0.512 ng/mL,后者的检测限为0.1 ng/mL[18]。
除了常规的IgG抗体外,Li等免疫鸡获得了针对庆大霉素的IgY抗体,并建立了荧光偏振免疫分析法(fluorescence polarization immunoassay,FPIA),方法的检测限为 0.17 μg/mL[19]。
1.2基于适配体的分析方法
关于庆大霉素适配体的报道较少,Wang等筛选到了特异性识别氨基糖苷类药物的RNA,对妥布霉素、新霉素B、庆大霉素、红霉素的解离常数分别为0.77 nmol/L、1.03 μmol/L、[JP+1]7.81 μmol/L、9.23 μmol/L[20];Rowe等利用RNA适配体,建立了电化学分析方法检测血液样品中的卡那霉素、妥布霉素和庆大霉素,检测范围在4~10 μg/mL[21]。上述研究主要分析人血液中的药物浓度,所建立的方法灵敏度较低,目前对于食品中的基于适配体的庆大霉素的分析方法鲜有报道。
2卡那霉素快速分析方法
2.1基于抗体的免疫分析方法
He等选用碳二亚胺法合成免疫原免疫鸡,经5次免疫后获得IgY型抗体,应用此抗体建立了间接竞争ELISA检测食品中卡那霉素的方法,该方法的IC50(half maximal inhibitory concentration,半抑制浓度)为4.48 ng/mL,回收率在 82.02%~98.20%之间[22]。Li等获得了针对卡那霉素的IgY抗体,并建立了FPIA,检测限可达0.001 μg/mL[19]。徐飞等建立了牛奶中同时检测卡那霉素和庆大霉素的可視化凝胶ELISA,该方法采用的是一步法,检测耗时仅为15 min,对2种抗生素的检出限均为5 μg/L[23]。
Wei等利用石墨片-全氟磺酸/硫堇/铂修饰的玻璃碳电极建立了一个无标记的电化学免疫传感器法来检测动物源性食品中的卡那霉素,该方法具有较低的检测限(5.74 pg/mL)和较宽的检测范围(0.01~12.00 ng/mL)[24]。Yu等建立了以银杂化多孔四氧化三铁纳米材料(Ag@Fe3O4NPs)和硫堇混合石墨烯片(TH-GS)为基础的免疫传感器,并应用于检测卡那霉素,该免疫传感器中硫堇被用作电子转移媒介,Ag@Fe3O4NPs能够固定更多的卡那霉素和促进电子转移,在循环伏安法和方波伏安法作用下可以用于识别卡那霉素,检测限可达15 pg/mL[25]。
2.2基于适配体的分析方法
根据不同纳米材料的理化性质,将适配体与之结合,构建了多种比色分析方法。Wang等用酪氨酸作为还原剂和封闭剂制备了具有酶促活性的金纳米颗粒,再将金纳米颗粒与核酸适配体结合,建立了无需酶的直接电化学法来检测蜂蜜中的卡那霉素,该方法具有极高的灵敏度,检测限可达 60 pmol/L[26]。贾向阳等基于聚阳离子鱼精蛋白与带负电的核酸适配体以及金纳米粒子之间的静电作用,构建了一种新型生物纳米检测技术来检测牛奶中的卡那霉素,其线性范围是5~5 000 nmol/L,该方法的检出限为0.52 nmol/L[27]。Sharma等将具有酶活性的金纳米颗粒和卡那霉素适配体结合,建立了能够在3~8 min内快速检测出卡那霉素含量的生物传感器,该传感器检测用时短,还能高灵敏地识别卡那霉素,检测限达1.49 nmol/L[28]。Xu等应用未被修饰的银纳米颗粒作探针,卡那霉素可以保护银纳米颗粒抵抗盐离子诱导的聚沉,而卡那霉素与适配体结合后,它的保护机制被削弱,该方法可在20 min内完成对卡那霉素的测定,线性范围在 0.05~0.60 μg/mL之间[29]。Ramezani等将核酸外切酶Ⅲ、金纳米颗粒还有羧基荧光素(FAM)标记的卡那适配体互补序列等结合在一起建立了适用于检测食品中卡那霉素残留的荧光适体传感器方法。该方法对卡那霉素和庆大霉素均有很高的识别能力,且检测卡那霉素的检测限可达321 pmol/L [30]。
适配体取代抗体在传感器技术的发展中也有较多的应用。Bai等建立了一个基于适配体的悬臂阵列传感器来检测卡那霉素。该悬臂阵列由传感悬臂梁和参考悬臂梁组成,当卡那霉素和适配体结合时会引起悬臂表面压力的改变,这个表面压力的改变和卡那霉素的浓度呈一定的线性关系,因此可以达到检测卡那霉素的目的[31]。Qin等首次以硫氨酸功能化石墨烯(GR-TH)和分吸纳米孔(HNP)PtCu合金为生物传感底物,建立了一种无标记的电化学适体传感器,这一方法具有较宽的线性范围(5.00×10-7~0.05 μg/mL),检测限可达0.42 pg/mL[32]。Sun等在金电极表面依次修饰壳聚糖金纳米粒子(CS-AuNPs)、石墨烯金纳米粒子(GR-AuNPs)和多壁碳纳米管-钴酞菁(MWCNTs-CoPc)用于固化适配体,构建了一种灵敏的电化学传感器,对卡那霉素的检测限可达5.8 nmol/L [33]。
3新霉素快速分析方法
3.1基于抗体的免疫分析方法
针对新霉素的免疫分析方法开始的较晚,目前的报道以ELISA为主。刘沙洲等分别采用1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)法、戊二醛法等合成完全抗原,制备了多克隆抗体或单克隆抗体,建立了竞争性ELISA,检测限为0.1 ng/mL,对牛奶中新霉素检测限为 0.69 ng/mL[34-38]。王爱萍等应用制备的新霉素B单克隆抗体,建立了简便的免疫层析分析方法,通过肉眼判断其检测限为50 ng/mL,可用于奶样、肌肉以及饲料样本的分析[39]。
Zhu等在玻碳电极表面先修饰了纳米金颗粒,然后组装了单分子层poly-[2,5-di-(2-thienyl)-1H-pyrrole-1-(p-benzoic acid)](pDPB),通过EDC/羟基琥珀酰亚胺(NHS)将新霉素抗体1固化在电极表面,新霉素抗体2连接在标记烯丙基肼的金纳米粒子(AuNPs)/多壁碳纳米管复合材料(Hyd-MWCNT(AuNP)-Ab2)上[40]。当有新霉素存在时,Hyd-MWCNT(AuNP)-Ab2与目标物以及电极上的抗体1形成夹心结构,从而诱发电流的变化。该方法检测的线性范围为10~250 ng/mL,检测限为6.76 ng/mL[40]。
3.2基于适配体的分析方法
最早在1999年,Jiang等通过光谱和计算机模拟的方法研究了新霉素B与其天然RNA结合靶点以及体外筛选获得的RNA适配体的结合特点,发现新霉素B与RNA适配体结合的亲和力可以达到100 nmol/mL[41]。de-los-Santos-Alvarez等在金电极表面修饰了巯基丙酸(MPA)的单层,然后利用碳二亚胺将新霉素B固定在电极上。适配体与电极表面的新霉素B特异性结合,从而诱发阻抗变化,该方法的线性范围在0.75~500.00 μmol/L之间,并且具有较高的特异性,和卡那霉素、链霉素、巴龙霉素均没有交叉反应[42]。Ling等将新霉素B的RNA适配体分成2段,一段通过多聚腺苷酸尾(PolyA)吸附在纳米金表面,另一段末端标记FAM荧光基团。当样品中存在靶物质时,靶物质与这2段核酸片段在纳米金表面快速组装成紧密的H维结构,导致FAM荧光基团淬灭,因此,溶液中新霉素B的浓度与荧光值成反比。该方法检测的线性范围为0~10 μmol/L,检测限为0.01 μmol/L,并且具有较高的特异性[43]。De-Los-Santos-lvarez等构建了基于表面等离子共振(SPR)的新霉素B分析方法,它的线性检测范围为10~100 μmol/L,检测限为 5 nmol/L[44]。
4链霉素/双氢链霉素快速分析方法
4.1基于抗体的免疫分析方法
国外对链霉素免疫分析方法的研究开始得比较早,集中在20世纪90年代。早在1992年,Hammer等将链霉素偶联到细菌蛋白上免疫家兔获得多克隆抗体,并建立了牛奶中链霉素残留的间接竞争ELISA,检测限为100 ng/mL[45]。随后Schnappinger等均建立了竞争性ELISA检测食品中的链霉素/双氢链霉素[46-48],我国在2000年后才开始相关研究,并且进展迅速,秦燕等制备了链霉素抗体,建立了链霉素/双氢链霉素残留检测ELISA,检测限为0.4~30.0 ng/mL,能够满足链霉素/双氢链霉素检测标准[49-56]。
可视化分析方法在链霉素/双氢链霉素检测中也多有应用。Schnappinger等建立了一种简便的、可视化的免疫过滤方法,对奶中链霉素和双氢链霉素的检测限分别是2、5 ng/mL,样品无需任何处理,整个过程仅需10 min[57]。Ferguson等建立了生物传感免疫检测法,测定了牛奶、蜂蜜、肾脏、肌肉等多种样品中的链霉素/双氢链霉素残留,在上述样品中的检测限分别为30、15、50、70 μg/kg[58]。Verheijen等利用胶体金标记单抗,建立了快速检测牛奶中链霉素和双氢链霉素残留的方法,检测限分为160、190 ng/mL[59]。
新型标记物及新型分析方法也被引入进来。Sun等引入镧系元素标记物Eu+,建立了时间分辨免疫分析方法检测链霉素,在牛奶中的检测限达1.8 ng/mL[60]。Mishra等將链霉素抗体固化在硫醇改性金石英晶体表面,建立了电化学石英晶体纳米天平生物传感器方法检测,对牛奶样品中的检测限可达0.3 ng/mL[61]。Wutz等将待测物质分子直接固化在玻片表面,采用竞争性反应模式,用CCD(charge coupled device)图像传感器记录其化学发光值,该方法对链霉素的检测限为15.9 ng/mL,并且通过阵列的方式,可以同时检测4种抗生素[62]。Liu等将介孔二氧化硅、AuNPs、HRP以及链霉素组装成多酶标记物,在玻碳电极表面修饰一层胶体有机硅纳米复合材料,建立了电化学分析方法检测食品中的链霉素,检测限为5 pg/mL,线性范围为 0.05~50.00 ng/mL[63]。
4.2基于适配体的分析方法
利用适配体对纳米金颗粒的保护作用,构建的比色分析方法在链霉素检测中报道较多。它的原理是当没有链霉素存在时,其适配体与AuNPs结合,在高盐条件下,由于核酸的保护AuNPs不会发生聚沉;而当有链霉素存在时,其适配体与链霉素结合,不能附着在AuNPs上,在高盐条件下,AuNPs会发生聚沉,使得吸光度发生变化。Zhou等均基于此原理构建了比色分析方法,检测限分别为0.2 μmol/L、47.2 nmol/L、73.1 nmol/L[64-66]。
Zhao等利用AuNPs的拟酶催化活性建立了链霉素比色分析方法。没有链霉素存在时,其适配体与AuNPs结合,阻碍了AuNPs的拟酶活性;而当有链霉素存在时,其适配体与链霉素结合,不能附着在AuNPs上,使得AuNPs的拟酶活性得以体现,该方法对链霉素的检测限为86 nmol/L,检测线性范围为0.1~0.5 μmol/L[67]。Emranj等采用链霉素适配体建立了荧光淬灭分析方法,首先合成一段与适配体互补的序列并标记FAM(cDNA-FAM),当链霉素存在时,适配体与链霉素结合,并吸附在AuNPs表面的FAM标记的互补链上,荧光基团被AuNPs所淬灭;反之,则出现荧光信号,这种方法的检测限为47.6 nmol/L[66]。
同时基于适配体核酸的化学性质,一系列利用核酸外切酶设计的分析方法被报道。Luan等先将AuNPs和链霉素适配体共同组装在一种酶聚合物(Apt-Au-PV)上,在多空二氧化硅(SiO2)微球上修饰单链DNA结合蛋白(P-SiO2-SSB)。当没有链霉素时,Apt-Au-PV与P-SiO2-SSB结合,反应液中没有聚合酶释放出来;当链霉素存在时,链霉素与适配体结合,使得Apt-Au-PV与P-SiO2-SSB分离,并且在核酸外切酶ExoⅠ作用下,适配体被降解,链霉素被释放出来,重新进入循环,使得反应液中聚合酶越来越多,起到信号放大的作用,该方法可以检测低至1 pg/mL的链霉素[68]。Taghdisi等利用Exo Ⅲ和SYBR Gold构建了一种无标记的荧光分析方法检测牛奶和血样中的链霉素。在没有链霉素时,适配体与其互补序列结合形成双链,能够被Exo Ⅲ所降解,不能与核酸染料SYBR Gold结合;当有链霉素时,适配体与链霉素结合,与其互补序列解离形成单链,不能被Exo Ⅲ所降解,在加入SYBR Gold后会产生强烈的荧光信号,检测限可达 54.5 nmol/L[69]。Wu等构建了一种新型的“signal-on”荧光分析方法,结合有单链DNA结合蛋白的量子点作为荧光探针(QDs-SSB),没有链霉素时,适配体与QDs-SSB结合诱发量子点聚集,导致量子点荧光的自淬灭;有链霉素存在时,链霉素与适配体结合,量子点被释放出来产生荧光,同时引入核酸外切酶ExoⅠ,降解核酸,链霉素被释放出来,重新进入循环,荧光进一步增强,放大信号,该方法最低可检测 0.03 ng/mL 的链霉素[70]。Danesh等设计了一种新型的电化学传感器,当没有链霉素时,适配体和它的互补序列部分结合形成弓形结构,核酸外切酶Exo Ⅰ不能发挥作用,不能产生化学信号;当链霉素存在时,适配体与其结合,并与互补序列解离,Exo Ⅰ降解单链DNA的3′末端,并与氧化还原探针结合,优化电信号,该方法的检测限为11.4 nmol/L[71]。
5氨基糖苷类药物多残留快速分析方法
同时检测多种药物残留可以提高检测效率,缩短检测周期,成为残留分析的重要研究方向。要实现多种物质的同时检测,一般采用2种策略:一是使用能同时识别多种靶物质的识别分子;二是构建多通道分析方法,实现多种物质同时检测。
小分子物质要获得同时识别多种靶物质的抗体,半抗原的设计直接决定了所得抗体的特性。以多种靶物质的共同结构作为半抗原,是较常采用的策略。从图1可以看出,新霉胺含有2个六元环,它的空间构象与卡那霉素以及庆大霉素部分结构十分相似。Loomans等以新霉胺作为通用型半抗原,采用EDC法合成免疫原,获得可通用型的多克隆抗体,能够同时识别庆大霉素、新霉素和卡那霉素,在原奶中IC50分别为9、113、21 ng/mL[72]。王忠斌等以新霉胺作为半抗原,采用戊二醛法合成免疫原,制备出能够识别多种氨基糖苷类药物的通用型抗体,该多克隆抗体对新霉素、庆大霉素和卡那霉素的检出限分别为0.20、0.15、0.35 mg/kg[73]。也有研究者尝试用链霉素作为通用抗原,如杨建军等采用EDC法将链霉素分别与牛血清白蛋白(BSA)、鸡卵白蛋白(OVA)偶联构建完全抗原,通过杂交瘤细胞筛选,获得了一株通用型的氨基苷类抗生素抗体PamiSP20-1,可以同时识别链霉素、庆大霉素、新霉素、卡那霉素、大观霉素,相关灵敏度并没有给出[74]。Rowe等利用RNA适配体,建立了电化学分析方法检测血液样品中的卡那霉素、妥布霉素和庆大霉素,检测范围为4~10 g/mL[21]。可以看出,文献所报道的通用型识别分子尽管能够满足MRL标准,但是相对于单一药物检测来说,灵敏度降低了很多,找寻新的半抗原结构以获得灵敏度较高的通用型抗体或是筛选出更高灵敏度的广谱性适配体仍然需要继续探索。
在获得特异性识别分子的基础上,将其整合在同一分析方法中,同样可以实现多种靶物质的同时分析。Haasnoot等将庆大霉素、新霉素、卡那霉素和双氢链霉素通过氨基偶联直接固化在芯片上,采用四通道传感器Biacore 3000,实现同时检测5种氨基糖苷类抗生素。在牛奶样品中,庆大霉素、新霉素、卡那霉素、链霉素和双氢链霉素的检测限分别为 20、40、15、30、60 ng/mL[75]。Xue等以适配体序列为模板,首先设计与适配体部分互补的DNA1(cDNA1)序列,然后以cDNA1序列为模板,分别设计了与其3′端部分互补的捕获探针(Cap-DNA)序列和与其5′端部分互补的DNA2(cDNA2)序列,并在cDNA2上标记量子点。当有靶物质存在时,适配体优先与靶物质结合,cDNA1被释放出来,随后被金电极表面的 Cap-DNA 捕获,再与标记有量子点的cDNA2结合,产生电信号;当没有靶物质存在时,cDNA1没有被释放出来,随后一系列反应无法进行,不能产生电信号。同时,采用多种不同的量子点(PbS、CdS、ZnS)进行试验,该方法可以实现3种物质同时检测。优化条件后,对链霉素、氯霉素、四环素的检测限分别为10、5、20 nmol/L[76]。徐飞等在凝胶检测柱的2个检测层中填充 CN-Br活化的Sephrose 4B凝胶-羊抗鼠IgG作为固相载体,然后分别结合卡那霉素和庆大霉素的单克隆抗体与载体结合,酶标抗原和待测样本中的物质竞争性抗体通过3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-Tetramethylbenzidine)底物显色实现定性检测,检测时间仅为15 min,对庆大霉素和卡那霉素的灵敏度为2.0 μg/L,对牛奶中的检出限为 5 μg/L[23]。
6结论与展望
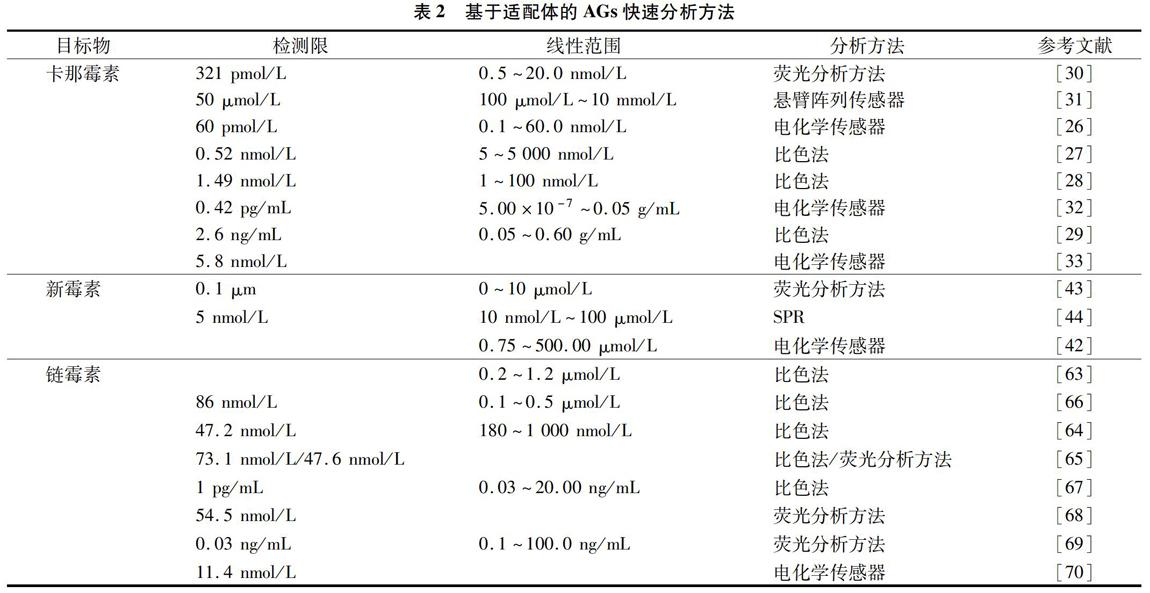
随着生产和生活水平的提高,食品安全问题被提到了一个前所未有的重视程度,食品中的药物残留是影响食品安全的重要因素。鉴于药物种类众多,样本数量庞大,基于特异性识别分子的快速检测方法成为研究的热点。基于抗体的免疫分析方法为药物残留快速检测提供了简便、快速、灵敏的技术手段,已在药物残留筛选中应用广泛,而基于适配体的分析方法则可将分子生物学技术与分析方法巧妙结合,构建出更多新型、超灵敏的检测方法(表2)。
基于上述对AGs快速分析方法的总结和综述发现:(1)由于传统抗体获得的局限性,适配体日益成为重要的生物识别分子;(2)利用适配体的理化性质,结合新型纳米材料以及电化学传感器等平台,设计并构建多种新型的、高灵敏度分析方法,灵敏度甚至可达飞克(fg,10-15 g)水平;(3)AGs多残留检测方法灵敏度尚不理想,通过设计新的半抗原获得高灵敏度的广谱性抗体或适配体还有待进一步研究,另外将高灵敏度的特异性识别分子组合在同一分析方法中,也是实现多残留检测的重要途径。
参考文献:
[1]丁大连,Salvi R. 氨基糖苷类抗生素耳毒性研究[J]. 中华耳科学杂志,2007,5(2):125-131.
[2]赵敏. 氨基糖苷类抗生素的发展现状和展望[J]. 中国抗生素杂志,1999,24(4):319-320.
[3]Shaikh B,Allen E H. Overview of physical-chemical methods for determining aminoglycoside antibiotics in tissues and fluids of food-producing animals[J]. Journal-Association of Official Analytical Chemists,1984,68(5):1007-1013.
[4]徐飞,氨基糖苷类药物残留监测筛选和驗证方法的研究[D]. 北京:中国农业大学,2014.
[5]Binns R B,Tsuji K. High-performance liquid chromatographic analysis of neomycin in petrolatum‐based ointments and in veterinary formulations[J]. Journal of Pharmaceutical Sciences,1984,73(1):69-72.[HJ1.45mm]
[6]Tsuji K,Jenkins K M. Derivatization of primary amines by 2-naphthalenesulfonyl chloride for high-performance liquid chromatographic assay of neomycin sulfate[J]. Journal of Chromatography,1986,369(1):105-115.
[7]张晓燕,徐锦忠,沈崇钰,等. 高效液相色谱柱后衍生法测定蜂王浆中的链霉素[J]. 色谱,2008,26(3):395-397.
[8]刘晓茂,赵淑军,张进杰,等. 蜂蜜中链霉素与双氢链霉素残留量的液相色谱串联质谱法测定[J]. 分析测试学报,2008,27(12):1351-1354,1358.
[9]龚强,丁利,朱绍华,等. 高效液相色谱-串联质谱法检测乳制品中10种氨基糖苷类抗生素残留[J]. 色谱,2012,30(11):1143-1147.
[10]Chen D,Yao D S,Xie C F,et al. Development of an aptasensor for electrochemical detection of tetracycline[J]. Food Control,2014,42(42):109-115.
[11]职爱民,李青梅,刘庆堂,等. 抗庆大霉素单克隆抗体的制备及其初步应用[J]. 中国农业科学,2010,43(12):2584-2589.
[12]许耀心,龚云飞,陈宗伦,等. 庆大霉素人工抗原及多克隆抗体的制备与鉴定[J]. 现代食品科技,2014,30(6):152-157.
[13]Jin Y,Jang J W,Han C H,et al. Development of ELISA and immunochromatographic assay for the detection of gentamicin[J]. Journal of Agricultural and Food Chemistry,2005,53(20):7639-7643.
[14]Chen Y Q,Shang Y H,Li X M,et al. Development of an enzyme-linked immunoassay for the detection of gentamicin in swine tissues[J]. Food Chemistry,2008,108(1):304-309.
[15]郭浩,王燕飞,邹明强,等. 悬液芯片与常规酶联免疫吸附法检测庆大霉素残留的比较[J]. 食品科学,2012,33(20):144-148.
[16]王丽哲,王丽丽,赵瑜,等. 牛奶中庆大霉素半定量胶体金试纸条的研制[J]. 中国饲料,2013(20):16-18.
[17]李周敏,许丹科. 可视化蛋白芯片检测牛奶中庆大霉素的方法研究[J]. 分析科学学报,2014,30(5):687-691.
[18]Zeng K,Wei W,Jiang L,et al. Use of carbon nanotubes as a solid support to establish quantitative (centrifugation) and qualitative (filtration) immunoassays to detect gentamicin contamination in [JP3]commercial milk[J]. J Agric Food Chem,2016,64(41):7874-7881.
[19]Li C,Zhang Y Y,Eremin S A,et al. Detection of kanamycin and gentamicin residues in animal-derived food using IgY antibody based ic-ELISA and FPIA[J]. Food Chemistry,2017,227:48-54.
[20]Wang Y,Killian J,Hamasaki K,et al. RNA molecules that specifically and stoichiometrically bind aminoglycoside antibiotics with high affinities[J]. Biochemistry,1996,35(38):12338-12346.
[21]Rowe A A,Miller E A,Plaxco K W. Reagentless measurement of aminoglycoside antibiotics in blood serum via an electrochemical,ribonucleic acid aptamer-based biosensor[J]. Analytical Chemistry,2010,82(17):7090-7095.
[22]He J X,Wang Y,Zhang X Y. Preparation of artificial antigen and development of IgY-based indirect competitive ELISA for the detection of kanamycin residues[J]. Food Analytical Methods,2016,9(3):744-751.
[23]徐飛,栗静雅,周洁,等. 可视化凝胶酶联免疫吸附分析法检测牛奶中庆大霉素和卡那霉素[J]. 分析化学,2015,43(6):881-885.
[24]Wei Q,Zhao Y F,Du B,et al. Ultrasensitive detection of kanamycin in animal derived foods by label-free electrochemical immunosensor[J]. Food Chemistry,2012,134(3):1601-1606.
[25]Yu S J,Qin W,Du B,et al. Label-free immunosensor for the detection of kanamycin using Ag@Fe3O4,nanoparticles and thionine mixed graphene sheet[J]. Biosensors & Bioelectronics,2013,48(19):224-229.
[26]Wang C S,Liu C,Luo J B,et al. Direct electrochemical detection of kanamycin based on peroxidase-like activity of gold nanoparticles[J]. Analytica Chimica Acta,2016,936:75-82.
[27]贾向阳,尤慧艳,付秀丽. 鱼精蛋白-核酸适配体-金纳米技术快速检测牛奶中的卡那霉素[J]. 色谱,2017,35(3):269-273.
[28]Sharma T K,Ramanathan R,Weerathunge P A,et al. Aptamer-mediated ‘turn-off/turn-on nanozyme activity of gold nanoparticles for kanamycin detection[J]. Chemical Communications,2014,50(10):15856-15859.
[29]Xu Y Y,Han T,Li X Q,et al. Colorimetric detection of kanamycin based on analyte-protected silver nanoparticles and aptamer-selective sensing mechanism[J]. Analytica Chimica Acta,2015,891:298-303.
[30]Ramezani M,Danesh N M,Lavaee P A,et al. A selective and sensitive fluorescent aptasensor for detection of kanamycin based on catalytic recycling activity of exonuclease III and gold nanoparticles[J]. Sensors and Actuators B-Chemical,2016,222(1):1-7.
[31]Bai X J,Hou H,Zhang B L,et al. Label-free detection of kanamycin using aptamer-based cantilever array sensor[J]. Biosensors & Bioelectronics,2014,56(18):112-116.
[32]Qin X L,Yin Y,Yu H J,et al. A novel signal amplification strategy of an electrochemical aptasensor for kanamycin,based on thionine functionalized graphene and hierarchical nanoporous PtCu[J]. Biosensors and Bioelectronics,2016,77:752-758.
[33]Sun X,Li F L,Shen G H,et al. Aptasensor based on the synergistic contributions of chitosan-gold nanoparticles,graphene-gold nanoparticles and multi-walled Carbon nanotubes-cobalt phthalocyanine nanocomposites for kanamycin detection[J]. Analyst,2014,139(1):299-308.
[34]劉沙洲,桑小雪,欧阳华学,等. 新霉素ELISA检测方法的建立[J]. 食品科学,2011,32(14):227-231.
[35]张晓剑. 新霉素单克隆抗体的制备及初步应用[D]. 扬州:扬州大学,2010.
[36]徐乃丰. 新霉素ELISA方法的建立[D]. 无锡:江南大学,2010.
[37]徐蓓. 食品中新霉素兽药残留酶联免疫检测方法研究[D]. 天津:天津科技大学,2007.
[38]Chen Y Q,Shang Y H,Wu X P,et al. Enzyme-linked immunosorbent assay for the detection of neomycin in milk:effect of hapten heterology on assay sensitivity[J]. Food and Agricultural Immunology,2007,18(2):117-128.
[39]王爱萍,李发弟,胡骁飞,等. 新霉素免疫膜层析检测方法研究[J]. 中国农业科学,2011,44(11):2387-2397.
[40]Zhu Y,Son J I,Shim Y B. Amplification strategy based on gold nanoparticle-decorated carbon nanotubes for neomycin immunosensors[J]. Biosensors & Bioelectronics,2010,26(3):1002-1008.
[41]Jiang L C,Majumdar A,Hu W D,et al. Saccharide-RNA recognition in a complex formed between neomycin B and an RNA aptamer[J]. Structure,1999,7(7):817-827.
[42]de-los-Santos-Alvarez N,Lobo-Castan M J,Miranda-Ordieres A J,et al. Modified-RNA aptamer-based sensor for competitive impedimetric assay of neomycin B[J]. Journal of the American Chemical Society,2007,129(13):3808-3809.
[43]Ling K,Jiang H Y,Zhang L L,et al. A self-assembling RNA aptamer-based nanoparticle sensor for fluorometric detection of neomycin B in milk[J]. Analytical and Bioanalytical Chemistry,2016,408(13):3593-3600.
[44]de-los-Santos-lvarez N,Lobo-Castaón M J,Miranda-Ordieres A J,et al. SPR sensing of small molecules with modified RNA aptamers:detection of neomycin B[J]. Biosensors & Bioelectronics,2009,24(8):2547-2553.
[45]Hammer P,Kirchhoff H,Hahn G. Detection of streptomycins in raw milk by an antibody-capture immunoassay[J]. Analytica Chimica Acta,1993,275(1/2):313-316.
[46]Schnappinger P,Usleber E,Martlbauer E,et al. Enzyme immunoassay for the detection of streptomycin and dihydrostreptomycin in milk[J]. Food and Agricultural Immunology,1993,5(2):67-73.
[47]Abuknesha R A,Luk C. Enzyme immunoassays for the analysis of streptomycin in milk,serum and water:development and assessment of a polyclonal antiserum and assayprocedures using novel streptomycin derivatives[J]. Analyst,2005,130(5):964-970.
[48]Heering W,Usleber E,Dietrich R,et al. Immunochemical screening for antimicrobial drug residues in commercial honey[J]. The Analyst,1998,123(12):2759-2762.
[49]秦燕,鮑伦军,朱柳明. 鸡肝中链霉素残留的2种免疫分析法[J]. 华南农业大学学报,2003,24(4):88-91.
[50]王谦. 抗链霉素单克隆抗体制备与ELISA方法的建立[D]. 北京:中国农业大学,2003.
[51]杨智洪. 分泌抗链霉素单克隆抗体杂交瘤细胞株的建立及其初步应用[D]. 郑州:河南农业大学,2005.
[52]唐娜. 牛乳中链霉素残留检测ELISA试剂盒的研制[D]. 扬州:扬州大学,2006.
[53]范国英. 链霉素残留免疫学检测技术研究[D]. 杨凌:西北农林科技大学,2007.
[54]张桂贤. 链霉素单克隆抗体的制备及其初步应用研究[D]. 重庆:西南大学,2006.
[55]Wu J X,Zhang S,Zhou X. Monoclonal antibody-based ELISA and colloidal gold-based immunochromatographic assay for streptomycin residue detection in milk and swine urine[J]. Journal of Zhejiang University-Science B(Biomedicine & Biotechnology),2010,11(1):52-60.
[56]奚茜. 食品中鏈霉素残留快速检测技术研究[D]. 杭州:中国计量学院,2012.
[57]Schnappinger P,Usleber E,Mrtlbauer E,et al. Rapid detection of streptomycin and dihydrostreptomycin in milk by enzyme-linked immunofiltration assay[J]. Food and Agricultural Immunology,1996,8(4):269-272.
[58]Ferguson J P,Baxter G A,Mcevoy J D G,et al. Detection of streptomycin and dihydrostreptomycin residues in milk,honey and meat samples using an optical biosensor[J]. Analyst,2002,127(7):951-956.
[59]Verheijen R,Osswald I K,Dietrich,ea al. Development of a one step strip test for the detection of (dihydro)streptomycin residues in raw milk[J]. Food and Agricultural Immunology,2000,12(1):31-40.
[60]Sun Y Z,Xie J,Peng T,et al. A new method based on time-resolved fluoroimmunoassay for the detection of streptomycin in milk[J]. Food Analytical Methods,2017,10(7):2262-2269.
[61]Mishra G K,Sharma A,Bhand S. Ultrasensitive detection of streptomycin using flow injection analysis-electrochemical quartz crystal nanobalance (FIA-EQCN) biosensor[J]. Biosensors & Bioelectronics,2015,67(3):532-539.
[62]Wutz K,Niessner R,Seidel M. Simultaneous determination of four different antibiotic residues in honey by chemiluminescence multianalyte chip immunoassays[J]. Microchimica Acta,2011,173(1/2):1-9.
[63]Liu B Q,Zhang B,Cui Y L,et al. Multifunctional gold-silica nanostructures for ultrasensitive electrochemical immunoassay of streptomycin residues[J]. ACS Applied Materials & Interfaces,2011,3(12):4668-4676.
[64]Zhou N D,Wang J Y,Zhang J,et al. Selection and identification of streptomycin-specific single-stranded DNA aptamers and the application in the detection of streptomycin in honey[J]. Talanta,2013,108(8):109-116.
[65]Soheili V,Taghdisi S M,Khayyat M H,et al. Colorimetric and ratiometric aggregation assay for streptomycin using gold nanoparticles and a new and highly specific aptamer[J]. Microchimica Acta,2016,183(5):1687-1697.
[66]Emrani A S,Danesh N M,Lavaee P,et al. Colorimetric and fluorescence quenching aptasensors for detection of streptomycin in blood serum and milk based on double-stranded DNA and gold nanoparticles[J]. Food Chemistry,2016,190:115-121.
[67]Zhao J,Wu Y G,Tao H,et al. Colorimetric detection of streptomycin in milk based on peroxidase-mimicking catalytic activity of gold nanoparticles[J]. RSC Advances,2017,7(61):38471-38478.
[68]Luan Q,Miao Y B,Gan N,et al. A POCT colorimetric aptasensor for streptomycin detection using porous silica beads- enzyme linked polymer aptamer probes and exonuclease-assisted target recycling for signal amplification[J]. Sensors and Actuators B-Chemical,2017,251:349-358.
[69]Taghdisi S M,Danesh N M,Nameghi M A,et al. A label-free fluorescent aptasensor for selective and sensitive detection of streptomycin in milk and blood serum[J]. Food Chemistry,2016,203:145-149.
[70]Wu C Y,Gan N,Ou C R,et al. A homogenous ″signal-on″ aptasensor for antibiotics based on a single stranded DNA binding protein-quantum dot aptamer probe coupling exonuclease-assisted target recycling for signal amplification[J]. RSC Advances,2017,7(14):8381-8387.
[71]Danesh N M,Ramezani M,Emrani A S,et al. A novel electrochemical aptasensor based on arch-shape structure of aptamer-complimentary strand conjugate and exonuclease I for sensitive detection of streptomycin[J]. Biosensors & Bioelectronics,2016,75:123-128.
[72]Loomans E E,Van Wiltenburg J,Koets M,et al. Neamin as an immunogen for the development of a generic ELISA detecting gentamicin,kanamycin,and neomycin in milk[J]. Journal of Agricultural and Food Chemistry,2003,51(3):587-593.
[73]王忠斌,王向紅,徐蓓,等. 氨基糖苷类药物多残留酶联免疫分析方法的研究[J]. 中国食品学报,2008,8(5):120-125.
[74]杨建军,于军,徐晓立. 抗氨基苷类抗生素单克隆抗体的制备[J]. 中国畜牧兽医文摘,2011,27(5):36-37.
[75]Haasnoot W,Cazemier G,Koets M,et al. Single biosensor immunoassay for the detection of five aminoglycosides in reconstituted skimmed milk[J]. Analytica Chimica Acta,2003,488(1):53-60.
[76]Xue J,Liu J,Wang C S,et al. Simultaneous electrochemical detection of multiple antibiotic residues in milk based on aptamers and quantum dots[J]. Analytical Methods,2016,8(9):1981-1988.
