甘蔗花叶病毒辅助成分一蛋白酶基因原核表达及抗血清制备
2019-08-03许小洁于伟鹏杨广玲韩士玲何梦君杨旭李向东
许小洁 于伟鹏 杨广玲 韩士玲 何梦君 杨旭 李向东


摘要:利用RT- PCR克隆甘蔗花叶病毒(Sugarcane mosaic virus,SCMV) DWKI分离物辅助成分一蛋白酶( helper component - proteinase,HC - Pro)基因,酶切后连接原核表达载体pEHISTEV,得到重组质粒pE-HISTEV - SCMV - HC - Pro。将重组质粒转化大肠杆菌菌株Rosetta,经IPTG诱导后,表达出57 kD的融合蛋白。切胶回收融合蛋白,多点注射法免疫新西兰长耳兔,制备SCMV HC - Pro抗血清。间接ELISA结果表明,该血清效价为1:8 192。感染DWKI的玉米叶片病汁液稀释128倍时,该血清仍然能够有效检测出HC - Pro。Westem - blot检测结果表明,该血清可特异性检测SCMV第1组分离物DWKI和第Ⅳ组分离物DWK2,与同属的烟草脉带花叶病毒( TVBMV)和马铃薯Y病毒(PVY)均无反应。本研究为准确、快速检测SCMV HC -Pro并进一步研究其功能和作用机制奠定了基础。
关键词:甘蔗花叶病毒;辅助成分一蛋白酶;原核表达;抗血清;检测
Prokaryotic Expression and Antiserum Preparation of HelperComponent - Proteinase of Sugarcane mosaic virusXu Xiaojie1,2 , Yu Weipengl,2* , Yang Guanglingl , Han Shilingl , He Mengjunl , Yang Xul , Li Xiangdong"2
Abstract
The helper component - proteinase (HC-Pro) gene of Sugarcane mosaic ViruS (SCMV) iso-late DWKl was cloned by RT-PCR, and ligated to prokaryotic expression vector pEHISTEV after enzymaticdigestion, producing the recombinant plasmid pEHISTEV-SCMV-HC-Pro. The recombinant plasmid wastransformed into Escherichia coli strain Rosetta, and expressed a fusion protein of 57 kD after induction withIPTG. The fusion protein was cut from the gel, emulsified and used to immumze the New Zealand long - earedwhite rabbits to produce polyclonal antiserum against SCMV HC - Pro. Titer of the antiserum was l:8192 whendetermined by indirect ELISA. SCMV HC-Pro could be detected even the extracts of DWKl-infected cornleaves were diluted at 128 times. Western-blot analysis showed that the antiserum could detect HC-Pro of i-solates DWKl (SCMV group I) and DWK2 (SCMV group IV) , but had no cross reaction to that of Tobaccovein mosaic VLrUS and Potato virus Y belonging to the Potyvirus. This study provided solid foundation for thequick and precise detection of SCMV HC - Pro and will facilitate the study on function and mechanism of SC-MV HC-Pro.
Keywords Sugarcane mosaic ViuS; Helper component - proteinase; Prokaryotic expression; Antise-rum; Detection
玉米矮花葉病是威胁我国东北、华北、西南山区三大玉米产区的重要病害之一,其发生面积广、危害重、经济损失大,已成为限制我国玉米粮食作物生产的重要因素。据农业部全国农业技术推广服务中心“玉米病毒病治理对策研讨会”会议纪要报道,1996年玉米矮花叶病发病面积达2.33×106公顷,毁种绝产4×104公顷,产量损失5亿千克。
引起玉米矮花叶病的毒原有多种,其中甘蔗花叶病毒(Sugarcane mosaic Virus,SCMV)是引起我国玉米矮花叶病的主要病毒[1,2]。SCMV属于马铃薯Y病毒科(Potyviridae)马铃薯Y病毒属(Pot-yvirus),可以经蚜虫和种子传播。SCMV粒体为线状,基因组为正单链RNA,长约9600核苷酸,编码11个成熟蛋白[3]。其中辅助成分一蛋白酶为多功能蛋白,参与病毒蚜传、复制、移动等过程,具有RNA沉默抑制活性[4-6]。
根据全基因组序列比对结果,SCMV分为5组,其中以BD8、DWK2为代表的第Ⅳ组致病力强,在生产中的危害越来越大[7,8]。本研究目的是制备可以检测SCMV第1组和第Ⅳ组分离物HC-Pro、但与马铃薯Y病毒属其它病毒HC -Pro没有反应的抗血清。
1 材料与方法
1.1 材料与试剂
感染SCMV第1组分离物DWKI和第Ⅳ组分离物DWK2的玉米样品均采自山东省泰安市岱岳区大汶口镇( N350 57'14. 05”,E1170 04'58. 66")[9];原核表达载体pEHISTEV、大肠杆菌(Escherichiacoli)菌株Rosetta( DE3)由英国安德鲁斯大学刘焕庭老师惠赠;大肠杆菌DH5α由本实验室保存。
Phusion DNA聚合酶、Western blot所用蛋白分子量标准购自Thermo公司;植物总RNA提取试剂盒TransZol、质粒小提试剂盒、PCR产物凝胶回收试剂盒为TransGen公司产品;限制性核酸内切酶、T4 DNA聚合酶、反转录酶、RNA酶抑制剂、Taq DNA聚合酶、dNTP购自TaKaRa公司;硝酸纤维素膜(NC)为Pall Gelman公司产品;羊抗兔IgG(碱性磷酸酯酶标记)、鼠抗兔IgG(辣根过氧化物酶标记)、福氏完全佐剂和福氏不完全佐剂购自Sigma公司;IPTG、DTT、甲醇等其它试剂为进口或国产分析纯。
1.2 引物设计
根据SCMV - DWK1序列(登录号KU171814)设计克隆SCMV - HC - Pro基因的引物,由上海生工生物工程有限公司合成。SCMV -HC - Pro基因克隆正向引物为SCMVHC一Pro -F:5- CGGGATCCGCTGATCCACAAGCGAATAG -3(下划线部分为BamH I酶切位点);反向引物为SCMVHC—Pro- R:5- GGAGCTCTTATCCCAC-TATATATTCACGCATCTC -3(下划线部分为Sac I酶切位点),扩增片段长度约为1380 bp。
1.3 原核表达载体构建
参照TransZol试剂盒使用说明,提取DWK1玉米样品总RNA,以RNA为模板,选择随机引物进行反转录合成cDNA,利用引物SCMVHC—pro。一F、SCMVHC—Pro-R扩增SCMV - HC - Pro基因。PCR扩增程序为:98℃30 s;98℃ 10 s,65℃ 20 s,72℃1 min,30个循环;72℃10 min,18℃保存。PCR产物用1%的琼脂糖凝胶进行电泳分离,紫外灯下切取目的条带,经PCR产物凝胶回收试剂盒回收纯化后,用BamH I、Sac I进行双酶切,与相同酶切处理的pEHISTEV载体通过T4连接酶连接,转化大肠杆菌E.coli DH5α感受态细胞。采用PCR、酶切验证筛选阳性克隆,由济南博尚生物技术有限公司测序验证。
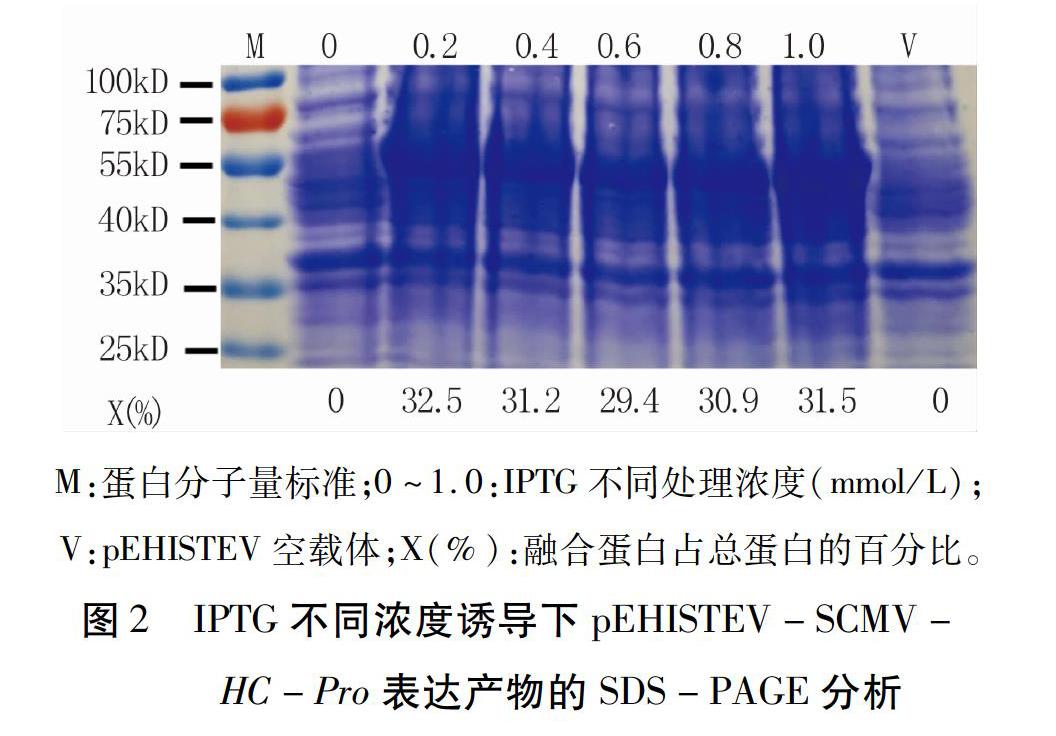
将测序验证后的阳性克隆提取质粒转化E.coli Rosetta菌株。挑取单菌落用3 mL含50 mg/L卡那霉素的LB培养基于37℃培养12 h后,取1mL菌液加入150 mL含50 mg/L卡那霉素的LB培养基中,37℃、200 r/min振荡培养2.5~3 h,使OD600,值达0.4~0.6。将菌液分为两份,一份加入终浓度分别为0、0.2、0.4、0.6、0.8、1.0mmol/L的IPTG,于28℃、150 r/min诱导Sh;另一份加入终浓度为0.2 mmol/L的IPTG,于28qC、150 r/min分别诱导0、l、2、3、4、5、6h。4qC、12000 r/min离心10 min收集菌体,加适量TE缓冲液(pH8.0)振荡悬浮,再加入等体积的2×SDS上样缓冲液,沸水浴5 min,冰上放置5 min,4℃、12 000 r/min离心10 min,取10μL上清进行SDS - PAGE电泳检测蛋白表达情况,并利用软件BandScan 5.0分析融合蛋白HC - Pro表达量占细菌总蛋白的百分比。
1.4 抗血清制备、效价及特异性测定
原核表达的目的蛋白电泳后,用4 0C预冷的含0.25 mol/L KCl和1 mmol/L DTT的显色液进行染色,切取目的蛋白条带于预冷的研钵中,按1:1(W/V)加入0.9%生理盐水充分研磨。初次免疫目的蛋白需加入等体积的弗氏完全佐剂进行乳化,采取皮下多点注射新西兰长耳兔,一周后改用弗氏不完全佐剂进行蛋白乳化,以后每隔一周注射一次,共5次,最后一次免疫一周进行心脏取血,分离血清后,于-20℃长期保存。
利用间接ELISA法测定抗血清效价:将DWK1玉米样品按1:10( W/V)的比例加入抗原包被緩冲液(0.05 mol/L碳酸盐缓冲液,pH9.6)充分研磨后,加入酶联板中,以相同的方法处理健康玉米叶片作为阴性对照。按照1:26~1:214对抗血清进行梯度稀释。显色后使用酶标仪读取OD405值,以I(待测样品读数一空白读数)/H(阴性样品读数一空白读数)≥2.0作为阳性反应[10]。
参照Towbin等[Il]的方法进行Western -blot,分析抗血清的特异性和灵敏度:以DWK1、DWK2玉米样品和分别感染烟草脉带花叶病毒、马铃薯Y病毒的普通烟以及pEHISTEV - SCMV -HC - Pro的原核表达产物为检测对象,以健康玉米叶片、普通烟叶片、pEHISTEV空载体的原核表达产物为阴性对照,测试抗血清的特异性;将DWKI玉米样品病汁液按照1:4、1:8、1:16、1:32、1:64、1:128、1:256、1:512稀释,以健康玉米叶片作为阴性对照,进行Western - blot分析。蛋白经SDS - PAGE电泳后于4qC转至NC膜,再用5%脱脂奶粉溶液将NC膜4qC封闭过夜。第二天,按1:500将制备的抗血清加入封闭液中,孵育、洗涤后加入HRP -鼠抗兔IgG稀释液中(1:50 000稀释)。将HRP - ECL化学发光所用A、B发光液按1:1混合,覆于NC膜上,用ChampChemi全自动化学发光仪观察结果。
2 结果与分析
2.1 SCMV - HC - Pro基因克隆及原核表達
通过RT - PCR从DWK1玉米样品中均克隆到1380 bp左右的特异性DNA条带,与预期大小相符(图1)。经BamH I、Sac I进行双酶切后连接到pEHISTEV载体,得到重组质粒pEHISTEV -SCMV - HC - Pro。
将重组质粒pEHISTEV - SCMV - HC - Pro转化E.coli Rosetta菌株,菌液经IPTG不同浓度和时间诱导,以pEHISTEV空载体原核表达产物为阴性对照,通过SDS - PAGE电泳检测目的蛋白表达情况,发现在57 kD左右出现一条明显的蛋白条带(图2、3),与预期结果一致,说明目的蛋白在E.coli Rosetta菌株中已成功表达。在IPTG浓度梯度中,当其浓度为0.2 mmol/L时蛋白即可表达,融合蛋白HC - Pro表达量约占细菌总蛋白的32.5%;增加IPTG浓度,对HC-Pro表达量无显著影响(图2)。WTG诱导1 h时融合蛋白即可表达,表达量约占细菌总蛋白的9.7%;随着诱导时间的延长,表达量增加;在诱导Sh时,融合蛋白HC -Pro表达量达到最大,占细菌总蛋白的32.8%;延长诱导时间,对表达量无显著影响(图3)。
2.2 抗血清制备及效价测定
原核表达的HC-Pro经SDS-PAGE分离后乳化,采取皮下多点注射免疫新西兰长耳兔,注射5次后获得SCMV HC-Pro抗血清。以DWK1玉米样品为试验材料进行效价测定,以健康的玉米叶片为阴性对照,利用间接ELISA法测得抗血清效价(表1),抗体在被稀释到8192倍时仍呈现明显的阳性,表明抗体具有较高的效价。
2.3 抗血清特异性检测
利用Western - blot分析抗血清特异性及灵敏度。结果显示,SCMV HC-Pro抗血清可同时对DWK1、DWK2玉米样品进行检测;制备的抗血清与马铃薯Y病毒属的烟草脉带花叶病毒和马铃薯Y病毒样品均无反应(图4)。在对pE-HISTEV-SCMV-HC-Pro原核表达产物检测时,由于原核表达的SCMV-HC-Pro基因携带His标签,所以其大小较野生型病毒大,符合预期结果(图4)。将DWK1样品病汁液稀释128倍时,利用制备的抗血清仍然能够检测到病毒(图5)。综上结果,本研究制备的抗血清具有较高的特异性及灵敏度。
3 讨论与结论
梁新苗等[12]利用原核表达载体pET22b(+)表达了SCMV北京分离物的HC-Pro基因,用原核表达产物制备的抗血清可用于检测SCMV北京分离物的HC-Pro;以发病玉米汁液为抗原,效价可达1:4096。本研究利用原核表达载体pE-HISTEV表达了SCMV第1组分离物DWK1的HC-Pro基因,表达蛋白占菌体总蛋白的32.5%。利用大肠杆菌Rosetta(DE3)表达的HC-Pro蛋白制备抗血清,效价为1:8192。该血清可检测SCMV第1组分离物DWK1和第Ⅳ组分离物DWK2的HC - Pro;当感染DWKI的玉米植株病汁液稀释到128倍时,该抗血清仍能对SCMVHC-Pro进行检测,且该抗体与同为马铃薯Y病毒属的烟草脉带花叶病毒、马铃薯Y病毒样品均无反应。
少数情况下,通过SDS凝胶电泳分离蛋白制备的抗体可能无法对未变性蛋白进行检测。这可能是由于蛋白变性、空间构象被破坏导致抗原决定簇发生改变,抗原与抗体无法特异性识别[13]。本研究制备的抗体可用于对SCMV HC-Pro进行ELISA和Western Blot检测。
本研究制备的抗血清具有较高的特异性、灵敏度,为SCMV HC-Pro检测、功能和作用机理研究提供了重要的物质保证。
[1] Jiang J X, Zhou X P. Maize dwarf mosaic disease in differentregions of China is caused by Sugarcane m.osaic viru.s [J] . Ar-chives of Virology , 2002 , 147 (12) : 2437 - 2443.
[2]Fan Z F, Wang W J, Jiang X, et al. Natural infection of maizehy Pennisemm mmTne virus in China [J] Plant Pathology,2004. 53(6) : 796.
[3]Fan Z F. Chen H Y, Liang X M, et al. Complete sequence ofthe genomic RNA of the prevalent strain of a potyvirus infectingmaize in China [J] Archives of Virology, 2003 . 148 (4) :773 - 782.
[4]Cronin S. Verchot J. Haldeman C R. et al. Long - distancemovement factor: a transport function of the potyvirus helpercomponent proteinase [J] Plant Cell. 1995 . 7 (5) : 549 -559.
[5 ]Maia I G. Haenni A. Bemardi F. Potyviral HC - Pro: a multi-functional protein[Jl. Journal of General Virology, 1996, 77(7) : 1335 -1341.
[6] Rojas M R. Zerbini F M. Allison R F. et al. Capsid proteinand helper component - proteinase function as potyvirus cell -to - cell movement proteins [ Jl Virology, 1997. 237 (2) :283 - 295.
[7]Yan Z Y, Cheng D J, Liu J. et al. First report of Sugarcanenzosaic virup group IV isolates from the corn production fields inChina[J].Plant Disease, 2016, 100(7):1508.
[8] Cao B,Cui X W. LiX D. et al.Complete genormic sequenceanalysis of a highly virulent isolate revealed a novel strain ofSugarcane mosaic virus[J].Virus Genes, 2011,43(3):390 - 397.
[9] 程德杰,閆志勇,黄显德,等.甘蔗花叶病毒两个山东分离物的全基因组序列分析[J].植物病理学报,2017,47(3):357 -363.
[ 10] Samhrook J,Fritsch E F,Man I.Molecular Cloning[ M]. NewYork: Cold Spring Harbor Laboratory Press. 1989.
[11] Towbin H. Staehelin T,(;ordon J.Electrophoretic transfer ofproteins from polyacrylamide gels to nitrocellulose sheets: pro-cedure and some applications[J].Proceedings of the NationalAcademy of Sciences of the United States of America, 1979,76 (9):4350 -4354.
[12] 梁新苗,范在丰,李怀方.甘蔗花叶病毒HC - Pro基因原核表达及表达产物抗血清制备[J].植物保护学报,2006(1):37 -40.
[13] 颜真,苏成芝.抗Dystrophin特异性抗血清Anti 5 -7的制备[J].中华医学遗传学杂志,1994,11(2):72 - 74.
