Na2S2O3溶液标定方法改进试验
2019-07-25李伟,熊健,周毅,杨灿
李 伟,熊 健,周 毅,杨 灿
(西藏大学理学院,拉萨 850000)
硫代硫酸钠作为碘量法中常用物质之一,在化工行业,高校以及基层检测单位中用途极为广泛[1,2]。实验室常用重铬酸钾作为基准物质对Na2S2O3溶液进行标定[3,4],但会产生含铬离子废液,如果处理不当,易对周围水体、土壤和人类生活环境等造成较为严重的污染[5]。鉴于此,Na2S2O3的标定方法有必要向绿色环保方向考虑,根据刘中兴等[6]、杨兵等[7]、杨维强[8]、朱华英等[9]对双氧水和碘化钾性质、反应特点的研究,探讨了利用H2O2标准溶液间接测定Na2S2O3浓度的可能性。
1 试验部分
1.1 仪器和试剂
碘量瓶、水浴锅、容量瓶、滴定管、移液管等。
0.1 mol/L Na2S2O3溶液的配制:称取五水硫代硫酸钠24.80 g于烧杯中,加入约0.2 g碳酸钠并用去离子水溶解,定容至1 L棕色容量瓶,贴上标签放置约 7 d 后待标定;3%H2O2;25%磷酸溶液;20 g/L碘化钾溶液;0.2 mol/L高锰酸钾溶液;0.5%淀粉指示剂(新配);草酸钠等,以上试剂均为分析纯。
1.2 试验原理
在磷酸作用下,H2O2标准溶液将I-定量氧化为I2,用Na2S2O3滴定至终点,间接测定其浓度,反应方程式如下:
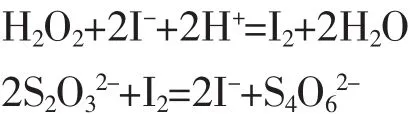
根据上述反应关系,Na2S2O3溶液浓度的计算公式如下:
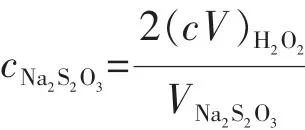
式中,cNa2S2O3表示Na2S2O3标准溶液的浓度,单位mol/L;cH2O2表示 H2O2溶液的浓度,单位 mol/L;VH2O2表示所用H2O2溶液的体积,单位mL;VNa2S2O3表示消耗Na2S2O3溶液的体积,单位mL。
1.3 试验方法
1.3.1 定性试验分析 在定性试验中分别对H2O2、磷酸用量和反应温度进行探讨。试验所用20 g/L碘化钾溶液与25%磷酸混合溶液在静置2 h后滴加淀粉指示剂均无明显变化,说明溶液在该时间段内未被氧化。
1)H2O2浓度的影响。将碘量瓶编号1至5,分别加入20 g/L碘化钾溶液30 mL、25%磷酸溶液6 mL,置于30℃的恒温水浴锅中,再依次加入3%、5%、10%、15%、30%的H2O2溶液1 mL,观察记录为现象1;滴加淀粉指示剂2滴,观察并记录现象2,结果见表1。通过表1试验现象可知,H2O2达到5%时有分解的趋势,不利于目标反应的进行,故选择3%H2O2溶液。

表1 H2O2浓度的影响
2)温度的影响。H2O2在磷酸环境中与碘化钾的反应速率较慢,但在高温中又容易分解,因此设计如下试验,将碘量瓶编号1至5,分别加入3%H2O2溶液 10 mL,分别置于 20、30、40、50、60 ℃的恒温水浴锅中,观察碘量瓶中是否出现气泡,记录现象1,然后依次加入20 g/L碘化钾溶液30 mL和25%磷酸溶液6 mL,观察并记录现象2;最后滴加淀粉指示剂2滴,观察溶液颜色并记录现象3,试验结果见表2。通过表2中现象1可知,当温度为40℃时,H2O2开始分解,与文献一致[6],现象 2、现象 3 说明 H2O2在磷酸作用下与碘化钾反应能生成碘,最佳试验温度为30℃。
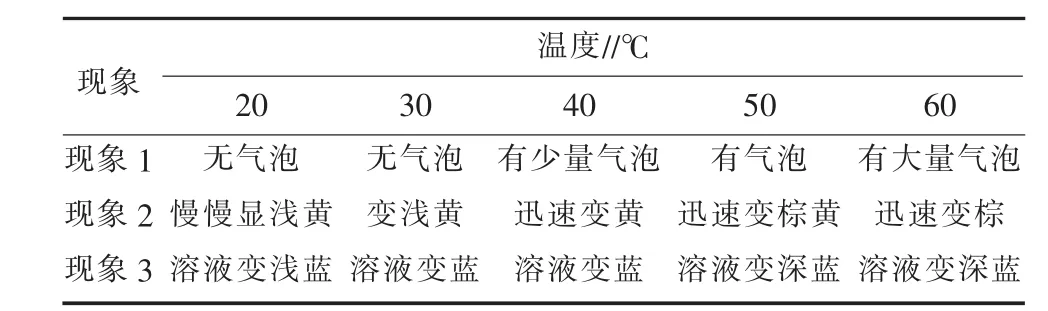
表2 温度的影响
3)磷酸用量的影响。将碘量瓶编号1至5,分别加入 20 g/L碘化钾溶液 30 mL,3% H2O2溶液1 mL,置于30℃的恒温水浴锅中,依次加入25%磷酸溶液 0、2、4、6、8mL,观察溶液变化,并记录现象 1,然后滴加淀粉指示剂2滴,观察记录现象2,结果见表3。通过试验可选择磷酸用量为6 mL。

表3 磷酸用量的影响
1.3.2 单因素定量试验 通过大量的定性试验分析,筛选出影响该反应的3个主要因素:磷酸、碘化钾用量以及反应时间。利用重铬酸钾法(n=6)测得 cNa2S2O3=0.099 6 mol/L,S1=0.08%,同时利用 cKMnO4=0.277 8 mol/L 标定 3%H2O2, 测得该 H2O2浓度为0.821 8 mol/L。
1)磷酸用量的影响。将碘量瓶依次编号1至5,分别加入20 g/L碘化钾溶液30 mL和0.821 8 mol/L H2O21.00 mL, 再按顺序取 25%磷酸溶液 2、4、6、8、10 mL于碘量瓶,置于30℃恒温水浴锅中,约10 min后滴加淀粉指示剂溶液2滴,溶液变蓝,用Na2S2O3溶液滴定至终点,平行3次,结果见表4。通过表4可知,当磷酸用量达6 mL时,结果趋于稳定,与表3的结论一致。

表4 磷酸用量对硫代硫酸钠标定结果的影响
2)碘化钾用量的影响。将碘量瓶依次编号1至5, 分别加入 0.821 8 mol/L H2O2溶液 1.00 mL,25%磷酸溶液6 mL,再依次取20 g/L碘化钾溶液20、30、40、50、60 mL于碘量瓶, 置于 30℃恒温水浴锅中,约10 min后滴加淀粉指示剂溶液2滴,溶液变蓝,用Na2S2O3溶液滴定至终点,平行3次,结果见表5。通过表5可知,过量碘化钾能促使反应正向进行,当用量达40 mL时,结果趋于稳定。
3)反应时间的影响。将碘量瓶依次编号1至5,分别取 0.821 8 mol/L H2O2溶液 1.00 mL,25%磷酸溶液 6 mL,20 g/L碘化钾溶液 40 mL于 30℃恒温水浴锅中,分别静置 10、15、20、25、30 min 后,滴加淀粉指示剂溶液2滴,溶液变蓝,用Na2S2O3溶液滴定至终点,平行3次,结果见表6。通过表6发现,增加时间能促使反应正向进行,反应时间为25 min时,结果趋于稳定。
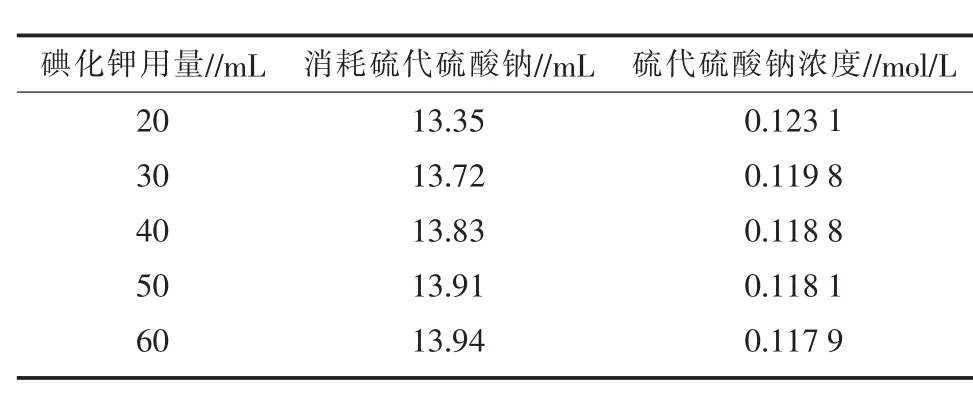
表5 碘化钾用量对硫代硫酸钠标定结果的影响
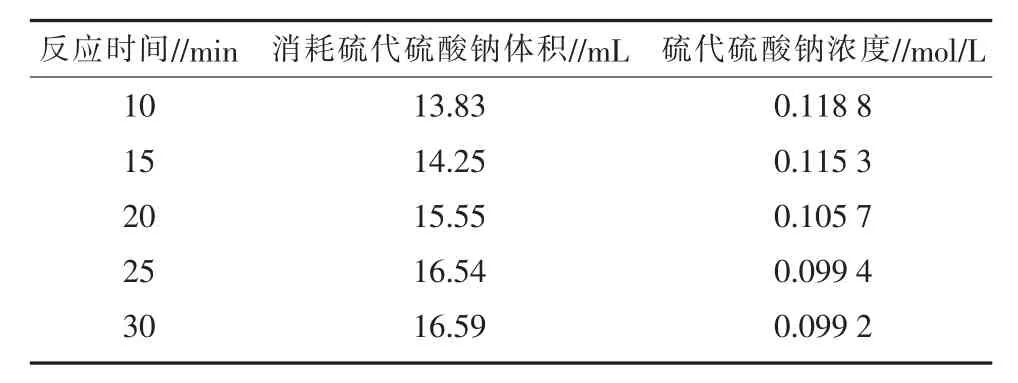
表6 反应时间对硫代硫酸钠标定结果的影响
1.3.3 正交试验 通过单因素试验探究,以磷酸用量、碘化钾用量和反应时间设计正交试验,以Na2S2O3浓度0.099 6 mol/L为参考指标,确定该试验的最佳条件。
2 结果与分析
2.1 正交试验结果
正交试验结果见表7。通过表7得出,各因素影响强弱为:反应时间>磷酸用量>碘化钾用量,综合试剂用量和反应时间因素及实践操作等考虑,最佳条件为 25%磷酸溶液6 mL,20 g/L碘化钾溶液40 mL,0.821 8 mol/L 的 H2O2溶液 1.00 mL 反应 30 min,此条件下对 Na2S2O3溶液进行标定(n=6),测得c=0.099 4 mol/L,S2=0.09%。
2.2 两种方法的对比分析
重铬酸钾法(方法1)与利用H2O2标准溶液对Na2S2O3浓度进行测定(方法2)的对比分析见表8。利用两种方法对Na2S2O3进行标定,标准偏差分别为0.08%和0.09%,以F检验法对结果进行分析,无显著性差异,表明该试验方法绿色环保,准确度高,可用于Na2S2O3溶液的标定。
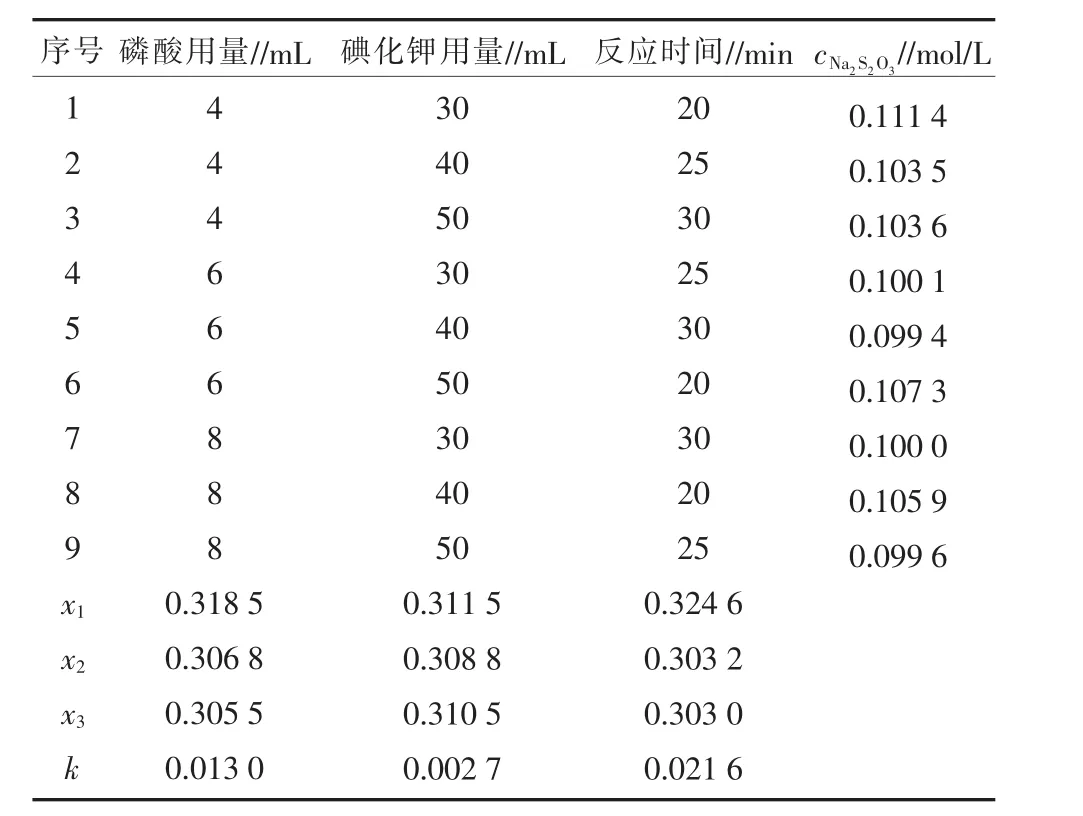
表7 正交试验结果
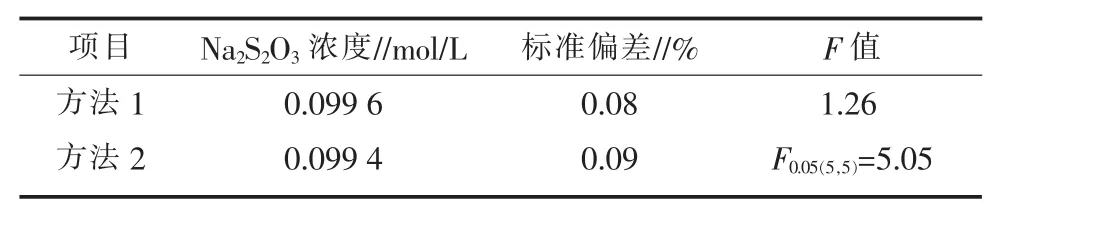
表8 两种方法的对比分析结果(n=6)
3 小结
各因素对试验影响大小为:反应时间>磷酸用量>碘化钾用量,最佳条件为25%磷酸溶液6 mL,20 g/L碘化钾溶液 40 mL,0.821 8 mol/L H2O2溶液 1.00 mL在30℃下反应30 min,试验效果最佳。
