水体pH对伪鱼腥藻生长及叶绿素荧光参数的影响
2019-07-02王茂伟周利高静思朱佳
王茂伟,周利,*,高静思,朱佳
1.青岛理工大学环境与市政工程学院,青岛 266033
2.哈尔滨工业大学深圳研究生院,深圳 518055
3.深圳职业技术学院建筑与环境工程学院,深圳 518055
0 前言
随着人类生产、生活等活动的进行,水体富营养化问题越来越严重,国内太湖、滇池和巢湖等湖泊的水体富营养化问题已经对人们的生存环境质量构成了潜在的威胁[1-3]。南方某市某梯级水库群发生蓝藻水华时的优势种群为伪鱼腥藻[4],伪鱼腥藻也是富营养化水体中常见的有毒水华藻种[5-6],常作为微囊藻的伴生种被微囊藻的胶鞘多糖包被而一起在富营养化水体中形成水华。同时,该藻能够产生典型嗅味物质2-甲基异莰醇(2-MIB)[7-8],严重影响水质安全。但目前国内外对该课题的研究较少,关于pH 对伪鱼腥藻的生长特性和光合生理方面的研究更是鲜有报道。
有学者认为水体pH 是变化的,不能作为预测藻类生长量的指标[9],但是鉴于水华的发展和形成是各种因素影响下的综合结果,研究者们开展了很多关于pH 对微藻影响的研究。有大量研究表明,不仅pH 会影响藻类生长,藻类的生长也会影响水体pH,改变后的pH 也是大多数藻类能够适应的pH 环境[10-12]。多数研究发现蓝藻偏好较高pH,但也有研究表明,在酸性条件下,也会发生蓝藻水华[13]。本试验以伪鱼腥藻为研究对象,研究不同pH 对其生长及叶绿素荧光参数的影响,为伪鱼腥藻增殖和水华暴发机理的研究提供依据。
1 材料与方法
1.1 试验材料
试验所需伪鱼腥藻(FACHB-1277)购自中科院水生生物研究所淡水藻种库,用BG 11 培养基培养,经实验室扩大培养后用于试验。试验在光照培养箱中进行,光照强度2000 lx,光暗比12 h:12 h,温度25 ,℃ 为保证光照均匀,每天定时手动摇瓶3 次,并任意交换锥形瓶位置。实验所用所有玻璃器皿均经121 ,30℃ min 高温灭菌后使用。
1.2 接种
取适量的藻液以5000 r·min-1的速度离心10 min,弃掉上清液,用15 mg·L-1的碳酸氢钠溶液洗涤后离心,重复3 次,用无菌水稀释后分别接种于试验所用BG 11 培养基内。以BG 11 培养基为参比,接种密度为OD665≈ 0.02[14]。
1.3 试验设置
试验一共分为2 个试验组,a 组自试验开始时调整pH 至设定值不再人为调节并每天测定一次pH,b组每天测定pH 后用0.1 mol·L-1HCl 或者NaOH 调节pH 至初始设定值。2 组试验设置的pH 梯度均为3、5、7、8、9、11、13。每个处理组设置三个平行样。
1.4 叶绿素a(Chla)及叶绿素荧光参数的测定
利用浮游植物分类荧光仪(PHYTO-PAM WALZ)对叶绿素荧光各个参数进行测定。测定叶绿素荧光参数前将样品暗适应5 min,各参数可在仪器上直接读出。Fv/Fm为最大光系统 Ⅱ( PSⅡ )的光能转换效率,可看作潜在最大的光合效率;ETR 为光抑制时的最大潜在相对电子传递速率,可作为一定光强下单位生物量内光合作用速率的探针;Ik为半饱和光强,反映了浮游植物光适应能力。
1.5 数据处理
采用SPSS 22.0 进行单因素方差分析,利用Origin 8.0 进行绘图。
2 结果与分析
2.1 pH 对伪鱼腥藻叶绿素a 含量的影响
不同pH 条件下2 组试验的叶绿素a 浓度变化情况如图1所示(a 代表未调控pH 试验组,b 代表调控pH 试验组,下同)。单因子方差分析表明,在整个培养周期中,2 组试验中pH 对伪鱼腥藻叶绿素a 浓度影响均极显著(P<0.01)。pH 为3、13 试验组的伪鱼腥藻接种后便死亡。不调控pH 试验组中,在pH为5—11 范围内伪鱼腥藻均能正常生长,但pH 5 试验组叶绿素a 浓度显著(P<0.05)低于7—11 试验组,pH 为7—11 试验组叶绿素a 浓度差异不显著(P> 0.05)。
调控pH 试验中,pH 5 试验组在试验前7 d 叶绿素a 含量略微增长,从第8 d 开始叶绿素a 浓度接近0 μg·L-1。在pH 为7—11 范围内,伪鱼腥藻叶绿素a含量与pH 显著正相关(P<0.05),而且pH 为9 和11试验组的叶绿素a 含量高于未调控试验组中相应pH下叶绿素a 含量。
2.2 试验期间pH 动态变化情况

图1 试验期间伪鱼腥藻叶绿素a 含量变化曲线 Figure1 Curve of Chlorophyll a content of Pseudanabaena sp.in the experiment
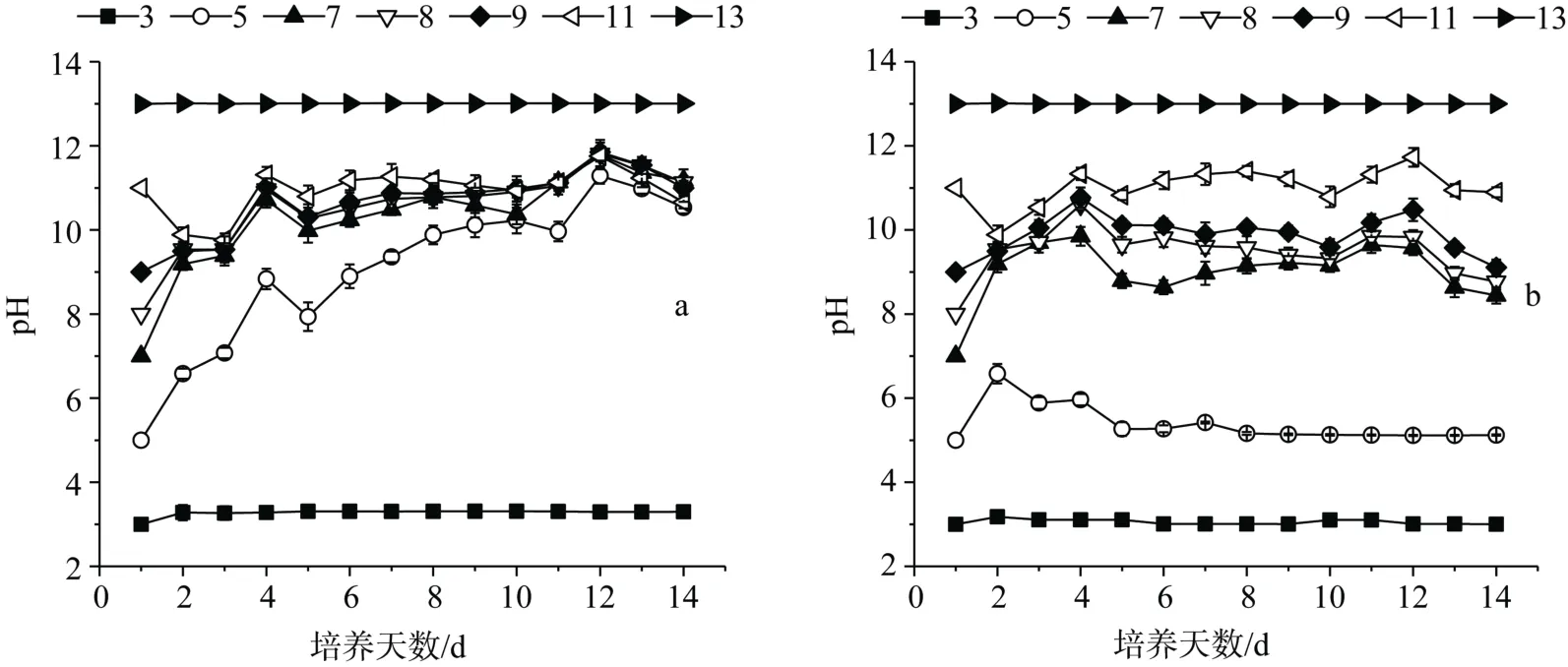
图2 试验期间pH 变化情况 Figure2 Change of pH in the experiment
试验期间各试验组实际pH 变化情况如图2所示。未人为调控pH 试验中,在试验开始前4 d,初 始pH 为5—9 的试验组pH 均迅速上升,pH 为11 的试验组pH 在试验前3 d 下降后也迅速上升,初始pH为5—11 试验组pH 最终调节到约10.9—11.5 范围内。人为调控pH 试验组的pH 变化趋势未调控pH组类似,不同的是pH 为5 的试验组在试验第2 d pH上升后,从第3 d 开始,随着藻细胞的死亡,pH 迅速下降,而且调控pH 试验中各组之间pH 差异较大,初始pH 为7—11 试验组pH 最终调节到约9.5—11.3。2 组试验中,pH 为3 和11 的试验组pH 基本保持不变。通过以上分析说明伪鱼腥藻偏好碱性环境,而且对水体的适应能力及调节能力较强,对pH 为5—11 水体能迅速作出反应,调节pH 至适宜生长的范围。
2.3 pH 对伪鱼腥藻叶绿素荧光参数的影响
2.3.1 pH 对伪鱼腥藻最大光能转化效率(Fv/Fm)的影响
pH 对伪鱼腥藻最大光能转化效率(Fv/Fm)的影响如图3所示。从图中可以看出,未调控pH 试验中,Fv/Fm总体趋势为先增大后减小,pH 为11 试验组的Fv/Fm最大,在整个试验周期中维持在0.28以上,pH 为5 试验组Fv/Fm低于其它实验组。调控pH 试验中,pH 为11 试验组Fv/Fm显著大于其它试验组,pH 为7—9 试验组差异不大,pH 为5 试验组Fv/Fm显著低于其它试验组,从实验第5 d 开始便趋于0。
2.3.2 pH 对伪鱼腥藻最大相对电子传递速率(ETR)的影响
pH 对伪鱼腥藻最大相对电子传递速率的影响如图4所示。从图中可以看出,在整个试验周期内,2 组试验ETR 均先增大后减小,pH 为5 的试验组ETR均显著低于其它试验组,其中人为调控pH 试验组的ETR 从第5 d 开始趋于0,而且该组试验中,ETR随着pH 增大而增大。
2.3.3 pH 对伪鱼腥藻半饱和光强(Ik)的影响
pH 对伪鱼腥藻半饱和光强的影响如图5所示。从图中可以看出,2 组试验中除pH 为5 试验组外,其它pH 下的Ik差异不大,而且在培养期内的变化趋势基本一致。未人为调控pH 试验中pH为5 试验组的Ik值在实验后期pH 上升,而调控pH试验中pH 为5 试验组的Ik值从第5 d 开始迅速下降,趋向于0。
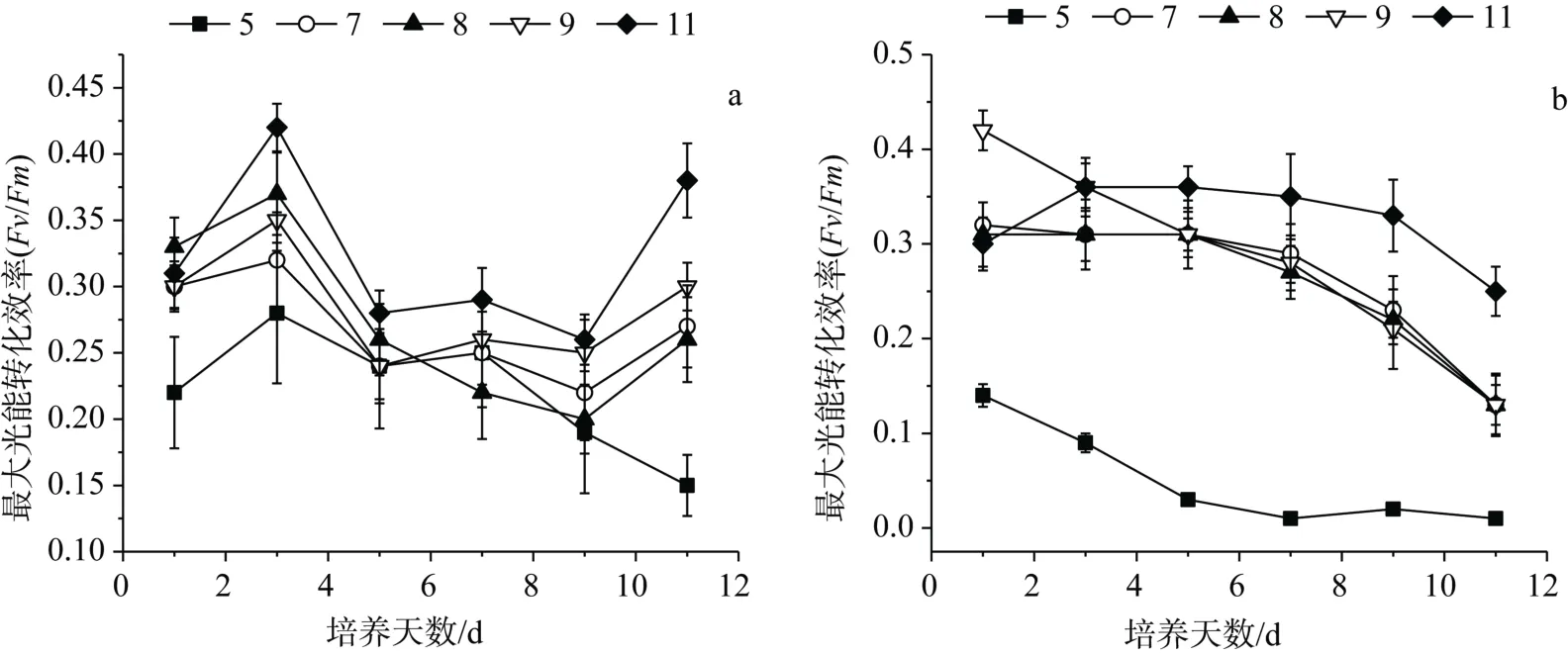
图3 pH 对伪鱼腥藻最大光能转化效率的影响 Figure3 Effect of pH on Fv/Fm of Pseudanabaena sp.
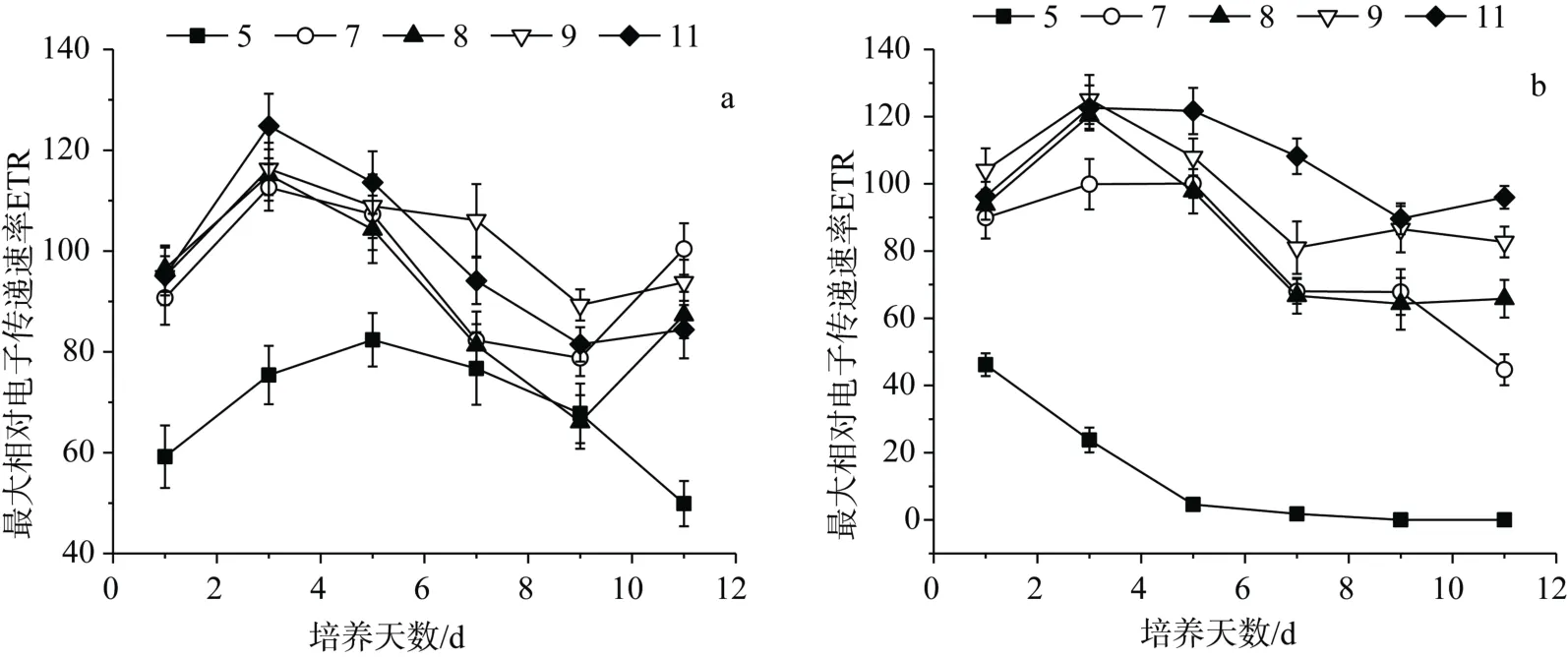
图4 pH 对伪鱼腥藻最大相对电子传递速率的影响 Figure4 Effect of pH on ETR of Pseudanabaena sp.

图5 pH 对伪鱼腥藻半饱和光强的影响 Figure5 Effect of pH on Ik of Pseudanabaena sp.
3 讨论
水体pH 主要从两方面对微藻产生影响,一方面通过改变环境酸碱度,酸性或碱性太强均会影响细胞膜的渗透性及酶的活性等,从而对藻细胞产生伤害;另一方面通过影响碳酸盐平衡系统及不同形态无机碳(等)分配关系而影响藻类的生长。其中自由CO2是藻类光合作用易于吸收的形态,当pH 达到9.0 时,水体中的CO2浓度很低[15-16]。此时,水体中的碳酸氢盐为主要碳源,支彦丽[17]利用pH 漂移技术,从碳酸氢盐的利用角度,将藻类分为三类,第一类是不能利用HCO3-,漂移试验中pH 终值一般很少超过9;第二类是具有利用HCO3-能力的,其pH 可漂移至9;第三类是强HCO3-利用者,本试验中伪鱼腥藻最适初始pH 为11,显然为第三类。藻类利用碳酸氢盐的机理为:藻类能够借助细胞表面的碳酸酐酶(CA)将水环境中的HCO3-转化为可以被吸收和固定的CO2[18-19],或者通过阴离子交换机制使HCO-3直接进入胞内,交换出OH-[20-21],完成碳酸氢盐的利用,其中前者叫做无机碳浓缩机制(CCM),CA 在此过程中起关键作用。
2 组试验中,伪鱼腥藻在pH 为3 和13 条件下均不能生长,但在初始pH 为碱性的条件下的生长情况明显好于酸性条件下,这与大多数蓝藻偏好碱性条件相似。而且伪鱼腥藻对环境有很强的适应与调节能力,未人为调控试验组中,对pH 5—11 的环境调节能力很强,使水体最终pH 趋向10.9—11.5,这也可以认为是伪鱼腥藻的最适pH 范围,其中初始pH 5 的试验组pH 最高上升到11.2,上升了6.2个单位。调控pH 试验中,虽然每天调控pH 至初始值降低了其自我调控能力,但伪鱼腥藻均努力调节pH 至较适宜的生长范围。蓝藻大多偏好碱性环境,但最适pH达11.0左右的藻却很少,铜绿微囊藻的最适pH 为9.5 左右[22-23],水华鱼腥藻为8.0—9.0,浮游颤藻为7.0—8.0[16]。pH 影响藻类对营养盐的吸收、细胞内生化组分以及各种酶的活性,离子及酶在水体中的解离状态和行为也受pH 影响,过高或者过低的pH 均会对以上的生理活动造成不利影响[24]。维持细胞内外的离子平衡对藻类的生长也非常重要,水体中pH 的变化使得藻类需要消耗大量的能量来维持这个平衡[25],随着培养周期的延长,藻液pH 总体升高,但是低pH 条件下,pH 的波动范围更大,这也是本试验中低pH 试验条件下伪鱼腥藻生长受到抑制的原因之一。藻类的光合作用、营养盐吸收等生理活动均需要酶的参与,伪鱼腥藻的最适pH 能达到11,可能是此pH 条件下,伪鱼腥藻细胞用于营养盐吸收、光合作用等酶的活性最高,在如此高的pH 条件下,伪鱼腥藻的细胞也没有受到破坏,说明其抗氧化系统[26]功能非常强大,能有效保护细胞膜的完整性。而且此pH 下,水体中几乎不含CO2,伪鱼腥藻需要启动上述提及的无机碳浓缩机制(CCM)来提供足够的碳源,可见伪鱼腥藻的具有很高的CCM 功能。
当植物受到胁迫时,用于光化学反应的能量下降,而以热能和荧光形式耗散的能量增加,因此叶绿素荧光参数的变化可以反应出植物受胁迫的程度,是光合作用良好的探针[27]。本试验调控pH 试验中pH 5 试验组的各荧光参数均显著低于其它组,并且随着培养时间的增加,各荧光参数趋于0,说明此条件下的伪鱼腥藻光合系统受到破坏。而不人为调控试验中pH 5 试验组的各荧光参数虽然低于其它组,但是各参数均处于正常范围内,光合系统并未被破坏。在pH 7—11 范围内,Fv/Fm、ETR 总体上随pH增大而增大,各试验组的Ik值差异不大。但是试验后期,未调控试验中,pH 5 试验组的Ik值上升,处于较大值,笔者认为原因是伪鱼腥藻在经历短期的逆境(低pH)驯化后,随着pH 恢复正常,使其具有了更强的耐受饱和光强的能力,郭连旺[28-29]等也指出,适当的逆境锻炼,有利于提高植物的某些光合能力。而且生物中普遍存在补偿与超补偿效应,是生物体在遭受逆境胁迫后,其生长和生理机能受到制约,但当恢复到适宜的生长条件后,生长状况和生理指标得到不同程度的恢复[30-31]。当pH 5 处理组pH 恢复正常后,叶绿素a 浓度虽然未超过其它试验组,但其生长速度却显著加快,Ik值也增大,这应该是出现补偿效应的结果。
伪鱼腥藻对水体pH 的适应范围大,调控能力强,水体pH 不适时仍有发生伪鱼腥藻水华的可能,因此通过调控pH 来控制伪鱼腥藻水华是有风险的,若要调节pH 来控制伪鱼腥藻的生长,必须使pH 处于恒定状态。本试验由于条件所限,没有从分子生物学方面探究伪鱼腥藻对pH 的适应及调控能力,以后条件允许,应该加强此方面的研究。
4 结论
在不人为调节pH 条件下,伪鱼腥藻在pH 5—11 范围内均能正常生长,在人为调节pH 条件下伪鱼腥藻在pH 7—11 范围内均能正常生长,且pH 越大,生长情况越好。pH 为3 和13 条件下伪鱼腥藻均不能生长。
伪鱼腥藻对水体pH 的调节能力极强,在初始pH 5—11 范围内,将pH 最终调至10.9—11.5,此pH范围可以认为是伪鱼腥藻最适pH 范围。调控pH 试验中,虽然每天调控pH 至初始值降低了其自我调控能力,但伪鱼腥藻均努力调节pH 至较适宜的生长范围。
水体pH 变化会影响伪鱼腥藻的生长,伪鱼腥藻的增殖也会影响水体pH,两者交互作用,互为因果关系。
在pH 5—11 范围内,Fv/Fm、ETR 总体上随pH增大而增大,除pH 5 试验组外各试验组Ik值差异不明显,不调控pH 试验中,pH 5 试验组后期Ik显著增大,人为调控pH 试验中pH 5 试验组各荧光参数均显著低于其他组。
