猪瘟病毒Erns蛋白在杆状病毒系统中的表达及纯化
2019-06-25张乾义夏应菊朱元源邹兴启赵启祖
牛 康,徐 璐,张乾义,夏应菊,朱元源,邹兴启,李 翠,赵启祖,王 琴
(中国兽医药品监察所国家/OIE猪瘟参考实验室,北京 海淀 100081)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的对世界养猪业造成巨大经济损失的一种高度传染性疾病,是OIE规定必须上报的疫病[1]。CSFV是单股正链RNA病毒,其基因组的大小为12.3 kb,含有单个大型开放阅读框编码约3 898个氨基酸的多聚蛋白,其经过宿主细胞及病毒酶的加工形成结构蛋白(C,Erns,E1和E2)和非结构蛋白(NS2,NS3,NS4A,NS4B,NS5A和NS5B)[2]。Erns蛋白的分子量大小为44~48 kDa[3],其潜在的糖基化位点有9个,Erns蛋白的糖基化反应能够影响免疫应答,Erns蛋白的中和表位也依赖于糖基化的存在[4]。糖基化过程会影响Erns蛋白的分泌和其二聚体的合成与加工,这种糖基化模式能够影响病毒的毒力,在病毒的吸附、进入、释放过程中起到重要作用[5]。Erns蛋白参与CSFV的吸附和自噬的调控[6-7],能够抑制I型干扰素的合成[8-9],从而引起持续性感染[10]。Erns蛋白和E2蛋白可刺激机体产生中和抗体并提供保护作用[11-12]。因此,猪瘟的血清学诊断主要针对Erns蛋白和E2蛋白[13]。囊膜糖蛋白E2是主要的抗原蛋白,目前已有E2蛋白的亚单位疫苗问世。另外,以E2基因为目标的能够区分感染和免疫动物(Differentiating infected from vaccinated animals,DIVA)的标记疫苗也是当前的研究热点。因此,Erns蛋白就成了开发相应的鉴别检测方法的首选蛋白[14-15]。本研究拟利用杆状病毒系统表达并纯化Erns蛋白,并验证纯化后Erns蛋白的反应原性,为研究亚单位疫苗和DIVA疫苗的鉴别诊断试剂盒以及Erns蛋白的结构和生物学功能奠定重要基础。目前应用于蛋白表达的系统多为原核表达系统,表达产物多以包涵体形式存在[16],而真核表达系统(如酵母和昆虫细胞)克服了此缺点。Luo Y等[17]在酵母表达系统中获得了具有生物活性的Erns蛋白。Liu chen等[16]在杆状病毒系统中成功表达Erns蛋白,并证实Erns蛋白具有RNA酶活性,这表明通过杆状病毒系统表达的Erns蛋白与天然结构的Erns蛋白是相似的。本研究利用杆状病毒系统表达猪瘟病毒的结构蛋白Erns,并对其反应原性进行分析。【拟解决的关键问题】构建表达猪瘟病毒Erns蛋白的重组杆状病毒,通过对表达和纯化条件的优化得到可溶性的高效表达的Erns蛋白,并对其特性进行鉴定,为CSFV的感染、复制、致病机理等方面的研究以及DIVA疫苗的开发奠定重要基础。
1 材料与方法
1.1 材料 病毒、质粒、细胞和相关试剂:SM株(CVCC AV1411)由本实验室保存;TaKaRa病毒RNA提取试剂盒、反转录酶、Ex Taq酶等,购自宝生物工程(大连)有限公司;限制性内切酶 BamH I、Xba I,购自NEB公司;T4DNA连接酶,购自Promega公司;质粒小量提取试剂盒Ⅱ,购自Omega公司;DH5α感受态细胞,购自天根生化科技(北京)有限公司;Bluo-Gal,购自赛默飞世尔科技(中国)有限公司;Cellfection Ⅱ Reagent、Grace's insect medium 1x,unsupplemented、Sf900Ⅱ SFM,购自Invitrogen公司;胎牛血清(FBS)、马血清,购自GIBCO公司;FITC标记的羊抗鼠抗体、抗His标签的单抗、兔抗猪二抗,购自Sigma公司;Ripa(中)裂解液、Pmsf,购自碧云天生物公司。转移表达载体 pFastBac HT A、DH10Bac感受态细胞、Sf9细胞、猪瘟病毒阳性血清、Erns单抗由本实验室保存。
1.2 方法与结果
1.2.1 引物设计 根据GeneBank(AF333000)SM株 Erns基因序列设计引物,上游引物:5′-CGC GGATCC G GAAAATATAACTCAAT-3′(斜体为 Bam-HI酶切位点)、下游引物:5′-GC TCTAGA TT ACAGTAAGGCGATAGGG-3′(斜体为 XbaI酶切位点),由生工生物工程(上海)股份有限公司合成。
1.2.2 Erns基因的扩增和重组转移载体pFastbac HT A-Erns的构建 参照TaKaRa病毒RNA提取试剂盒说明书提取病毒RNA,并进行反转录获得cDNA。 PCR 反应体系为:Erns-F、Erns-R 各1.5 μL;Ex Taq 酶 12.5 μL;cDNA 5 μL;ddH2O 4.5 μL。 反应程序如下:97℃预变性1 min;98℃变性10 s;52℃退火30 s;72℃延伸1 min,共35次循环;72℃终延伸10 min。将PCR产物进行1%琼脂糖凝胶电泳分析,出现了一条分子量约为700 bp的目的条带(图1),与预期大小(696 bp)相符。
使用BamH I和Xba I对回收的目的基因双酶切并克隆至表达载体pFastbac HT A,转化至DH5α感受态细胞中,挑取单菌落过夜培养并提质粒,进行PCR、双酶切鉴定,经琼脂糖凝胶电泳分析可见大小为4 856 bp左右的载体片段和696 bp左右的Erns基因片段(图1)。将阳性质粒进行测序,将测序正确的阳性质粒命名为pFA-Erns。

图1 Erns基因的RT-PCR扩增与pFastbac HT A-Erns的双酶切鉴定
1.2.3 重组杆粒rBacmid-Erns的构建 将阳性质粒转化至DH10bac感受态细胞中,经蓝白斑筛选及二次筛选后挑取单个白色大菌落进行培养,提取杆粒,利用M13-F和M13-R通用引物对杆粒进行PCR鉴定,得到片段大小为3 126 bp(图2),并将PCR产物送测序。将鉴定正确的重组杆粒命名为rBacmid-Erns。

图2 重组杆粒rBacmid-Erns的PCR鉴定
1.2.4 收获重组杆状病毒 将重组杆粒rBacmid-Erns转染至对数生长期的sf9细胞中,在27℃培养箱中培养,转染后4 d收取sf9细胞培养上清,即为P1代重组杆状病毒,命名为rBac-Erns,继续将P1代毒接种于对数生长期的sf9细胞中盲传至第3代获得P3代病毒并置于-80℃避光保存。
1.2.5 Erns蛋白的表达及Western Blot鉴定 将P3代重组杆状病毒及野生杆状病毒感染sf9细胞72 h后,弃去细胞培养上清,使用PBS冲洗细胞,2 000 r/min离心5 min,弃上清。向细胞沉淀中加入ripa裂解液裂解10 min后,12 000 r/min(4℃)离心取上清。加入5×Loading Buffer,煮沸10 min,取10 μL样品进行SDS-PAGE电泳。
结果表明,在37 kD左右出现条带,与目的大小相符(图3A),对照细胞无此条带。
SDS-PAGE电泳结束后将蛋白转印至PVDF膜上,分别用1∶300稀释的猪瘟阳性血清及1∶300稀释的His单抗作为一抗,以兔抗猪二抗(1∶2 000稀释)和羊抗鼠二抗(1∶2 000稀释)作为二抗对表达产物进行Western-Blotting分析。
Western-Blotting结果表明,猪瘟阳性血清(图3B)和His单抗(图3C)都可以与目的蛋白发生特异性结合;对照细胞裂解上清均没有目的蛋白与高免血清和His单抗发生特异性结合。
1.2.6 间接免疫荧光法鉴定Erns重组蛋白的表达
在96孔板铺好sf9昆虫细胞,细胞密度为70% ~80%。将P3代杆状病毒稀释103倍并接种sf9细胞,每孔加100 μL。在27℃细胞培养箱中吸附1 h后每孔补加维持液100 μL,继续培养72 h。使用4%甲醛室温固定30 min,弃固定液,用PBS洗2~3次,再加0.1%triton X-100室温静置15~20 min,弃triton X-100,用PBS洗2次,分别使用50 μL 5%BSA稀释的Erns单抗和His单抗37℃孵育1 h,吸弃一抗,PBS洗2~3次。每孔加5%BSA稀释的二抗50 μL,37℃孵育1 h,吸弃二抗,PBS洗2~3次。在荧光显微镜下观察重组蛋白Erns的表达情况。
经P3代重组病毒感染的sf9昆虫细胞的胞浆中有亮绿色的荧光(中插彩版图4-A、图5-A),而未接毒的sf9细胞对照呈阴性(中插彩版图4-B、中插彩版图5-B),说明Erns基因和His标签成功表达。
1.2.7 Erns蛋白表达条件的优化 使用P3代重组病毒接种对数生长期的sf9细胞,分别在48 h、60 h、72 h、84 h、96 h收样,检测蛋白的表达量,再以不同的感染复数(MOI=0.1、0.5、1、2、5、10)分别接毒收样,检测Erns蛋白的表达量。
结果表明,在MOI=1,表达时间为72 h,蛋白的表达量最高(图6)。
1.2.8 Erns蛋白的纯化 按照优化好的表达条件大量表达Erns蛋白,使用HIS标签亲和层析法纯化Erns蛋白,并对纯化后的蛋白进行SDS-PAGE检测,获得了单一条带的目的蛋白(图7)。使用BCA法测定蛋白的浓度为0.2 mg/mL。
1.2.9 纯化后Erns蛋白的Western Blotting鉴定使用Erns单克隆抗体对纯化后的Erns蛋白进行Western Blotting鉴定,结果证明,纯化后的Erns蛋白具有很好的反应性(图7)。
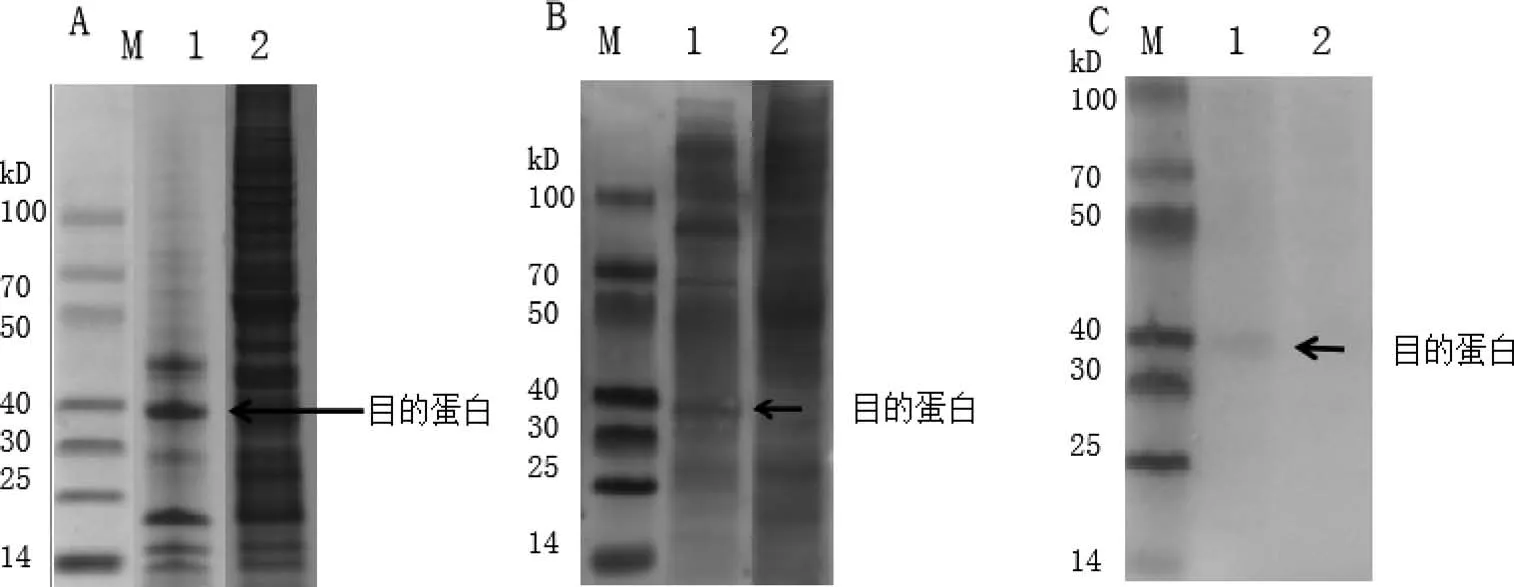
图3 Erns基因表达产物的SDS-PAGE及Western-Blotting鉴定

图6 不同收获时间及不同MOI对Erns蛋白表达量的影响

图7 纯化后的Erns蛋白的SDS-PAGE分析
1.2.10 猪瘟阳性血清的检测 将纯化后的Erns蛋白采用适宜浓度进行包被,并对3份猪瘟阳性血清和3份阴性血清进行检测,平均P/N值为4.74,说明采用Erns蛋白建立的间接 ELISA方法能够有效的区分猪瘟阳性血清和阴性血清(图9)。

图8 纯化后Erns蛋白的Western Blotting鉴定
2 讨论

图9 猪瘟阳性血清与Erns蛋白表达抗原的ELISA反应结果
猪瘟对我国养猪业造成巨大危害,根据《国家猪瘟防治指导意见(2017-2020年)》,2020年底,全国所有种猪场和部分区域要达到猪瘟净化标准。传统的疫苗虽能有效防控猪瘟但不具备能够鉴别自然感染与疫苗免疫的功能,因此需要开发新型DIVA疫苗和与之相应配套的检测Erns抗体的ELISA方法,以促进猪瘟的净化和最终根除。CSFV的E2蛋白是猪瘟病毒的主要保护性抗原蛋白,参与猪瘟病毒感染过程并诱导机体产生中和抗体,也是DIVA疫苗研究的重要靶蛋白。Erns蛋白也能刺激机体产生中和抗体,因此是鉴别诊断猪瘟野毒感染与疫苗免疫的靶抗原。而NS3蛋白在所有的猪瘟病毒属病毒中相对保守,其刺激机体产生的抗体会与其他属的病毒发生交叉反应,因此不能作为鉴别诊断的理想抗原。
糖基化反应是蛋白质修饰的最普遍的类型之一。CSFV的Erns蛋白包括7个糖基化位点,分别在2、7、11、65、95、143,158 位。 病毒蛋白的糖基化会影响免疫反应的产生及蛋白的天然构象,所以得到正确糖基化的Erns蛋白对于CSFV诊断方法的建立以及新型标记疫苗的研发具有重要意义[18]。由于真核表达系统具有翻译后的修饰作用,因此更容易获得具有生物活性的蛋白产物。本试验选择杆状病毒表达系统,该系统具有表达产物产量高、生物活性好、产物接近天然构象等优势[19-20]。使用 Erns单抗进行Western Blotting鉴定,目的蛋白的大小约为37 kD,这比非糖基化的Erns蛋白分子量(约25 kD)大,结果证明,获得的重组Erns蛋白发生了糖基化。
在本试验采用亲和层析技术对Erns蛋白进行纯化。纯化开始前,先使用超滤管对收集的含有目的蛋白的细胞裂解上清液进行浓缩。目的蛋白带有6×His标签,其与特定配基结合使得杂蛋白流过柱子,达到分离纯化的效果。而且6×His标签的大小可以忽略不计且不具备免疫源性,纯化后的蛋白可以直接免疫动物[21]。但是单一使用亲和层析的方法进行纯化的效果不是最好,会得到一些非目的蛋白,将多种纯化方法进行排列组合可能会取得更好的效果。有研究表明,蛋白纯化投入的成本能占到整个基因工程产品的70%左右[22],因此蛋白纯化技术会是未来医药研发的突破口。
本研究成功利用杆状病毒系统实现猪瘟病毒Erns蛋白的高效表达,并通过亲和层析技术得到了纯度良好、具有生物活性的纯化的Erns蛋白。经Western Blotting鉴定,纯化后的Erns蛋白具有良好的反应原性,为今后进一步建立与DIVA疫苗相配套的检测Erns抗体的ELISA方法奠定了基础;也为Erns蛋白的结构和生物学功能研究奠定了重要基础。
