siRNA基因沉默ASIC1a对过敏性紫癜(HSP)患儿血清IgA1诱导的血管内皮细胞损伤的保护作用*
2019-06-03袁丽萍李玉飞戴寒晶
闫 波,袁丽萍,张 琴,华 冉,李玉飞,戴寒晶
(1.安徽医学高等专科学校医学技术系;2.安徽医科大学第一附属医院儿科,安徽 合肥 230000)
过敏性紫癜(Henoch-Schonlein syndrome, HSP)是儿童时期最常见的一种系统性小血管炎综合征,其病理生理机制为IgA1免疫复合物沉积在血管壁导致血管内皮细胞损伤、功能屏障为主的全身免疫性小血管炎症[1]。炎症伴随着组织酸化,我们前期研究证实HSP患儿皮肤血管内皮中存在ASIC1a的高表达,ASICs阻断剂Amiloride可以显著抑制HSP患儿血管内皮细胞细胞因子的分泌,改善血管内皮细胞的损伤[2-3]。本研究在血管内皮细胞中靶向沉默ASIC1a,观察其对HSP患儿血管内皮细胞细胞因子、骨架蛋白的影响,进一步探讨HSP血管炎发生的分子机制。
1 材料与方法
1.1实验材料
1.1.1细胞株及试剂人皮肤微血管内皮细胞HDMVEC 购自美国ATCC公司,重组穿梭质粒和包装质粒 pGag/Pol、 pRev、 pVSV-G 由上海吉玛制药技术有限公司构建制备, ECM 细胞培养基、胎牛血清(FBS)、胰酶购自美国Hyclone公司,Lipofectamine 2000转染试剂、TRIzol及M-MLV 反转录试剂盒均为美国Invitrogen公司产品。
1.1.2HSP患儿及正常儿童IgA1的分离收集6例HSP患儿(6~13岁,男3例,女3例)及6例正常健康同龄儿童血清,参照文献[3]采用Jacalin 亲和层析法及蛋白纯化法提取血清IgA1。
1.1.3慢病毒siRNA表达载体的构建及重组慢病毒包装根据ASIC1a(NM_020039)的RNA 序列信息,由上海吉玛制药技术有限公司按RNA干扰序列设计针对序列的si-RNA,根据ASIC1a序列(5' -GCCAAGAAGT TCAACAAATCT-3' )设计并合成2条互补的、编码shRNA的DNA单链,退火后连接到慢病毒载体pshRNA。合成好的互补双链克隆至表达载体pshRNA,一组 siRNA 序列的错义序列(5' -TTCTCCGAACGTGTCACG T-3' )作为阴性对照,构建阴性对照载体。重组克隆经测序后进行无内毒素质粒DNA 提取,提取过程严格按照试剂盒说明书进行,重组质粒分别命名为pshRNA-ASIC1a、pshRNA-NC。
重组慢病毒制备:采用293 T细胞制备重组慢病毒, 取对数生长期细胞, 胰酶消化并计数后,取2×106个细胞接种于10 cm 培养皿,加入含 10%FBS的DMEM培养基10 mL,37 ℃、5%CO2条件下培养过夜。在5 mL离心管中加入1.5 mL无血清DMEM,加入含目的序列的穿梭质粒和包装质粒(pGag/Pol、 pRev、 pVSV-G),混匀;在另一支5 mL离心管中加入1.5 mL无血清 DMEM, 再加入300 μL RNAi-Mate,混匀,室温放置 5 min后将两管混合,室温放置 20~25 min。待细胞80%~90%融合时,按照 Lipofectmaine 2000转染试剂说明书进行操作。转染后72 h, 收集细胞上清液, 用 0.45 μm过滤器过滤按照梯度稀释法测定滴度,- 80 ℃冰箱保存。2组病毒分别命名为LV3-NC 和LV3-sh-ASIC1a。
1.1.4HDMVEC细胞的培养及分组HDMVEC 细胞培养在含 10%胎牛血清, 100 U·mL-1青霉素,100 μg·mL-1链霉素的ECM 培养基中,37 ℃、5%CO2的细胞培养箱中培养。当细胞长至 80%~90%时,去除培养基,加入PBS 洗 1~2 次,去除PBS后,加入1 mL胰酶消化 1~3 min 后,加入3 mL完全培养基中和胰酶终止消化,将消化的细胞转移至 15 mL离心管中,1 000 rpm 离心 5 min。倒掉上清加入3 mL培养基重悬细胞,1∶3 传代至培养皿中培养。
取对数生长期的细胞进行转染,将细胞分为无病毒转染对照组(NC组)、LV-h-ASIC1a转染组(si-ASIC1a组)。 转染前1 d,接种 HDMVEC 细胞到6 孔板,每孔 5×105细胞,37 ℃、5% CO2过夜,进行病毒转染,12~24 h移去细胞侵染后的病毒液,加入细胞培养液继续培养,感染 72 h 后,荧光显微镜下观察细胞转染情况,RT-PCR法测定转入基因ASIC1a的表达。
将细胞分为NC组, NC+正常健康儿童血清IgA1 (NC+ serum) 组,NC+HSP患儿血清IgA1 (NC+ HSP) 组,si-ASIC1a组,si-ASIC1a+正常健康儿童血清IgA1 (si-ASIC1a+ serum) 组,si-ASIC1a+HSP患儿血清IgA1 (si-ASIC1a+ HSP) 组,在转染后的细胞中加入正常儿童或HSP患儿血清IgA1 (250 μg·mL-1)培养12 h,用无血清细胞培养液培养6 h,收集细胞上清,ELISA法测定其上清中TNF-α、IL-8水平;收集细胞,real-time PCR和 Western blotting 分别检测细胞骨架蛋白(SM-α, Destrin, Vinculin, ML-CK)mRNA及蛋白表达水平。
1.1.5Real-timePCR测定ASIC1a及细胞骨架蛋白SM-α,Destrin,Vinculin,ML-CKmRNA表达收集好的细胞按照Trizol法提取总RNA,按照试剂盒说明书将RNA逆转录为cDNA,后进行荧光定量PCR扩增,ASIC1a引物:F-GAGATACCAGACACACAGATGG,R-CACGCATGTTGAAGGGTTTG(扩增长度:100 bp);SM-α引物:F-AGGGAGTGATGGTTGGAATG,R-GATGATGCCGTGTTCTATCG(扩增长度:200 bp);destrin引物:F-GTAAATGCTCCACACCAGAAGA,R-CACCAACATCTCCAA CCAAGA(扩增长度:123 bp);Vinculin引物:F-GAACATCAGACCTGCTCCTTAC,R-TTCCATAGTCTCCACCACCT(扩增长度:113 bp);MLCK引物:F-GCTGCCT GACCACGAATATAA,R-CATCTGACACCTCCACTTCATC(扩增长度:137 bp);GAPDH引物:F-CTTTGGTATCGTGGAAGGACTC,R-AGTAGAGGCAGGGATGATGT(扩增长度:133 bp)。荧光定量PCR反应体系包括cDNA 2 μL,PCR上游及下游引物(10 μm)0.4 μL,SYBR Green solution 10 μL,ddH2O 7.2 μL,总体积20 μL,置于PCR仪中,反应条件为:95 ℃ 10 min,95 ℃ 5 s,60 ℃ 1 min,40个循环。95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,溶解曲线。根据 CT值算出 2-△△ct, -△△ct=N目的-N内参-T目的+T内参(N目的=正常组目的基因,N内参=正常组内参基因,T代表是实验组),然后各组间用 2-△△ct结果进行比较。
1.1.6Westernblotting检测细胞骨架蛋白SM-α,Destrin,Vinculin,ML-CK蛋白表达收集好的细胞加入500 μL RIPA 裂解液提取蛋白(每1 000 μL RIPA 中加入10 μL PMSF),按照BCA 测定试剂盒测定提取蛋白的浓度,将蛋白加入SDS-PAGE蛋白上样缓冲液,后将蛋白转移至PVDF膜上,将膜移至含有封闭液(5%脱脂奶粉TBST 溶液)的平皿中封闭1 h,然后与1∶1 000兔抗人多克隆抗体SM-α、destrin、Vinculin、MLCK于4 ℃孵育过夜,再与HRP标记的辣根过氧化物酶标记山羊抗兔 IgG(1∶5 000)室温孵育 2 h,采用 Thermo ECL 进行化学发光显色,结果测定用Quantity One软件分析。

2 结 果
2.1HDMVEC细胞慢病毒转染荧光显微镜结果显示HDMVEC细胞72 h基因转染率为100%,如图1。RT-PCR结果显示病毒转染72 h后,与NC组比较, ASIC1a转染组(si-ASIC1a组)细胞内ASIC1a mRNA表达明显降低(P<0.01),如图2。
2.2ASIC1a沉默对HSP血清IgA1诱导HDMVEC细胞表达TNF-α和IL-8的影响与NC对照组及NC+ serum组比较,NC+HSP组HDMVEC细胞培养上清中TNF-α和IL-8水平显著增加,si-ASIC1a、si-ASIC1a+正常血清IgA1(si-ASIC1a+serum)、si-ASIC1a+HSP血清IgA1(si-ASIC1a+HSP)组细胞培养上清中TNF-α和IL-8水平明显下降(P<0.01); 与NC+HSP组比较,si-ASIC1a+HSP组细胞培养上清中TNF-α和IL-8水平亦显著降低(P<0.01),提示ASIC1a沉默可以显著抑制HDMVEC细胞炎性细胞因子的分泌。如图3。

图1 HDMVEC细胞病毒转染效率

注:与NC组比较P<0.01。
2.3ASIC1a沉默对HSP血清IgA1诱导HDMVEC细胞骨架蛋白表达的影响与NC对照组比较,HSP血清IgA1可以降低HDMVEC细胞骨架蛋白SM-α、destrin、Vinculin、MLCK mRNA(图4)和蛋白的表达(图5) (P<0.01);沉默HDMVEC细胞ASIC1a,细胞骨架蛋白mRNA(图4)及蛋白表达明显增加(图5) (P<0.01);HSP血清IgA1对沉默ASIC1a的HDMVEC细胞,其细胞骨架骨架蛋白mRNA(图4)及蛋白表达明显增加(图5) (P<0.01),但与si-ASIC1a细胞组比较,其细胞骨架骨架蛋白mRNA(图4)及蛋白表达降低(图5) (P<0.01)。

注:与NC组比较**P<0.01;与si-RNA组比较##P<0.01;与NC+HSP组比较▲▲P<0.01。
图3ASIC1a沉默对HSP患儿血清IgA1诱导细胞表达TNF-α和IL-8的影响(n=6)
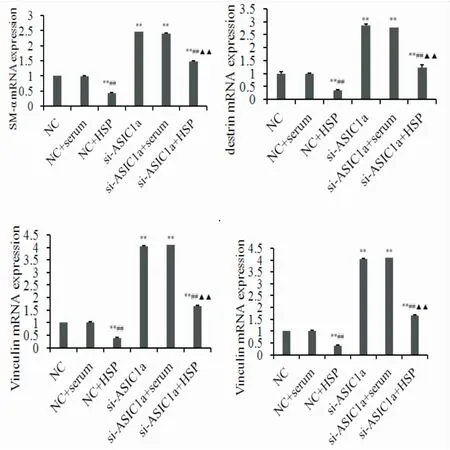
注:与NC组比较**P<0.01;与si-RNA组比较##P<0.01;与NC+HSP组比较▲▲P<0.01。

注:与NC组比较**P<0.01;与si-RNA组比较##P<0.01;与NC+HSP组比较▲▲P<0.01。
3 讨 论
ASICs是一类由胞外H+激活的阳离子通道,在某些病理反应如局部缺血、炎症、癫痫等过程中发挥重要作用,在这些病理反应中共同的特点是组织酸化,激活的ASICs 导致胞外Na+、 Ca2+内流并激发各种病理生理效应[4]。研究证实在HSP发生发展过程中, IgA形成的循环免疫复合物,尤其是IgA1作用于HSP患儿血管内皮细胞,导致血管内皮细胞损伤,促使血小板的激活,并释放IL-8、 NO、 TM等血管活性物质,形成微血栓,加重局部缺血,乳酸等酸性代谢产物增多,引起局部pH下降[5]。我们研究发现HSP患儿局部组织酸化可以激活其皮肤血管内皮细胞中ASIC1a及ASIC3表达[6];体外研究发现HSP血清IgA1可以刺激细胞外酸化的人皮肤微血管内皮细胞(HDMVEC)中 ASIC1a、 ASIC3 mRNA 及蛋白表达,抑酸剂奥美拉唑及西米替丁可以明显促进 HSP 患儿皮疹消退[7],提示 ASICs 可能对 HSP 患儿血管损伤发挥一定的调控作用。
RNAi技术是通过特异性剔除或关闭特定基因的表达探索该基因的功能,本研究中我们把ASIC1a基因的siRNA序列转染入HDMVEC细胞中进行ASIC1a基因沉默,发现转染ASIC1a基因siRNA后,HDMVEC细胞ASIC1amRNA表达明显低于空质粒转染 (NC) 组,说明基因沉默成功。本研究中我们发现转染ASIC1a基因siRNA可以抑制HSP患儿血清IgA1刺激后的HDMVEC细胞TNF-α及IL-8分泌。既往研究已经明确在HSP急性期其体内TNF-α和IL-8增加,这些炎症细胞因子增加促进了血管炎的发生,参与了HSP的发生及发展[8]。我们研究亦发现HSP患儿血清IgA1与HDMVEC细胞共培养,细胞培养上清中TNF-α和IL-8水平明显增加,ASIC1a基因siRNA转染HDMVEC与HSP患儿血清IgA1共培养,培养上清中TNF-α和IL-8水平显著下降,说明沉默ASIC1a可以抑制或减轻HSP患儿体内IgA1沉积介导的血管炎的发生。
为进一步探讨ASIC1a在HSP患儿血管内皮细胞损伤中的作用,我们测定了转染后HDMVEC细胞骨架蛋白SM-α、destrin、Vinculin、MLCK mRNA和蛋白表达。研究发现酸化的细胞外环境导致血管内皮细胞行为的改变,从而引起细胞骨架蛋白的改变,致使血管损伤和功能丧失[9]。本研究发现HSP患儿血清IgA1可以抑制HDMVEC细胞骨架蛋白SM-α、destrin、Vinculin、MLCK mRNA和蛋白表达,HSP患儿血清IgA1和ASIC1a基因siRNA转染HDMVEC共培养可以促进SM-α、destrin、Vinculin、MLCK mRNA和蛋白表达,提示沉默ASIC1a基因siRNA可以保护HSP患儿血管内皮炎症性损伤。
综上,ASIC1a在HSP血管炎发生发展过程中发挥重要的调节作用,沉默ASIC1a可以改善HSP患儿血管内皮细胞损伤,ASIC1a是一个颇具潜力的基因治疗靶点。
