中高温α-淀粉酶热稳定性的研究进展
2019-05-23曹慧慧胡珈玮王进军
曹慧慧,胡珈玮,桂 波,王进军
(扬州大学 环境科学与工程学院,江苏 扬州 225172)
1 引言
α-淀粉酶是一种液化型、内切型淀粉酶,作用于淀粉时以无规则的方式切开其内部α-1,4糖苷键,使得淀粉粘度快速下降成为液化淀粉且不再与碘有呈色反应,生成物为糊精以及少部分还原糖,由于产生的还原糖在光学结构上是α-型,因此该水解酶被称作α-淀粉酶。目前对于常温、中温和耐高温α-淀粉酶的分级温度尚没有一个严格的界定,一般认为最适反应温度在60 ℃以上的为中高温型α-淀粉酶,在啤酒酿造、酒精工业、纸浆和造纸业等行业中应用广泛,耐高温α-淀粉酶甚至在95~105 ℃间依然可以保持高酶活,其更大的耐热潜力仍有待探究。淀粉的酶转化工业包括三个步骤——糊化、液化与糖化[1]。在高温下加热淀粉溶液即可达到淀粉糊化的目的,而液化和糖化过程需要相应酶的参与,此时为了避免过长的冷却时间,就需要一批在较高温度下仍能保持相对稳定的淀粉酶,因此筛选或改造出热稳定性高的α -淀粉酶对淀粉转化工业的发展进步具有重大意义。
2 α-淀粉酶的来源
如今应用于工业上的中高温α-淀粉酶大多是微生物来源。来源于动物、植物、微生物的α-淀粉酶其酶解适温分别在40~50 ℃、35~40 ℃、60 ℃以下,当然,微生物界由于生存环境遍布火山深海、极地荒漠等条件极端的地区,不乏具有极端嗜热、耐酸碱、耐低温等特性的α-淀粉酶产生菌。如某些生存在火山口、温泉、堆肥区等高温环境中的微生物,体内含有丰富的热稳定性酶,有待探寻和研究。细菌、真菌(丝状真菌)、酵母菌以及放线菌等微生物都能产生α—淀粉酶,其中能够满足工业生产条件并已经投入应用的α-淀粉酶多来源于细菌和丝状真菌。
2.1 细菌α-淀粉酶
细菌α-淀粉酶在淀粉加工业中主要是起到液化和降低淀粉粘度的作用。芽孢杆菌属通常被认为是中高温α -淀粉酶的优良生产菌属,如枯草芽孢杆菌(Bacillussubtilis)、地衣芽孢杆菌(Bacilluslicheniformis)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、嗜热脂肪芽孢杆菌(Bacillusstearothermophilus)等,表1所列为部分芽孢杆菌属来源的α -淀粉酶及其最适反应温度。

表1 芽孢杆菌属来源的α -淀粉酶及其最适反应温度
2.2 真菌α-淀粉酶
相较于细菌,真菌来源的α-淀粉酶可以水解麦芽三糖,生成麦芽糖和其他低聚寡糖,因此广泛应用于麦芽糖浆的生产工业中。真菌α-淀粉酶的反应温度多在50~55 ℃间,反应温度温和、耐热性较低,少部分具有耐热性质的真菌α-淀粉酶在60 ℃以上的作用温度下仍能保持良好的热稳定性。与中性酶相比,耐热性淀粉酶在液化、糖化等淀粉深加工过程中能够避免在中温反应条件下极易发生的染菌问题并且降低了生产成本[12]。表2为部分真菌来源的α-淀粉酶及其最适反应温度。
3 影响α-淀粉酶热稳定性的因素及提高方法
3.1 影响α-淀粉酶热稳定性的因素
α-淀粉酶本质上是一种拥有催化功能的蛋白质,各种不利环境条件如高低温、辐射、抑制剂的存在等都会影响其催化活性,尤其是在一定高温条件下极易失活,这种对热的不稳定性严重影响其应用。任何可能会致使酶蛋白空间结构发生变化的因素都会影响到酶的热稳定性,如酶液中底物的浓度、反应液的pH值、添加剂种类和浓度等。当水解淀粉的反应液中能够保持较高的淀粉浓度,酶的热稳定性和活力都会有所提高;霉菌中的黑曲霉在偏酸性条件下的热稳定性要明显高于中碱性条件下的,而米曲霉则相反,在pH值为2.5、55 ℃条件下活性几乎完全丧失,而在pH值为7.0条件下可15 min不失活[19]。研究发现,反应液中加入羧酸类添加剂如二苯基乙酸钠可以提高α-淀粉酶的热稳定性使得高温下半衰期延长,且该特性随着羧酸链长增加而增加[20]。

表2 部分真菌来源的α-淀粉酶及其最适反应温度
3.2 提高α-淀粉酶热稳定性的途径
从根本上说,α-淀粉酶的热稳定性与其在高温状态下多肽链的特性和空间立体结构的变化有关,所以利用蛋白质工程技术对酶进行理性设计是如今提高酶热稳定性或达成其他特质的改造目的最根本性的方法。研究表明,一些热稳定性良好的α-淀粉酶在分子水平上有几点共同的特征。
(1)Ca2+、Zn2+等金属离子结合位点的存在。当在降解淀粉的反应液中加入部分Ca2+时,很多α-淀粉酶的热稳定性会得到明显提高,说明了α-淀粉酶对钙离子的依赖性[21]。如来源于地衣芽孢杆菌的α-淀粉酶具有优良的催化活力和耐热性能而被广泛应用,但却十分依赖于Ca2+。在赵荧等[22]的研究中,发现Ca2+不仅参与α-淀粉酶的催化作用,还能对酶结构起稳定作用。曾静等[23]对一来源于极端嗜热古生菌KOD1的α-淀粉酶Apk A进行氨基酸序列分析后,对其多个Ca2+结合位点进行定点突变,结果显示突变体在90 ℃和100 ℃下的热稳定性均有明显下降,原酶在90 ℃下半衰期为5 h,而突变体只有2 h,表明原酶中的具有高亲和力的Ca2+结合位点对该酶热稳定性具有重要意义。曾静等[24]同样基于定点突变技术向一嗜热α-淀粉酶Apk A的两个氨基酸残基中引入PFA的Zn2+结合位点,构建一双位点突变体,其中PFA是目前已知的耐热性最强的α-淀粉酶。结果显示该突变体的热稳定性有显著提升,在90 ℃下的热失活半衰期由5h提高至10,100 ℃下半衰期达到80 min,为原酶的十倍。
(2)较多的氢键数目。杨倩等[25]对一米根霉产α-淀粉酶ROAmy的氨基酸残基进行了定点突变,几株突变体的酶活及耐热性能都有显著的提高,其中一性能优秀的突变体G128L/K269L/G393P在55 ℃下的热失活半衰期提升约为原酶的5.63倍,经过结构分析,得出在特定位置引入脯氨酸以及增加氢键数目可能对酶热稳定性提高具有重要意义的结论。
除此之外,α-淀粉酶分子内紧凑的空间结构,α-螺旋的稳定结构,相较于不耐热α-淀粉酶更多的疏水性氨基酸等特征都有利于酶的热稳定性。
除了在分子水平上对α-淀粉酶进行定点突变、修饰酶的遗传特性等从根本上改造酶的方法外,通过添加热稳定剂来提高α-淀粉酶耐热性是一种简单有效的方法。在王爱平[26]的研究中,发现α-淀粉酶的失活过程符合一级失活动力学方程:A=Amaxexp(-Kpt),其中Amax为初始酶活,Kp为失活系数。而在加入热稳定剂(醋酸钙、乳酸钠、壳聚糖、L-组氨酸)后,该酶的热失活动力学不再严格符合上述反应式,失活速度有不同程度的减缓。各热稳定剂对该酶在高温下的半衰期有很大影响,已知原酶在70 ℃的半衰期为1.8 min,表3为加入不同热稳定剂后α-淀粉酶在70 ℃下的半衰期及提高倍数。
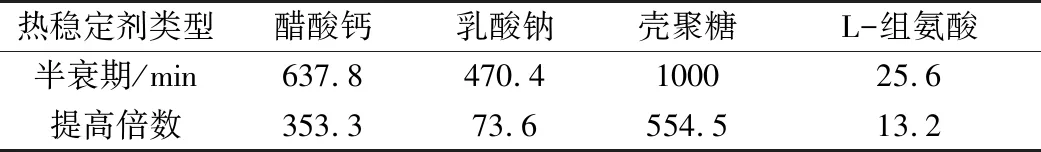
表3 70 ℃不同热稳定剂对α-淀粉酶的效果
