基于实时荧光环介导等温扩增快速检测鸡肉中的大肠杆菌O157:H7
2019-05-18赵远洋林丽萍郜彦彦吴国平
赵远洋 王 瑾 林丽萍 郜彦彦 吴国平
(江西农业大学食品科学与工程学院 南昌市农产品加工与质量控制重点实验室 南昌330045)
大肠杆菌(E.coli)O157:H7 是肠出血性大肠杆菌中最常见的血清型,也是其多种血清型中最主要的致病菌株,感染剂量低于5 CFU[1-2]。感染该菌可使人患腹泻、出血性结肠炎(hemorhabic colitis,HC),还可引发溶血性尿毒综合征(hemolytic uremic syndrome,HUS)及血栓性血小板减少紫癜(thrombotic thrombocytopenic purpura,TTP)等严重并发症,致死率达5%~10%[3]。自1983年美国Riley 等[4]首次报道肠出血性大肠杆菌O157:H7以来,相继在英国、加拿大、日本、德国等多国出现爆发性流行病例。我国自1986年江苏徐州市首次报道大肠杆菌O157:H7 感染以来,广西、海南、广东等地都先后出现并分离到大肠杆菌O157:H7[5]。在世界范围内,家畜及其肉制品是大肠杆菌O157:H7 主要的传播途径,其中鸡、牛、猪等是该菌主要感染对象[6]。如何快速检测食品尤其是肉类食品中污染的大肠杆菌O157:H7,是有效防控大肠杆菌O157:H7 食源性疾病爆发的必要条件。
目前检测大肠杆菌O157:H7 的方法主要有传统分离培养、免疫学和分子生物学检测[7-9]。这些方法在不同的检测要求下都有各自的优点,也都存在不足,比如耗费时间长,操作过程繁琐及检测灵敏度低等。环介导等温扩增技术自2000年日本科学家Notomi 发明以来[10],因其可在等温条件下数十分钟内完成核酸的高倍扩增,从而成为继PCR 技术之后又一新型快速、 简便的分子生物学检测技术。目前各国研究人员在此基础上发展出多种病原菌的LAMP 检测方法,比如副猪嗜血杆菌(Haemophilus parasuis)[11]、沙门氏菌[12]、人乳头瘤病毒(HPV16)[13]、副溶血性弧菌[14]等。与PCR 等其它方法相比,LAMP 有独特的优点,如在等温条件下即可完成扩增反应,反应时间短 (40~60 min),灵敏度较高,反应温度较低(60~65 ℃),甚至可肉眼直接判断反应结果[15]。
许多研究表明,食品中存在多种水溶性DNA聚合酶抑制剂,会干扰PCR 等分子生物学方法检测食品中致病菌。活性炭是一种具有较大表面积、复杂孔隙结构的物质,具有良好的吸附性能,可以用来消减干扰PCR 聚合酶活性的抑制剂[16]。由于活性炭同时能吸附细菌,所以需对其表面进行适当封闭,从而防止细菌被吸附。据文献[17]报道,使用蒙脱石封闭的活性炭可以消减食品中抑制剂,不影响食品中细菌的回收。
Midori Green 是一种新型的核酸荧光染料,具有灵敏性高,毒性低,安全性好的优点,而利用该染料进行实时荧光定量LAMP 法 (Rti-LAMP)的报道不多[18]。本研究采用Midori Green 为核酸染料,建立大肠杆菌O157:H7 的Rti-LAMP 检测技术;通过模拟鸡肉污染大肠杆菌O157:H7,建立基于Rti-LAMP 检测鸡肉样品中的大肠杆菌O157:H7 并与国标检测法进行对比。
1 材料与方法
1.1 材料与试剂
大肠杆菌O157:H7 ATCC BAA-708 菌株,本实验室保存;鸡脯肉样品,市场购买;月桂基硫酸盐胰蛋白胨肉汤(LST)、EC 肉汤等,青岛高科园海博科技有限公司产品;胰蛋白酶大豆肉汤(TSB),美国Difco 公司;Bst DNA polymerse,新西兰Biolabs 公司;Midori Green,dNTPs,Bulldog Bio公司;2×Taq Master Mix,上海欣百诺生物科技有限公司;Whirl-Pak 均质过滤袋,美国Nasco 公司;八 连 管,BIO-RAD;Activated carbon (Filtrasorb 200),美国Calgon Carbon 公司。
1.2 仪器与设备
拍击式均质机,AES chemuex 公司;紫外可见分光光度计(WFZ-UV-2100),尤尼科(上海)仪器有限公司;GL-21M 高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;XB-150B 全自动雪花制冰机,宁波新艺超声设备有限公司;凝胶成像系统,法国Vibler Lourmat 公司;电泳仪(EPS300)、电泳槽(VE-180),上海天能科技有限公司;荧光PCR 仪,CFX Connect Real-time System,BIORAD。
1.3 方法
1.3.1 引物设计与合成 针对大肠杆菌 O157:H7 (VT2)基因,参考Hara-Kudo 等[19]设计了6 条特异性引物用于Rti-LAMP,包括两条内引物(FIP/BIP),两条外引物(F3/B3),两条环引物(Loop F/ Loop B),详见表1。引物由北京鼎国生物技术有限公司合成。
1.3.2 细菌培养、计数及细菌DNA 提取 将活化的大肠杆菌O157:H7 接种于3 mL TSB 液体培养基中,37 ℃,150 r/min 过夜培养16~18 h,以3%菌液量转接于10 mL TSB 液体培养基,37 ℃,150 r/min 培养1.5 h 左右至对数期细菌(OD600≈0.5)。将菌液用灭菌的生理盐水按10 倍梯度依次稀释,取100 μL 涂于平板,培养18~24 h 细菌计数,测定OD600的数值,建立OD600值与菌浓度的标准曲线。
细菌总DNA 制备,生理盐水稀释的细菌500 μL 加入500 μL 2×TZ 裂解液[20],于99.5 ℃下加热10 min,冰上冷却后高速离心5 min,取上清即为细菌DNA 模板。

表1 LAMP 引物Table 1 Primers used in the Rti-LAMP
1.3.3 Rti-LAMP 反应 Rti-LAMP 反应体系总体积 为25 μL:2.5 μL 10×buffer,5 μL 25 mmol/L MgCl2,2.5 μL 12.5 mmol/L dNTPs,2 μL 20 mmol/L FIP,2 μL 20 mmol/L BIP,0.4 μL 20 mmol/L F3,0.4 μL 20 mmol/L B3,1.2 μL 20 mmol/L Loop F,1.2 μL 20 mmol/L Loop B,1 μL 1 ∶500 稀释的荧光染料Midori Green,0.9 μL Bst 聚合酶,2 μL DNA 模板,无菌去离子水补足至25 μL。制备好的反应管放入BIO-RAD CFX Connect Real-time System 内65 ℃扩增反应60 min。每分钟读取荧光数值,设定样品荧光值出现指数增加的时间为Tp值(类似于Rti-PCR 的Ct 值)[21-22],测定Tp 值与细菌浓度之间关系函数。
1.3.4 琼脂糖凝胶电泳 Rti-LAMP 产物上样于2%琼脂糖凝胶,将1 μL 的Midori Green 原液加入到20 mL 琼脂糖凝胶后进行电泳。电泳条件为:电压80 V,电流60 mA,时间35 min,取出置于凝胶成像系统拍照观察。
1.3.5 蒙脱石封闭活性炭(BCAC)的制备 16 g活性炭用蒸馏水冲洗至流水无色,放入烘箱烘干待用。取蒙脱石4 g 加蒸馏水200 mL,振荡摇匀至完全溶解,转移至250 mL 离心杯中室温下700 r/min,1 min,将上清液倒入加了上述活性炭的三角瓶中,37 ℃下150 r/min,振荡3 h。然后转移到55℃烘箱中烘干备用。
1.3.6 模拟大肠杆菌O157:H7 污染鸡肉样品 取25 g 经国标检测大肠杆菌O157:H7 阴性的鸡肉样品,置于装有75 mL PBS(50 mmol/L)缓冲液的Whirl-Pak 均质过滤袋中,加入生理盐水稀释至适宜浓度的大肠杆菌O157:H7 0.5 mL,以制备浓度为0,140,450,1 400,4 500,14 000,45 000 CFU/g的人工模拟污染样品,将均质袋置于均质机中,37℃下拍打1 min,随后放入37 ℃的水浴增菌4 h。样品过滤液转移至离心杯中,800 r/min 离心5 min,上清液通过含0.5 g 玻璃棉的灭菌注射器过滤,取过滤液用于样品中细菌DNA 的提取。
1.3.7 封闭活性炭对鸡肉样品前处理 模拟大肠杆菌O157:H7 污染鸡肉样品的步骤见1.3.6 节,但不经过增菌培养。滤液转移至离心杯中,10 000 r/min 离心5 min,除去上清,用30 mL PBS(50 mmol/L)缓冲液重悬,加入4 g 制备的BCAC,37℃150 r/min 振荡15 min,用含0.2 g 玻璃棉的灭菌注射器过滤,取过滤液用于样品中细菌DNA 的提取。
1.3.8 样品中细菌DNA 的提取 将过滤液于10 000 r/min 下离心5 min,弃上清,沉淀重悬于0.5 mL 生理盐水,加入等体积2×TZ 裂解液,混匀后于99.5 ℃下加热10 min,冰浴2 min 后12 000 r/min 离心10 min,上清即为样品DNA 模板,取2 μL 作为Rti-LAMP 反应模板。
1.3.9 临床鸡肉样品的对比检测 从市场上购买51 份冷冻鸡肉样品,利用增菌Rti-LAMP、封闭活性炭预处理未增菌的Rti-LAMP 和国标法(GB 4789.38-2012 食品安全国家标准食品微生物学检验),同时检测这些鸡肉样品中大肠杆菌O157:H7污染情况。
2 结果与分析
2.1 大肠杆菌O157:H7 的Rti-LAMP 检测方法建立
以大肠杆菌 O157:H7 裂解液为模板,结合Midori green 核酸荧光染料,通过设计的6 条特异性引物进行Rti-LAMP 反应,其结果显示阳性样品在30 min 之内出现荧光值呈指数增加,而阴性样品则没有荧光指数增加现象。为测定Rti-LAMP的灵敏度,设置了0,1.1,3.5,11,35,110,350 CFU/管,共7 个梯度,结果表明3.5 CFU/管可稳定扩增检出,低于该浓度则检出稳定性不够,故该Rti-LAMP 的检测灵敏度为3.5 CFU/管(图1)。以荧光值500 作为衡量各反应荧光指数增加出现的时间(Tp 值),以Tp 值为纵坐标,lg(CFU/管)为横坐标,则细菌CFU 与Tp 值之间的线性回归方程为Y=-2.1632X+22.655,决定系数R2=0.9896,表明在3.5~350 CFU/管范围内,其细菌浓度与其相应的Tp 值具有良好的线性关系,通过Rti-LAMP的Tp 值可实现定量检测大肠杆菌O157:H7(图1)。大肠杆菌O157:H7 的Rti-LAMP 扩增产物电泳图如图2所示,典型LAMP 扩增产物是一系列梯度的DNA 片段混合物,在电泳图上呈现出规律的梯状条带,表明本研究建立的Rti-LAMP 法检测大肠杆菌O157:H7 具有良好的特异性。
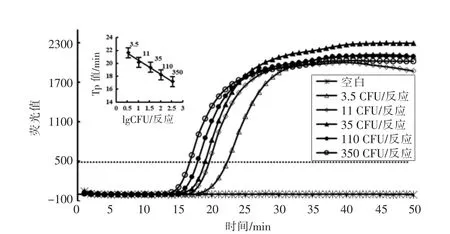
图1 典型Rti-LAMP 扩增大肠杆菌O157:H7 荧光曲线及Tp 值与lg(CFU/反应)的线性回归方程Fig.1 Rti-LAMP plots and linear detection plot of E.coli O157:H7 derived from various numbers of log phase E.coli O157:H7 cells
2.2 增菌前处理的Rti-LAMP 检测人工模拟大肠杆菌O157:H7 污染的鸡肉样品
为研究Rti-LAMP 检测鸡肉样品中大肠杆菌O157:H7 的灵敏度和特异性,本研究人工模拟大肠杆菌O157:H7 污染鸡肉样品,经37 ℃增菌4 h后,提取样品DNA 进行Rti-LAMP 检测。结果表明,Rti-LAMP 能稳定检测140 CFU/g 的样品,显示该方法检测灵敏度为140 CFU/g(图3),整个检测时间约为7 h。以Tp 值为纵坐标,lg(CFU/g)为横坐标,建立的线性回归方程为:Y=-3.9792X+31.218,决定系数R2=0.9504,表明本研究增菌前处理的Rti-LAMP 具有定量分析检测鸡肉样品中大肠杆菌O157:H7 的污染程度(图3)。如图4所示,扩增产物与纯菌扩增产物的电泳条带完全一致,说明该方法检测鸡肉中大肠杆菌O157:H7 特异性良好。

图2 Rti-LAMP 扩增产物的琼脂糖凝胶电泳图Fig.2 Product of amplicons derived from Rti-LAMP reactions by agarose gel electrophoresis
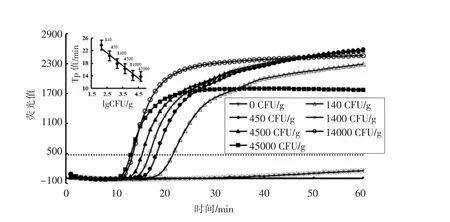
图3 Rti-LAMP 检测模拟大肠杆菌O157:H7 污染的鸡肉样品的扩增曲线及Tp 值与lg(CFU/g)的线性函数Fig.3 The fluorescence curves of the amplified products by Rti-LAMP and linear detection plot of E.coli O157:H7 derived from various numbers of seeded chicken

图4 模拟污染的鸡肉样品Rti-LAMP 扩增产物电泳图Fig.4 Product of amplicons derived from Rti-LAMP reactions in samples filtrate of chicken by agarose gel electrophoresis
2.3 封闭活性炭前处理的Rti-LAMP 检测人工模拟E.coli O157:H7污染的鸡肉样品
封闭活性炭的用量经本实验室优化[23]后,确定处理每份样品的用量为4 g。使用封闭活性炭处理人工模拟污染大肠杆菌O157:H7 的鸡肉样品,不经过增菌步骤,提取样品DNA 进行检测。结果表明,使用封闭活性炭处理后的Rti-LAMP 能稳定检测出12 CFU/g 的鸡肉样品(图5),表明经封闭活性炭预处理的Rti-LAMP 较增菌前处理的Rti-LAMP 检测灵敏度提高约10 倍。3 次重复试验,以Tp 平均值为纵坐标,lg(CFU/g)为横坐标,线性回归方程为:Y=-3.1888X+24.684,决定系数R2=0.9905,说明在12~4 000 CFU/g 范围内具有良好的可定量分析特性。
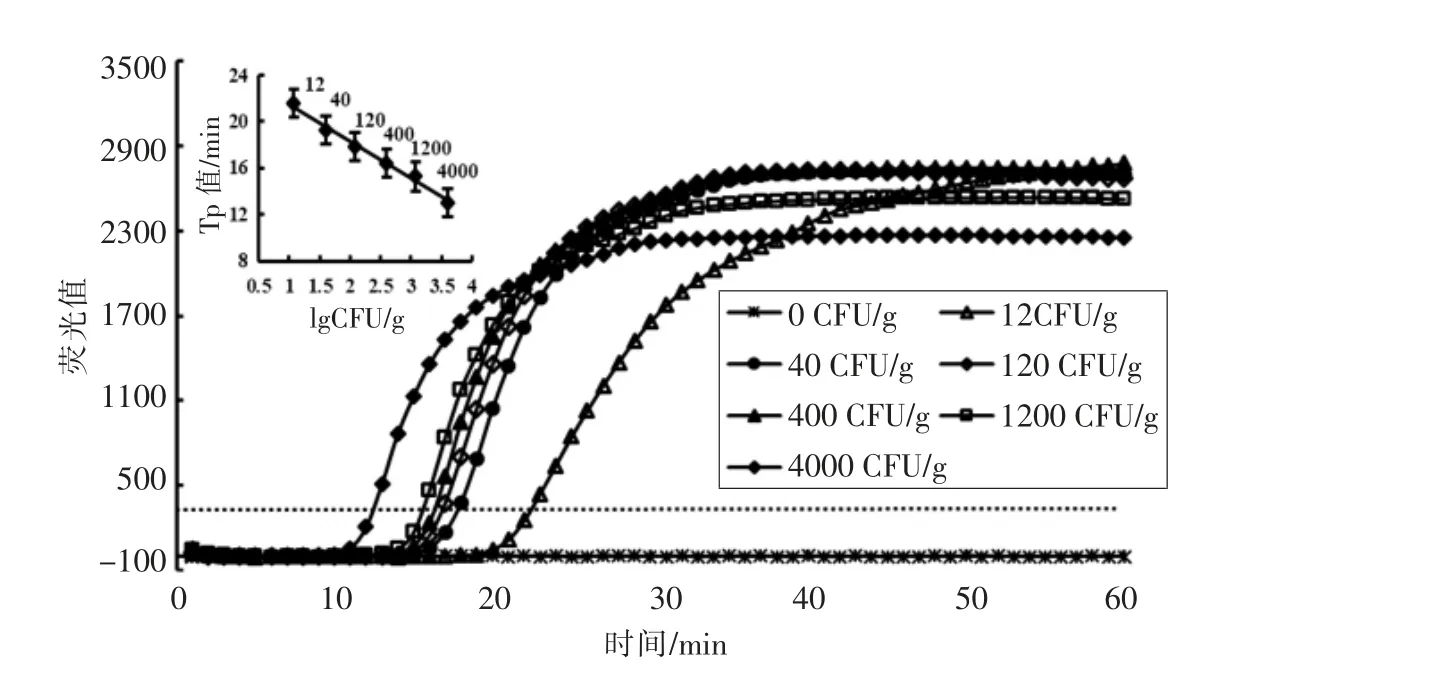
图5 经活性炭处理后Rti-LAMP 的扩增曲线及Tp 值与lg(CFU/g)的线性函数Fig.5 The fluorescence curves of the amplified products by Rti-LAMP after activated carbon treated and linear detection plot of E.coli O157:H7 derived from various numbers of seeded chicken
2.4 3 种方法对比检测临床鸡肉样品
使用上述建立的两种大肠杆菌O157:H7 的Rti-LAMP 方法和国标法进行对比检测分析,对市场上购买的51 份冷冻鸡肉样品进行大肠杆菌O157:H7 检测,检测结果见表2。结果表明,增菌前处理的Rti-LAMP 和国标法,均检测到1 份大肠杆菌O157:H7 阳性样品,且为同一份鸡肉样品;而使用封闭活性炭预处理的Rti-LAMP 法,还检测到另外7 份阳性样品(共8 份)。因此,本研究建立的鸡肉样品中大肠杆菌O157:H7 增菌前处理的Rti-LAMP 检测方法与国标法灵敏度相当,而使用封闭活性炭前处理的Rti-LAMP 检测方法则具有更高的检测灵敏度,且检测时间极大地缩短至4.5 h 左右。
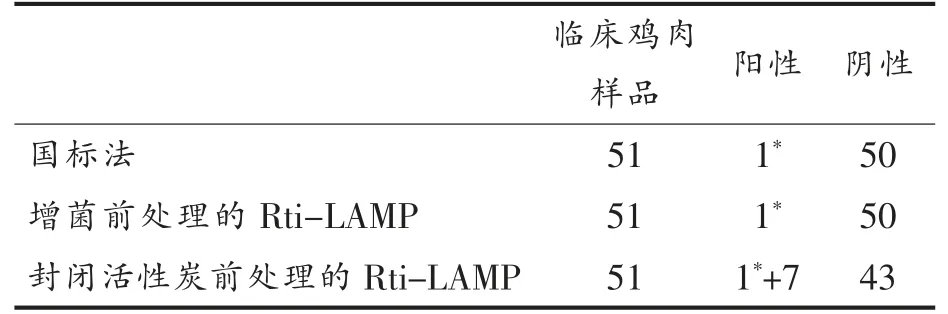
表2 3 种检测方法对临床鸡肉样品中大肠杆菌O157:H7 的检测结果Table 2 Three methods detected clinical chicken samples for E.coli O157:H7
为验证临床鸡肉样品大肠杆菌O157:H7 Rti-LAMP 检测的特异性,将扩增产物进行琼脂糖凝胶电泳(图6),结果DNA 扩增条带与大肠杆菌O157:H7 纯菌扩增条带一致,表明本研究建立的Rti-LAMP 检测鸡肉样品中大肠杆菌O157:H7 具有良好的特异性。
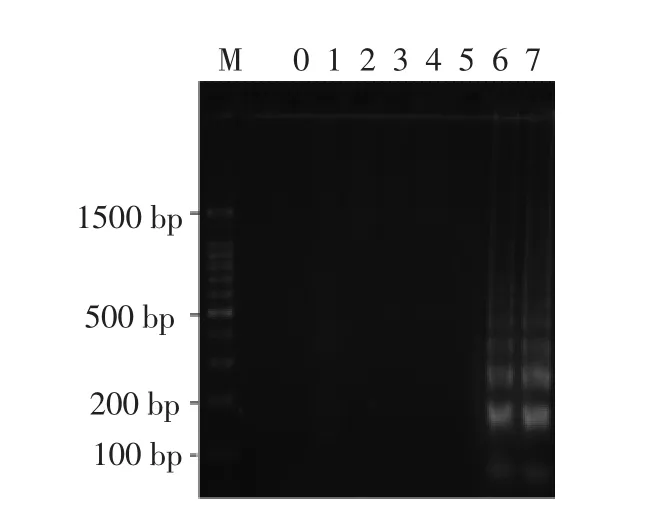
图6 临床鸡肉样品Rti-LAMP 扩增产物电泳图Fig.6 Detection of amplicons derived from Rti-LAMP reactions in clinical samples of chicken by agarose gel electrophoresis
3 讨论
本研究根据大肠杆菌O157:H7 的VT2 基因设计了6 条特异性引物,结合Midori Green 新型核酸染料,建立了大肠杆菌O157:H7 的Rti-LAMP 检测方法,其中纯培养菌液灵敏度达到3.5 CFU/反应,模拟大肠杆菌O157:H7 污染的鸡肉样品中增菌前处理的Rti-LAMP 检测灵敏度为140 CFU/g,整个检测流程可在7 h 内完成;而经封闭活性炭前处理的Rti-LAMP 检测灵敏度为12 CFU/g,需时约4.5 h 左右。
检测的51 份临床鸡肉样品,增菌前处理的Rti-LAMP 方法和国标法检出率均为1.96%。据Zhang 等[5]对中国南方多个省市183 份鸡肉污染情况调查,结果大肠杆菌O157:H7 的阳性检出率为3.28%。这与本试验的检测结果大致相似,表明Rti-LAMP 与国标法具有相同的检测灵敏度,但Rti-LAMP 所需时间约7 h,可在一个工作日内完成,较国标法节省了时间和人力。
研究表明,由于食品成分的复杂性,其中存在着多种水溶性DNA 聚合酶抑制剂,对检测的灵敏度和稳定性产生很大的影响[16]。例如本研究中未经封闭活性炭处理的Rti-LAMP 对模拟污染的鸡肉样品进行检测,其线性函数的R2系数较低(0.9504),显示食品组分中的抑制剂对扩增反应有一定的影响。本研究尝试使用蒙脱石封闭的活性炭进行前处理以消减抑制剂,结果表明经封闭的活性炭前处理人工模拟大肠杆菌O157:H7 污染的鸡肉样品,相比增菌但未使用封闭活性炭处理的Rti-LAMP 方法灵敏度提高了约10 倍。封闭活性炭前处理的Rti-LAMP 检出临床鸡肉样品8份大肠杆菌O157:H7 阳性,进一步说明该方法检测灵敏度确实有很大的提高,同时不需要增菌,极大地缩短检测至4.5 h。封闭活性炭前处理的Rti-LAMP 法检出鸡肉样品大肠杆菌O157:H7 高阳性率,推测可能的原因主要有两点:一是鸡肉中污染的大肠杆菌O157:H7 浓度并不低,但由于食品在加工储藏过程中会对细菌造成抑制和损伤,导致细菌活力降低甚至死亡,增菌培养时,损伤细菌不易生长繁殖,从而影响了国标法的检出率;但由于Rti-LAMP 法是对目标菌DNA 的扩增检测,损伤细菌其DNA 可以作为扩增模板;二是封闭活性炭消减鸡肉中可溶性抑制剂效果好,解除了抑制剂对DNA 聚合酶的抑制作用,从而极大地提高了Rti-LAMP 检测灵敏度。国家食品安全标准(GB 29921-2013)中规定,同一批次的5 份样品中大肠杆菌O157:H7 的检出率为0,说明对大肠杆菌O157:H7 有着严格的限定标准,所以严格控制大肠杆菌O157:H7 的检出对于保障食品安全具有重要意义。当然,本研究建立的Rti-LAMP 方法无法区别目标菌是死菌还是活菌,如何利用分子生物学方法进行鉴别,实现临床样品致病菌更精准的检测,仍需进一步研究。
