宫颈癌组织中缺氧诱导因子-1α、葡萄糖转运蛋白1的表达及临床意义
2019-05-04张洁金华古丽米热·布然江李小文姚丽艳
张洁 金华 古丽米热·布然江 李小文 姚丽艳

[摘要] 目的 研究缺氧誘导因子-1α(HIF-1α)和葡萄糖转运蛋白1(Glut-1)在宫颈癌组织中的表达情况及其临床意义。 方法 选取2015年1月~2017年12月新疆医科大学第三临床医学院宫颈手术切除样本的石蜡切片,采用免疫组化方法检测87例宫颈癌组织(宫颈癌组)、75例宫颈上皮内瘤变组织(宫颈上皮内瘤变组)及69例旁癌正常组织(癌旁正常组)中HIF-1α和Glut-1的蛋白表达情况,分析其表达与临床病理资料的关系。采用Spearman分析宫颈癌组中两蛋白的相关性。 结果 宫颈癌组中HIF-1α的阳性率为79.31%(69/87),显著高于宫颈上皮内瘤变组[13.33%(10/75)]和癌旁正常组[5.80%(4/69)](P < 0.01);Glut-1在宫颈癌组中的阳性率为66.67%(58/87),显著高于宫颈上皮内瘤变组[24.00%(18/75)]和旁癌正常癌组[20.29%(14/69)](P < 0.01);宫颈癌组中HIF-1α和Glut-1表达呈正相关(r = 0.644,P < 0.05),且两蛋白表达与肌层浸润程度、淋巴结转移、及FIGO分期相关(P < 0.05),而与年龄、宫颈癌肿瘤的大小、组织学分级、病理类型无关(P > 0.05)。 结论 HIF-1α和Glut-1在宫颈癌组织中表达显著升高,是诊断宫颈癌、提示疾病进展的潜在生物学标志。
[关键词] 宫颈癌;缺氧诱导因子-1α;葡萄糖转运蛋白-1;诊断;疾病进展
[中图分类号] R737.33 [文献标识码] A [文章编号] 1673-7210(2019)03(c)-0086-04
[Abstract] Objective To explore the expression and clinical significance of hypoxia-inducible factor-1α (HIF-1α) and glucose transporter-1 (Glut-1) in cervical carcinoma tissues. Methods From January 2015 to December 2017, the Third School of Clinical Medicine, Xinjiang Medical University, paraffin sections of cervical resection samples were randomly selected. The HIF-1α and Glut-1 expression of 87 cases of cervical carcinoma tissues (cervical carcinoma group), 75 cases of cervical intraepithelial neoplasia tissues (cervical intraepithelial neoplasia group) and 69 cases of cervical epithetium tissues (cervical epithetium group) was detected by immunohistochemical method, the relationship between the expression and the clinicopathological data was analyzed. Spearman test was used to analyze the correlation between the two proteins in cervical cancer tissues. Results The positive rate of HIF-1α in cervical carcinoma group (79.01%, 69/87) was significantly higher than that in cervical intraepithelial neoplasia group (13.33%, 10/75) and cervical epithetium group (5.80%, 4/69) (P < 0.01); the positive rate of Glut-1 in cervical carcinoma group (66.67%, 58/87) was significantly higher than that in cervical intraepithelial neoplasia group (24.00%, 18/75) (P < 0.01) and cervical epithetium group (20.29%, 14/69) (P < 0.01); the expression of HIF-1α was positively related with Glut-1 (r = 0.644, P < 0.05), and their expression was related with myometrial infiltration depth, lymph node metastasis and FIGO date (P < 0.05), but they were not related with age, cancer size, histological grades and tumor pathological types (P > 0.05). Conclusion The expression of HIF-1 and Glut-1 increased significantly in cervical carcinoma tissues, which is the potential biomarker of cervical cancer diagnosis and disease progression indication.
[Key words] Cervical carcinoma; Hypoxia-inducible factor-1α; Glucose transporter-1; Diagnosis; Disease progression
宫颈癌是最常见的女性恶性肿瘤之一,其发病率在女性恶性肿瘤中排第二位,全球每年死亡人数约为50万人,我国每年宫颈癌新发病数超过13.15万人[1]。目前宫颈癌的发病机制并不十分清楚,有学者认为其发病机制与宫颈细胞增殖活跃后的低氧应激关系密切[2-3]。低氧是肿瘤发生的微环境基础,缺氧诱导因子-1α(hypoxia inducible factor 1α,HIF-1α)能够在缺氧条件下促进下游能量供应链中的多种蛋白表达的特异转录因子。葡萄糖转运蛋白1(glucose transporter 1,Glut-1)是HIF-1α的下游靶基因之一,在细胞内葡萄糖酵解过程中发挥重要作用。以往报道HIF-1α和Glut-1参与多种恶性肿瘤的形成和转移[4-6],但其在宫颈癌中的作用还需要深入探究。因此,本研究探索HIF-1α和Glut-1蛋白在宫颈癌组织中的表达情况,分析其与临床病理特征的关联,为宫颈癌的诊断提供潜在生物学标志物。
1 资料与方法
1.1 一般资料
选取2015年1月~2017年12月新疆医科大学第三临床医学院宫颈手术切除样本的石蜡切片,根据病理诊断结果分为三组,宫颈癌组87例患者,年龄45~60岁,平均(52.12±7.48)岁;根据国际妇产联合会(the International Federation of Gynecology and Obstetrics,FIGO)分期标准[3],宫颈癌组临床分期:Ⅰ期16例,Ⅱ期24例,Ⅲ期20例,Ⅳ期27例;病理分型鳞癌49例,腺癌38例。宫颈上皮内瘤变组75例患者,年龄44~58岁,平均(51.56±6.89)岁;FIGO临床分期:Ⅰ期13例,Ⅱ期21,Ⅲ期17例,Ⅳ期24例;病理类型鳞癌40例,腺癌35例。癌旁正常宫颈组69例患者,年龄47~59岁,平均(54.32±5.41)岁。三组研究样本来源者的年龄比较,差异无统计学意义(P > 0.05),具有可比性。本研究经医院医学伦理委员会批准,所有患者和/或家属均知情同意并签署知情同意书。
纳入标准:①临床病理医师经病理组织活检确诊为宫颈癌;②临床病理医师经病理组织活检确诊为宫颈上皮内瘤变组织来源者无合并其他恶性肿瘤;③正常宫颈组织来源于距离癌组织3 cm的癌旁组织;④所有标本来源者近1个月无感染性疾病;⑤所有标本来源者近1个月未接受藥物治疗。排除标准:①标本来源者存在其他疾病或感染;②宫颈癌诊断不明确者;③临床病例资料不完整。
1.2 方法
所有标本切成4 μm薄片层,68℃烤片2 h,二甲苯浸泡后,用梨酸盐缓冲液清洗后,加入3%过氧化氢,EDTA进行抗原修补。封闭后,加入HIF-1α或Glut-1一抗稀释液(1∶200)(北京中杉金桥公司)4℃过夜,37℃复温1 h;滴加二抗经4℃孵育1 h,二氨基联苯胺显色2 min,苏木精复染30 s,梯度乙醇脱水、透明后封片镜检。
1.3 观察指标及评价标准
三位临床病理医师从阳性细胞率及着色情况两个方面进行双盲判读,至少两人判读结果相同。HIF-1α和Glut-1表达分别位于细胞膜、细胞核。随机选择5个高倍视野,每个视野计数200个瘤细胞,计数每个视野中阳性细胞数及总细胞数,计算出阳性细胞率。0分:0≤细胞阳性率≤5%;1分:5%<细胞阳性率≤25%;2分:25%<细胞阳性率≤50%;3分:50%<细胞阳性率≤75%;4分:细胞阳性率>75%。根据两种蛋白着色情况,分为:0分为无色,1分为淡黄色,2分为中黄色,3分为褐色。总评分=阳性细胞率评分×着色评分,0~1分为(-)、2~4分为(+)、5~6分为(++)、7分及以上为(+++)。(-)为阴性;(+~+++)为阳性。
1.4 统计学方法
采用统计学软件SPSS 20.0对数据进行分析,计数资料用率表示,采用χ2检验。采用Spearman进行相关性分析。以P < 0.05为差异有统计学意义。
2 结果
2.1 HIF-1α和Glut-1蛋白在不同宫颈组织中的免疫组化结果
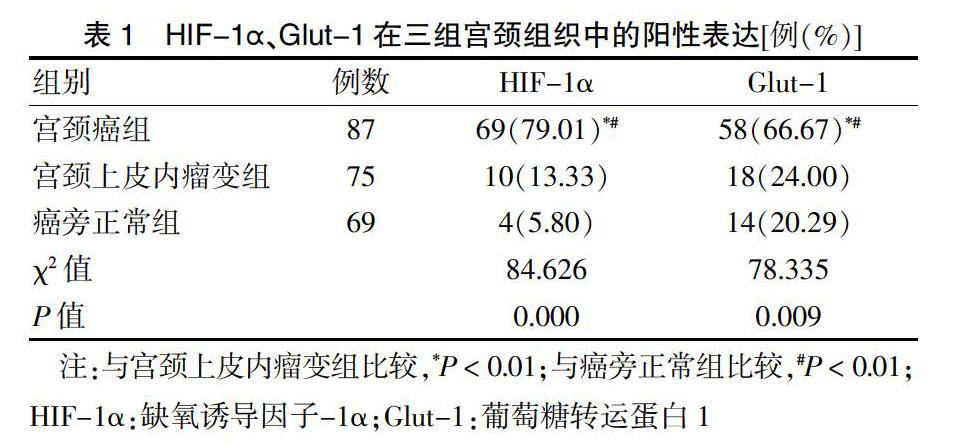
HIF-1α主要表达于细胞核和/或细胞浆,阳性染色呈棕黄色细颗粒状。宫颈癌和宫颈上皮内瘤组织中HIF-1α蛋白阳性表达增加,而癌旁正常组织中无HIF-1α表达。
Glut-1主要表达于癌细胞胞膜和/或红细胞。在癌组织中,阳性染色呈灶状或弥散分布,深浅不等,远离间质血管或临近坏死区的癌细胞染色加深。Glut-1蛋白在宫颈癌和宫颈上皮内瘤组织中的阳性表达均增加,而癌旁正常组织中不表达或微弱表达。
2.2 HIF-1α和Glut-1在不同宫颈组织中的表达情况
HIF-1α在宫颈癌组中的阳性表达率显著高于宫颈上皮内瘤变组和癌旁正常组(P < 0.01),HIF-1α在宫颈上皮内瘤变组和癌旁正常组中的表达差异无统计学意义(P > 0.05);Glut-1在宫颈癌组中的阳性表达率显著高于宫颈上皮内瘤变组和癌旁正常组(P < 0.01),Glut-1在宫颈上皮内瘤变组和癌旁正常组中的表达差异无统计学意义(P > 0.05)。见表1。
2.3 宫颈癌组HIF-1α和Glut-1表达与临床病理特征的相关性
宫颈癌组中HIF-1α和Glut-1的表达与年龄、肿瘤大小、组织学分型、肿瘤病理类型无关(P > 0.05),而与FIGO分期、淋巴结转移及肌层浸润程度均有关(P < 0.05)。见表2。
2.4 宮颈癌组HIF-1α和Glut-1表达的相关性
Spearman进行相关性分析显示,宫颈癌组HIF-1α和Glut-1的表达呈正相关(r = 0.644,P = 0.013)。
3 讨论
宫颈癌发病率和死亡率逐年攀升[1],严重危害人类健康,因此了解宫颈癌的早期诊断、检测肿瘤的疾病进展至关重要。目前宫颈癌的致病机制还不完全清楚,以往报道认为,肿瘤组织中的氧化应激(reactive oxygen species,ROS)在肿瘤的形成与发展过程中发挥重要作用[4]。肿瘤细胞内的有氧环境失衡,细胞的缺氧状态刺激肿瘤细胞快速增殖并形成实质性肿瘤团块,导致团块周围血管阻塞[7]。部分血管失去正常的血运功能,加重肿瘤周围的低氧状态。为了对抗低氧环境,肿瘤细胞通过活化多种细胞存活信号通路,以适应低氧环境,维持自身生长繁殖。HIF-1是一种异型低氧转录诱导因子,由HIF-1α和HIF-1β构成,在肿瘤细胞适应低氧环境中发挥重要作用[5]。低氧环境中,HIF-1α能活化下游涉及葡萄糖代谢、细胞增殖等100多个基因的转录。研究显示,HIF-1α在肺癌、胃癌、结直肠癌等肿瘤组织中表达升高,并在肿瘤的形成与发展过程中发挥重要作用[6]。例如,HIF-1α抑制抗凋亡基因(如c-Myc、survivin)的表达、诱导原癌基因(如Bax、caspase 3/8)的表达从而抑制肺癌细胞及胃癌细胞凋亡;HIF-1α是低氧诱导的自噬的核心调节因子,帮助细胞应答低氧和代谢压力,产生ATP而使细胞避免坏死及凋亡性死亡,促进肿瘤细胞在细胞毒性压力下的存活[7],使结肠癌细胞对放射治疗的敏感性降低[7-8]。本研究发现,通过免疫组化分析显示,HIF-1α在宫颈癌组织中的阳性率显著高于宫颈上皮内瘤变组和癌旁正常组,提示HIF-1α蛋白的异常表达可能参与了宫颈癌的形成过程,HIF-1α高表达可以通过影响宫颈癌上皮细胞的持续性诱导分化调控因子α的活性,促进局部癌细胞相关蛋白信号通路途径等的异常激活,加剧宫颈癌的发生风险[9]。
GLUTs是葡萄糖转运入肿瘤细胞的关键酶,维持多个生物过程的能量供应[10]。Glut1是GLUTs的经典成员之一,在正常上皮细胞及癌旁上皮细胞中几乎不表达[11]。有文献报道在非小细胞肺癌、结肠癌、胃癌等肿瘤组织中Glut1表达上调,增加肿瘤细胞内葡萄糖的水平,参与肿瘤形成、侵袭与转移[12-14]。本研究发现,Glut1在宫颈癌组织中高表达,在宫颈癌组织中的阳性率显著高于宫颈上皮内瘤变组和癌旁正常组。同时Glut1表达量与FIGO分期、淋巴结转移和肌层浸润程度相关,提示Glut1与肿瘤的形成密切相关,这与以往报道类似[15-16]。Glut1是HIF-1α下游靶基因之一,受到HIF-1α的靶向调控[17]。在快速生长的肿瘤组织中,HIF-1通过诱导糖酵解通路中的关键酶而过表达Glut1,帮助低氧肿瘤细胞转换葡萄糖代谢类型,达到诱导糖酵解的目的。Huang等[18]报道,HIF-1α既能通过调节Glut1增加非线粒体途径ATP的产生,又能结合在PDK3的启动子,诱导其表达,削弱线粒体呼吸链而增加糖酵解,表明HIF-1α-Glut1通路在肿瘤细胞糖酵解过程中至关重要。本研究还发现,宫颈癌组织中HIF-1α与Glut1的表达呈正相关,提示HIF-1α-Glut1在宫颈癌细胞中的能量供应中发挥重要作用,提示HIF-1α可能是调节宫颈癌细胞内Glut1葡萄糖转运膜蛋白的主要途径,持续低氧状态促进了HIF-1α的表达,进而诱发宫颈癌的生长与浸润。除HIF-1α之外,Glut1葡萄糖供应的调节通路还包括磷脂酰肌醇3-激酶(PI3K)、Ras、c-Myc和P53等,说明Glut1葡萄糖代谢转换功能受到多个信号通路的调节,据此推测可能存在其他Glut1调节基因,与HIF-1α共同调控Glut1的葡萄糖转换功能[19-20]。
综上所述,宫颈癌组HIF-1α和Glut-1表达均有明显升高,且两者表达水平与FIGO分期、淋巴结转移和肌层浸润程度相关,提示HIF-1α、Glut1促进肿瘤细胞的代谢及存活,与宫颈癌的形成和侵袭相关。此外HIF-1α和Glut1在宫颈癌组织中表达呈正相关,可以联合应用于宫颈癌的诊断和疾病进展的评估。因此,HIF-1α和Glut1在宫颈组织中的表达对于判定宫颈癌的进展程度具有重要的临创意义。
[参考文献]
[1] 刘萍.中国大陆13年宫颈癌临床流行病学大数据评价[J].中国实用妇科与产科杂志,2018,34(1):41-45.
[2] Lyng H,Malinen E. Hypoxia in cervical cancer:from biology to imaging [J]. Clin Transl Imaging,2017,5(4):373-388.
[3] Kristensen GB,Holm R,Malinen E,et al. Hypoxia-induced gene expression in chemoradio-resistant cervical cancer revealed by dynamic contrast-enhanced MRI [J]. Cancer Res,2012,72(20):5285-5295.
[4] Zelenka J,Koncosova M,Ruml T. Targeting of stress response pathways in the prevention and treatment of cancer. Biotechnology advances [J]. Biotechnol Adv,2018,36(3):583-602.
[5] Takasaki C,Kobayashi M,Ishibashi H,et al. Expression of hypoxia-inducible factor-1alpha affects tumor proliferation and antiapoptosis in surgically resected lung cancer [J]. Mol Clin Oncol,2016,5(2):295-300.
[6] Rodríguez ME,Catrinacio C,Ropolo A,et al. A novel HIF-1α/VMP1-autophagic pathway induces resistance to photodynamic therapy in colon cancer cells [J]. Photochem Photobiol Sci,2017,16(11):1631-1642.
[7] Courtnay R,Ngo DC,Malik N,et al. Cancer metabolism and the Warburg effect:the role of HIF-1 and PI3K [J]. Mol Biol Rep,2015,42(4):841-851.
[8] Sun Y,Xing X,Liu Q,et al. Hypoxia-induced autophagy reduces radiosensitivity by the HIF-1 alpha/miR-210/Bcl-2 pathway in colon cancer cells [J]. Int J Oncol,2015, 46(2):750-756.
[9] 孫慧霞,孙会,李国正.HIF-1α和Glut-1蛋白在中老年宫颈癌组织中的表达及其意义[J].中国妇产科临床杂志,2018,19(1):16-19.
[10] Adekola K,Rosen ST,Shanmugam M. Glucose transporters in cancer metabolism [J]. Curr Opin Oncol,2012,24(6):650-654.
[11] Zhao M,Zhang Z. Glucose transporter regulation in cancer:a profile and the loops [J]. Crit Rev Eukaryot Gene Expr,2016,26(3):223-238.
[12] Ding X,Liu J,Liu T,et al. MiR-148b inhibits glycolysis in gastric cancer through targeting SLC2A1 [J]. Cancer Med,2017,6(6):1301-1310.
[13] Tan Z,Yang C,Zhang X,et al. Expression of glucose transporter 1 and prognosis in non-small cell lung cancer:a pooled analysis of 1665 patients [J]. Oncotarget,2017,8(37):60954-60961.
[14] Gonzalez-Menendez P,Hevia D,Mayo JC,et al. The dark side of glucose transporters in prostate cancer:are they a new feature to characterize carcinomas [J]. Int J Cancer,2018,142(12):2414-2424.
[15] 陈赣洪.TLR4基因在宫颈癌组织中的表达及其与HIF-1α的相关性[J].实用癌症杂志,2013,28(6):608-610.
[16] 应申鹏,曹学全,刘艳梅,等.缺氧诱导因子-1α与缺氧诱导因子-2α蛋白和mRNA在宫颈癌中的表达及其临床意义[J].中国临床药理学杂志,2017,33(19):1893-1896.
[17] 王芳,尹立勇,娄娟,等.HIF-1α及其靶基因在宫颈癌中的表达[J].河北医科大学学报,2017,38(7):764-769.
[18] Huang CY,Kuo WT,Huang YC,et al. Resistance to hypoxiainducednecroptosis is conferred by glycolytic pyruvate scavenging of mitochondrial superoxide in colorectal cancer cells [J]. Cell Death Dis,2013,4(5):e622.
[19] Wu XL,Wang LK,Yang DD,et al. Effects of Glut1 gene silencing on proliferation,differentiation,and apoptosis of colorectal cancercells by targeting the TGF-β/PI3K-AKT-mTOR signaling pathway [J]. J Cell Biochem,2018, 119(2):2356-2367.
[20] Broecker-Preuss M,Becher-Boveleth N,Bockisch A,et al. Regulation of glucose uptake in lymphoma cell lines by c-MYC-and PI3K-dependent signaling pathways and impact of glycolytic pathways on cell viability [J]. J Transl Med,2017,15(1):158-159.
(收稿日期:2018-06-28 本文编辑:苏 畅)
