夹脊电针对ALS-SOD1G93A小鼠腰髓中p38 MAPK/NF-κB信号通路的影响研究
2019-04-18孙远征王仕林李禹明
苏 苏, 孙远征, 王仕林, 李禹明
(1黑龙江中医药大学, 哈尔滨 150001; 2黑龙江中医药大学附属第二医院, 哈尔滨 150001)
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)发病机制尚未确证,其主要症状表现为进行性肌无力、骨骼肌萎缩[1]。夹脊穴位于督脉与足太阳经之间,既与脏腑密切相关,又互通背部体表,于该处施针可对以上两经同时产生作用[2]。针刺可促进周围神经的传导和营养作用,有利于神经元轴突的再生,促进脊髓神经功能的恢复[3],若给予脉冲电流刺激,可使针刺作用增强,临床上已证实夹脊电针对ALS的治疗作用明显[4]。研究表明,炎症贯穿ALS发生、发展的始终,炎症因子可通过与神经元表面抗体肿瘤坏死因子α受体2(TNFR2)结合,诱导神经元的凋亡,促进ALS疾病的进展[5]。NF-κB是炎性反应的经典通路,使用anti-125b抑制NF-κB通路,可抑制运动神经元凋亡[6]。本实验通过检测ALS-SOD1G93A大鼠腰髓中p38 MAPK/NF-κB信号通路相关因子及促炎因子的表达,探讨该信号通路在夹脊电针治疗ALS中的作用机制。
1 资料与方法
1.1实验动物分组与处理由hmSODlG93A阳性C57BL/6J雄鼠与hmSODlG93A阴性C57BL/6J雌鼠繁殖得到hmSODlG93A阳性雌性小鼠,转基因C57BL/6J小鼠由美国Jackson实验室引进。以小鼠新生记为第1天,第30天根据Jackson实验室提供的引物及鉴定方案,以IL-2为内参进行PCR扩增基因鉴定,以表型特征对小鼠进行表型鉴定[7]。阳性小鼠饲养于黑龙江动物实验研究所,保持恒温恒湿的SPF级环境。
共取45只ALS-SOD1G93A转基因阳性雌性小鼠作为实验对象,转基因小鼠随机分为模型组、手针组、电针组,每组15只,另取15只同窝野生型雌性小鼠为阴性对照,第60天开始进行预处理实验:手针组给予普通针刺干预,于双侧L1~2、L5~6夹脊穴针刺(杏林牌针灸针0.17×7mm针刺),进针2~3 mm,每次留针20 min,每周行针2次,共治疗4周;电针组给予电针刺干预,于双侧L1~2、L5~6夹脊穴针刺(杏林牌针灸针0.17×7 mm针刺),进针2~3 mm,同一组电极正负两极连在脊柱同侧,设定电流频率2 Hz,电流强度不高于小鼠下肢肌肉收缩的强度,导线与电疗仪相连,电疗仪采用杭州丹顿长城牌KWD-808全能脉冲电疗仪。每周行针2次,共治疗4周;阴性对照组、模型组于同一时间给予捆绑固定20 min,每周固定2次,共固定4周。
针刺穴位以中国针灸学会实验针灸分会制定的《动物针灸穴位图谱》为基础,同时参考中国兽牧医学会编写的《中国兽医针灸学》及《实验针灸学》:L1~2夹脊穴:位于督脉与膀胱经第一侧线间中点,背正中线旁开约3 mm,平肋角下缘;L5~6夹脊穴:位于督脉与膀胱经第一侧线间中点,背正中线旁开约3 mm,平髂嵴上缘。
1.2小鼠腰髓采集及形态学检测第120天,腹腔注射10%水合氯醛麻醉后,取小鼠脊髓L1~6节段4℃多聚甲醛浸泡固定(透射电镜用2.5%戊二醛固定)24 h,分别检测如下项目:
1.2.1 尼氏染色 腰髓组织石蜡包埋、切片、1%焦油紫或1%硫堇染色1 h、封片并观察。对连续切片的每第5张切片的双侧脊髓前角的运动神经元进行计数,每块组织观察10个切片。生物功能良好的神经元识别标准:细胞核内有一个清晰的大的核仁,周围为完整淡蓝染色的细胞质。
1.2.2 透射电镜 腰髓组织依次经切片、固定、丙酮梯度脱水、包埋、聚合、组织块的修整、半薄切片制备、超薄切片的定位、载网及3%醋酸铀-枸橼酸铅双染色后,透射电镜下观察运动神经元的超微结构。
1.3免疫组织化学法测定小鼠腰髓p38、p-p38的表达采用S-P法检测腰髓p38、p-p38的表达。取腰髓组织磷酸盐缓冲液(PBS)漂洗,用OCT包埋剂将组织包埋并固定在载物台上切片。将切片放入12孔板中,依次加入过氧化物酶阻断剂、正常非特异性血清、相应一抗、生物素标记的二抗、链霉素室温下振荡孵育。最后经DAB显色,梯度乙醇脱水,二甲苯透明,中性树胶封固,光镜观察,棕黄色颗粒为表达阳性。结果进行评分判定。
1.4免疫荧光染色检测小鼠腰髓p65核移位细胞爬片用预冷的PBS漂洗3次,加入4%多聚甲醛室温固定30 min,PBS漂洗,加入0.5%Triton X-100室温透化10 min,PBS漂洗,加入5%牛血清白蛋白(BSA)溶液室温封闭1 h,PBS-T漂洗,加入p65一抗(1∶400),37℃孵育1 h,磷酸盐缓冲液-吐温20(PBST)漂洗,加入荧光标记的山羊抗兔二抗,37℃避光孵育1 h,PBS-T漂洗,加入DAPI避光处理5 min,PBS-T漂洗三次,滴加90%甘油封片,荧光显微镜观察p65染色分布情况。
1.5Westernblot小鼠脊髓L1~6段,加入细胞裂解液冰浴匀浆,裂解液于4℃下12000 r/min离心15 min提取总蛋白,上清液采用BCA蛋白定量法测定蛋白浓度。聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离,分离的蛋白在200 mA下转膜至PVDF膜上。转膜完成后,4℃下用5%脱脂奶粉封闭1 h,加入相应一抗4℃孵育过夜,磷酸盐缓冲液-吐温20(PBST)洗涤后加入二抗室温孵育1 h,用电化学发光(ECL)显影液显色,化学发光凝胶成像系统中显影成像,Image pro-plus 6.0软件对结果进行灰度扫描分析,以β-actin为内参计算各蛋白条带相对灰度值之比。
1.6实时荧光定量PCR检测采用Trizol法抽提各组脊髓神经细胞总RNA,经紫外分光光度法、变性琼脂糖凝胶电泳鉴定RNA纯度,按PrimeScript RT Master Mix反转录酶试剂盒说明书将RNA反转录为cDNA。使用实时定量PCR仪7300型(美国ABI公司),采用SYBR green法对目的基因进行扩增。以β-actin为内参,引物由上海生工生物工程(上海)股份有限公司合成。引物序列祥见表1。反应条件:预变性95℃ 2 min,变性95℃ 15 s,退火60℃ 30 s,延伸72℃30 s,共40个循环。采用2-△△Ct法计算目的基因的变化水平。

表1 qPCR引物序列

2 结果
2.1各组小鼠腰髓前角尼式染色结果阴性对照组中前角运动神经元数目较多有(17.00±1.78)个/HP,神经元形态结构无异常,无空泡散在,胞质染色均匀,核仁清晰可见。模型组神经元数目为(7.48±1.46)个/HP,与对照组比较,差异有统计学意义(P<0.05),神经元结构完整性破坏,细胞核固缩,有大量散在空泡。与模型组相比,手针组[(10.93±1.84)个/HP]与电针组[15.04±1.57)个/HP]神经元数量增加(P<0.05),形态结构有所改善,空泡化减少,电针组改善情况较手针组更优,见图1。
2.2各组小鼠腰髓前角神经元超微结构观察阴性对照组神经元形态正常,细胞器完整而清晰,核膜完整且染色质核内分布均匀。模型组神经元萎缩皱缩,线粒体肿胀且部分空泡化,核膜变形且部分破裂,可见异染色质聚化散在,胶质细胞在变性神经元围绕形成卫星现象。与模型组相比,手针组与电针组细胞、线粒体、核膜、染色质分布均有改善,表现神经细胞轻度萎缩,线粒体肿胀及空泡化程度降低,核膜较为完整,染色质分布较为均匀。电针组各组分形态结构的改善可见优于手针组,见图2。




对照组 模型组 手针组 电针组




对照组 模型组 手针组 电针组
2.3各组小鼠腰髓TNF-α、IL-6、IL-1βWesternblot检测与对照组相比,模型组小鼠腰髓TNF-α、IL-6、IL-1β含量升高(P<0.05)。与模型组相比,手针组与电针组TNF-α、IL-6、IL-1β含量下降,差异具有统计学意义(P<0.05)。与手针组比较,电针组TNF-α、IL-6、IL-1β表达有所降低(P<0.05),见表2、图3。

表2 各组小鼠腰髓TNF-α、IL-6、IL-1β相对表达量的比较
注: 与对照组比较,*P<0.05; 与手针组比较,#P<0.05。
2.4各组小鼠腰髓前角免疫组化结果免疫组织化学结果显示,小鼠腰髓中可检测到p38、p-p38阳性表达,主要分布于脊髓灰质前角,中央管、白质及其他灰质部分表达较为微弱。与模型组相比,手针组与电针组p-p38表达减弱,以电针组减弱程度最大,见图4。

图3 TNF-α、IL-6、IL-1β在各组小鼠腰髓中的表达




p38




p-p38
2.5各组小鼠腰髓前角免疫荧光结果免疫荧光结果显示,对照组p65(绿色荧光)主要分布于细胞质,模型组p65主要位于细胞核,绿色荧光与蓝色荧光有较大重合,表明模型组p65已从细胞质转移至细胞核。手针组与电针组细胞核中绿色荧光强度降低,而细胞质中绿色荧光增强,表明手针与电针均能可抑制p65入核过程,见图5。



对照组


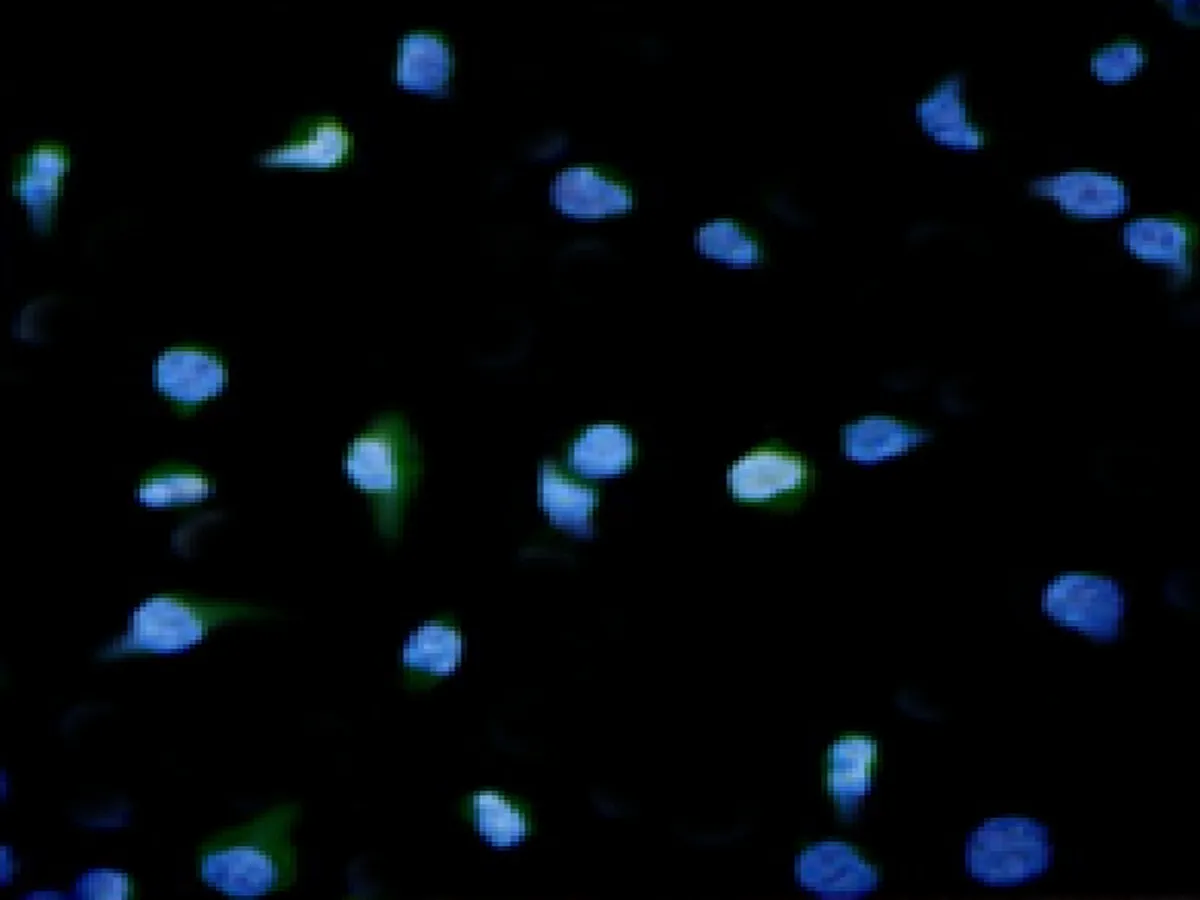
模型组
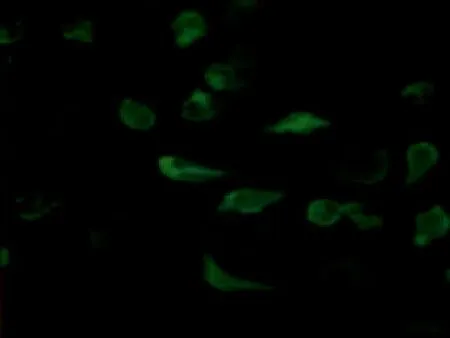


手针组
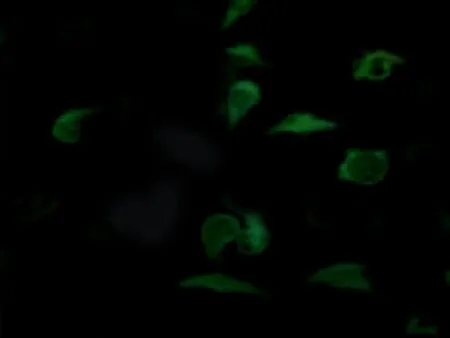


电针组
2.6Westernblot检测小鼠腰髓p38MAPK/NF-κB信号通路蛋白与对照组比较,模型组p-IκB-α、p-p38、p-p65水平升高(P<0.05)。与模型组比较,手针组与电针组p-IκB-α、p-p38、p-p65蛋白水平下降(P<0.05)。与手针组相比,电针组p-IκB-α、p-p38、p-p65表达下降,差异有统计学意义(P<0.05)。4组总p38、p65、IκB-α蛋白水平差异无统计学意义(P>0.05),见表3、图6。
2.7各组小鼠腰髓TNF-α、IL-6、IL-1βmRNA表达与对照组相比,模型组小鼠腰髓TNF-α、IL-6、IL-1β mRNA表达提高(P<0.05)。与模型组相比,手针组与电针组TNF-α、IL-6、IL-1β mRNA表达水平下降(P<0.05),差异具有统计学意义。与手针组比较,电针组TNF-α、IL-6、IL-1β mRNA显著降低(P<0.05),见表4。

表3 各组小鼠腰髓p38、p65、IκB-α及各磷酸化蛋白相对表达比较
注: 与对照组比较,*P<0.05; 与手针组比较,#P<0.05。

图6 p38、p65、IκB-α及各磷酸化蛋白在小鼠腰髓中的表达

表4 各组小鼠腰髓TNF-α、IL-6、IL-1β相对表达比较
注: 与对照组比较,*P<0.05; 与手针组比较,#P<0.05。
3 讨论
在ALS早期,小胶质细胞在脊髓和外周神经中聚集并活化,介导慢性炎症的产生,进一步影响脊髓运动神经元的功能[8]。研究表明活化的小胶质细胞内大量p38 MAPK和NF-κB被激活,促进炎症因子基因的转录与表达,向外周释放大量诱导型一氧化氮合酶(iNOS)、IL-6、白介素-8(IL-8)、TNF-α、IL-1β等促炎因子。
在本研究中发现,模型组腰髓前角运动神经元数量减少,大量小胶质细胞围绕于变性神经细胞周围,尼氏体染色不清晰,核固缩,线粒体空泡化严重,表现严重的神经元炎症变性。经手针、电针处理后,症状明显改善,相比手针,电针改善程度更高一些。模型组的炎症因子TNF-α、IL-6、IL-1β蛋白及mRNA表达水平明显上升,电针组以上3种因子的含量明显低于模型组与手针组,提示电针组能显著抑制腰髓前角炎症反应的发生,抑制了由于炎症反应介导的细胞凋亡坏死,从而改善腰髓前角运动神经元的活性与功能,起治疗ALS的作用。研究表明IL-6参与ALS小鼠的NK-κB信号通路传导,并与NK-κB起到相互刺激和激活的作用[9-10],与本研究的实验结果相符合。
本研究进一步观察电针刺激对MAPK-NF-KB的关键蛋白p38及其磷酸化的作用、IκB-α、p65的磷酸化及入核的影响。结果显示,在脊髓前角部位,电针组神经元内p38的磷酸化明显降低, IκB-α、p65磷酸化明显降低,免疫荧光结果显示电针组能抑制p65的入核过程,与Hu等[9]研究结果一致。在NK-κB经典激活通路中,p50/p65与抑制因子IκB-α结合形成三聚体,此时NF-κB为无活性状态[11],当有外界刺激作用于细胞时,IKK的IKKp亚基被磷酸化激活,引起IκBαSer32和Ser36位点被磷酸化,进而被泛素化降解,NF-κB得以释放并进行核易位[9],之后特异性地结合于κB位点启动下游基因的表达,从而调节细胞的功能。因此本次研究说明,电针刺激可抑制对IκB-α的磷酸化,加强对NK-κB抑制作用,p65难以在胞质中被释放且被磷酸化,抑制p65进入细胞核启动下游基因的表达。对下游基因mRNA的检测,也证实电针能降低TNF-α、IL-6、IL-1β转录水平。谭晶[10]的一项研究发现,p38 siRNA显著抑制p38基因的表达,降低p65的磷酸化水平,在降低IKKβ的磷酸化的同时,还增加了IκB-α在细胞质的稳定性,说明对p38的抑制可进一步介导对NK-κB通路的抑制作用。
综上所述,夹脊电针能通过抑制p38 MAPK/NF-κB信号通路,降低TNF-α、IL-6、IL-1β转录与表达,减轻炎症反应对运动神经元的损伤作用,缓解ALS-SOD1G93A转基因小鼠的病情,为夹脊电针治疗ALS的临床推广提供了详实的理论依据。
