TNF-ɑ、Rho、C-AbI蛋白表达对海洛因致大鼠小脑颗粒神经元细胞凋亡的作用和意义
2019-04-18李卫峰苏丽萍胡夏韵蒲红伟
李卫峰, 苏丽萍, 胡夏韵, 蒲红伟,4
(1成都三六三医院病理科, 成都 610000; 2新疆医科大学第一附属医院病理科, 乌鲁木齐 830054,3新疆医科大学基础医学院病理教研室, 乌鲁木齐 830011; 4河北省法医学重点实验室, 石家庄 050000)
海洛因海绵状白质脑病(HSLE)是由于长期吸食海洛因,致脑组织部分区域呈空泡状变性,组织疏松呈海绵样改变,海洛因选择性地作用脑组织,产生损伤、中毒性改变的中枢神经系统病变[1]。HSLE被认为是一种非特异性脱髓鞘病变,可导致细胞空泡样变性和细胞坏死,是海洛因引起中毒性脑病最常见和最早的表现,可发生神经细胞大量程序性死亡[2]。
细胞凋亡(apoptosis)是机体维持体内平衡和生长发育的重要生理过程,细胞在基因的自我调节控制下,机体内凋亡因子启动并导致细胞发生程序性细胞死亡(programmed cell death, PCD)过程。肿瘤坏死因子(tumor necrosis factor,TNF-ɑ)作为死亡受体途径中的重要因子,能够引起肿瘤细胞发生坏死,在自身免疫反应和细胞凋亡中发挥主导调控作用。Rho蛋白广泛分布于哺乳类动物的组织细胞中,1985年被确认是哺乳类动物Ras基因的同系物(ras homologue,Rho),是Ras超家族的一个亚群,被称为小G蛋白超家族,对细胞有丝分裂、粘附、细胞骨架调整、肌肉收缩、肿瘤细胞浸润、细胞凋亡等一系列基本生命现象起着调控功能[3]。非受体酪氨酸激酶家族(cellular-abelson基因产物,C-Abl)广泛存在哺乳动物中,其中C-AbI蛋白作为此家族主要成员,特别是在氧化应激反应中,可调节细胞周期、DNA重组、修复和凋亡的发生发展,决定细胞的生存与凋亡[4]。然而,TNF-ɑ、Rho和C-AbI是否参与海洛因致神经元病变的机制文献少有报道。本课题研究海洛因成瘾大鼠模型,通过海洛因对大鼠一定时间的作用条件下,对激活凋亡路径的活化蛋白TNF-ɑ、Rho、C-AbI进行检测,分析研究TNF-ɑ、Rho、C-AbI在此凋亡过程中具体作用和意义。
1 材料与方法
1.1材料盐酸纳洛酮(批号:H20055758) 购自北京四环制药有限公司,甲醛、苏木精、酒精、伊红购自北京中衫金桥技术生物有限公司。Rho、TNF-ɑ、C-AbI均购自于Abcam公司,海洛因由新疆维吾尔族自治区公安厅禁毒总队提供,呈米黄色粉末及颗粒状(纯度为90%以上)。
1.2实验动物及分组SPF级健康雄性SD大鼠90只(3月龄),体质量(200±20) g,由新疆医科大学第一附属医院临床研究院动物饲养中心统一喂养(动物许可证号:IACUC-20131224002)。参照Zhou等[5]方法并结合预实验结果,将SD大鼠随机分为对照组(10只)和模型组(80只),采用剂量递增方法,初次海洛因剂量为5 mg/kg,随后逐日剂量递增2.5 mg/kg,每日于北京时间10:00和19:00进行皮下注射,持续注射30 d,建立海洛因成瘾模型组。通过腹腔注射盐酸纳洛酮(0.8 mg/kg)催瘾,判断每只大鼠戒断症状,评判成瘾模型是否建立。模型成功建立后,连续给与海洛因恒定剂量注射大鼠10 d、20 d、30 d、40 d,按同样方式腹腔注射同等体积的生理盐水建立对照组。
1.3苏木精—伊红(HE)染色腹腔注射水合氯醛麻醉,快速断颈,取小脑,10%的中性福尔马林溶液固定3 d,组织脱水,包埋、切片(3~5 μm厚度薄片),二甲苯Ⅰ、Ⅱ脱蜡20 min,梯度酒精脱水,复染,分化,温热水返蓝,伊红染色2 min,脱水、透明、中性树胶封片,显微镜观察。
1.4电镜观察取对照组、海洛因成瘾组和海洛因成瘾40 d组大鼠小脑组织,体积1 mm×1 mm×1 mm作为电镜材料,冲洗,戊二醛固定1周,梯度丙酮脱水;100%丙酮20 min清洗3次,环氧丙烷:环氧树脂(PO∶EPON=1∶3)浸透各2 h、过夜、包埋,60℃下聚合2 d以上,制成电镜切片,染色,置于透射扫描电镜下观察。
1.5脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)检测对照组、海洛因成瘾10 d组、海洛因成瘾20 d组、海洛因成瘾30 d组及海洛因成瘾40 d组,取小脑组织制成石蜡切片,多聚甲醛15 min,加入蛋白酶K,37℃温箱孵育20 min。加入混合液50 μL末端脱氧核苷酸(TdT)+450 μL脱氧尿嘧啶核苷三磷酸( dUTP),37℃温箱内孵育1 h。浸入过氧化氢(H2O2)10 min,磷酸盐缓冲液(PBS)清洗,加入80 μL生物素(POD)30 min,显色,自来水终止,复染,脱水,透明,封片。
1.6免疫组织化学方法将各组大鼠小脑组织制作成石蜡切片,进行前期脱蜡和脱水程序,加入3% H2O2浸泡10 min,PBS 清洗,加入柠檬酸钠溶液高温抗原修复8 min,冷却,PBS清洗。滴加稀释好浓度的一抗(TNF-ɑ 浓度1∶200,Rho浓度1∶150,C-AbI浓度1∶50)于4℃冰箱内孵育过夜。次日早晨取出室温放置30 min,PBS清洗,加二抗,37℃温箱孵育40 min,清洗,显色,终止。复染,分化,返蓝,脱水,透明,封片,显微镜下随机拍照,从每只大鼠的切片中随机选择1张,并选取4个视野拍照。采用ImageProPlus6.0(Media Cybernetics)软件进行定量分析,计算各组阳性染色面积,用所计算出的阳性染色面积表示蛋白的表达水平,取平均值。
1.7免疫印迹(WesternBlot,WB)检测将每组冷冻保存的小脑组织,称取100 mg组织,提取细胞总蛋白,进行蛋白定量,上样,以湿转法电转移至PVDF膜上,5%脱脂奶粉室温封闭2 h后加一抗(TNF-α浓度1∶1 500、Rho浓度1∶200,C-AbI、β-tubulin浓度均按1∶1 000),4℃孵育过夜,取出,洗膜3次,加入二抗,室温1 h,洗膜3次,显色,图像处理仪分析相关蛋白表达情况。

2 结果
2.1海洛因对小脑神经元细胞形态学的影响对照组大鼠小脑颗粒细胞排列整齐均匀,染色均衡,细胞核形态清晰,间质结构清晰完整。海洛因成瘾组大鼠小脑白质神经细胞数目减少,结构紊乱,神经细胞内出现小空泡(箭头所指),多个小空泡可以合并较大腔隙,周围炎症细胞浸润不明显(图1)。


a: 对照组 b: 海洛因成瘾组
2.2电镜观察对照组神经元细胞形态完清晰,排列整齐,细胞突起成交叉网格状,线粒体密集,结构完整(图2a、b);海洛因成瘾组神经元细胞胞核固缩变小,核染色质密集,细胞器密集,线粒体轻微度肿胀(图2 c箭头所指),核膜皱缩,核密度降低,胞体肿胀(图2d箭头所指);成瘾40 d组,神经元细胞轴突减少、胞体皱缩,胞浆破碎、线粒体大量肿胀或崩解,嵴排列紊乱或断裂,部分空泡化(图2e箭头所指),染色质加深,髓鞘水肿(图2f箭头所指)。细胞突触高度水肿,围绕毛细血管或分布于神经毡内与周围水肿的突触使神经毡呈疏松的网孔状、海绵状外观,细胞核固缩,染色质加深(图2 e、f)。
2.3细胞凋亡与正常细胞不同,凋亡细胞主要是在细胞核呈黄褐色。海洛因成瘾10 d组神经元细胞胞核开始出现少量黄褐色(图3b),与对照组比较细胞凋亡数量明显增多,差异有统计学意义(P<0.05);海洛因成瘾各组的细胞凋亡率显著高于对照组(图3b~e),差异有统计学意义(P<0.05);随着海洛因给药天数的增加,细胞核出现黄褐色数量逐渐增多,经统计显示在海洛因成瘾10 d组、20 d组30 d组和40 d组细胞凋亡率分别为(13.44±4.67)%,(26.4±3.01)%,(38.80±3.96)%,(46.4±8.05)%,对照组为(3.4±1.14)%(图3f),在给药时间和剂量延长情况下,细胞凋亡数量增加,这表明长期使用海洛因可致大鼠小脑神经元细胞产生凋亡。
2.4免疫组化检测结果在海洛因成瘾10、20、30 d和40 d组TNF-α蛋白明显高于对照组,差异有统计学意义[其中30 d和40 d组TNF-α蛋白表达差异有统计学意义(P<0.05)],TNF-α蛋白表达在胞浆和胞膜上,见图4、表1。Rho蛋白在海洛因成瘾各组中表达明显升高且高于对照组,差异统计学意义(P<0.05);Rho蛋白表达在胞质上见图4、表1;而各组中的C-AbI蛋白的表达无明显变化,与对照组比较,差异无统计学意义(P>0.05),见图4、表1;随着海洛因给药时间的延长,TNF-ɑ和Rho神经元凋亡变化趋势相同,这提示其与神经元凋亡相关,而C-AbI对成瘾大鼠动物模型神经元凋亡无明显相关性。




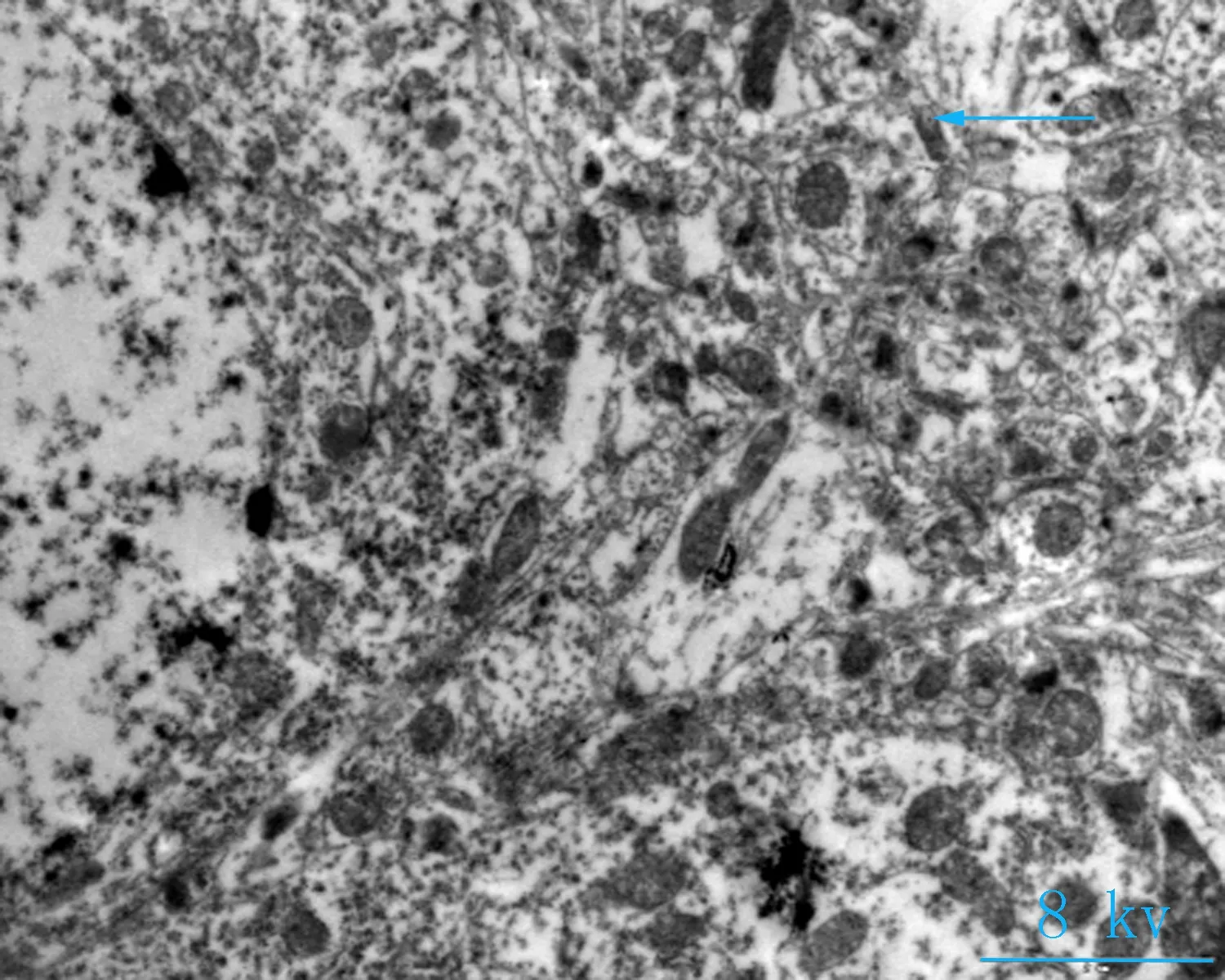

a、b: 对照组大鼠小脑组织(8、12 kv); c、d: 海洛因成瘾组大鼠小脑组织(8、12 kv); e、f: 海洛因成瘾40 d组大鼠组织(8、12 kv)



a: 对照组 b: 海洛因成瘾10 d组 c: 海洛因成瘾20 d组



d: 海洛因30 d组 e: 海洛因成瘾40 d组 f: 各组细胞凋亡数量柱状图

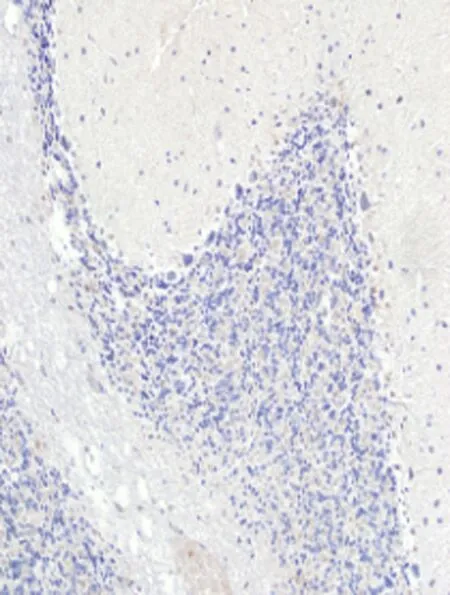

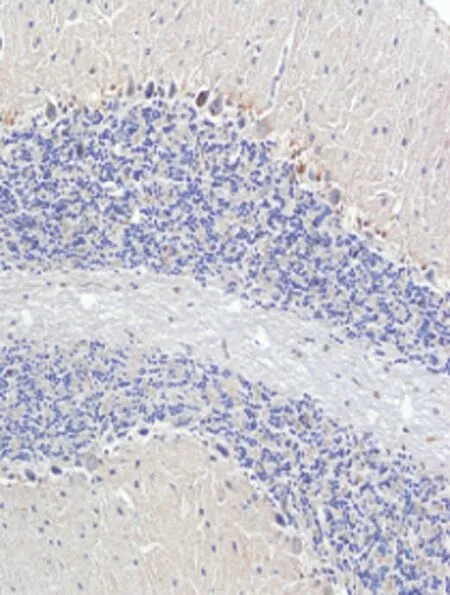

TNF-α





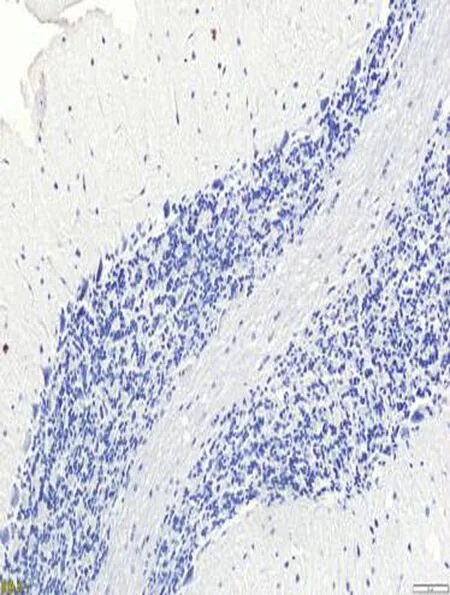

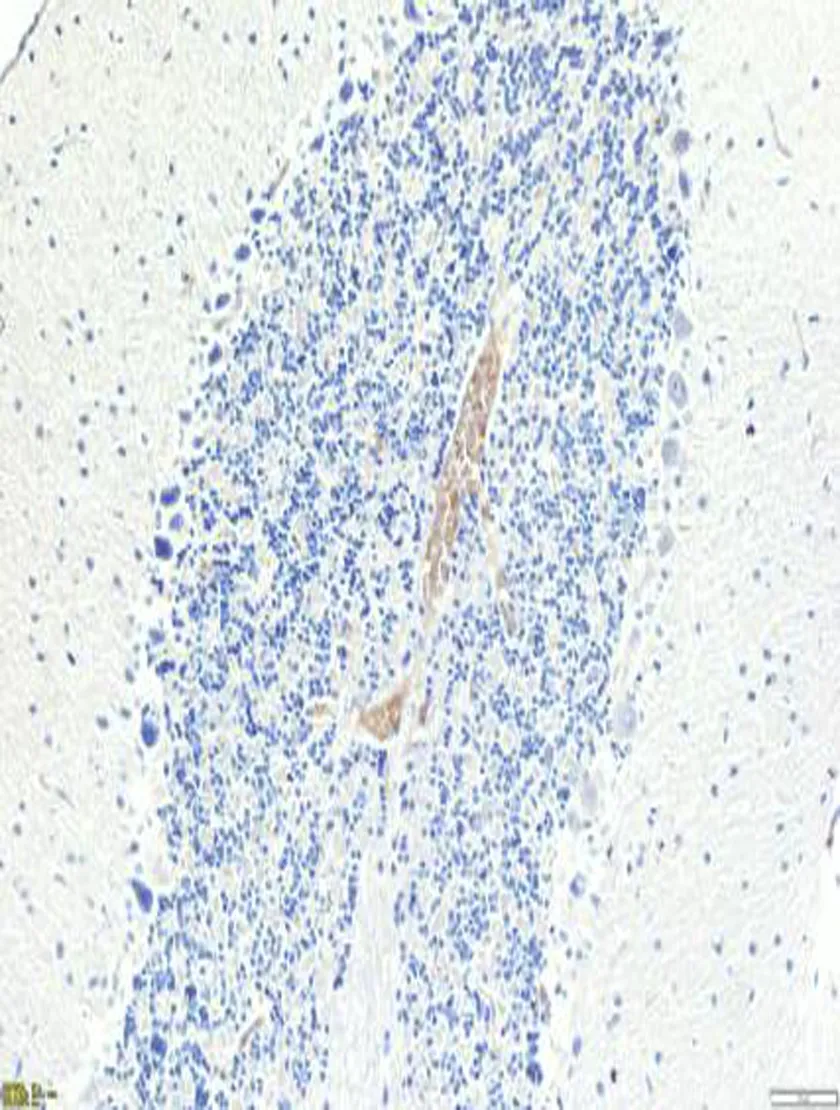


C-AbI

表1 TNF-α,Rho 和C-AbI 蛋白在海洛因成瘾大鼠小脑组织表达
注: 与对照组比较,*P<0.05。
2.5Westernblot法检测TNF-ɑ、Rho和C-AbI蛋白的结果TNF-α蛋白在海洛因成瘾各组明显高于对照组,差异有统计学意义,海洛因成瘾10 d组和20 d组蛋白表达量高于对照组,差异有统计学意义(P<0.05),在海洛因成瘾(30 d组和40 d组)蛋白表达量明显高于对照组,差异有统计学意义(P<0.01)。在海洛因成瘾20 d,30 d和40 d组Rho蛋白明显高于对照组,差异有统计学意义(P<0.05),在10 d组蛋白表达有升高趋势,但差异无统计学意义(P>0.05)。而C-AbI蛋白在各组表达无明显变化,与对照组比较差异无统计学意义(P>0.05)。随着海洛因给药时间的延长,TNF-ɑ和Rho对成瘾大鼠脑组织细胞凋亡存在影响,而C-AbI对成瘾大鼠脑组织细胞凋亡无明显相关性(图 5a、b)。
3 讨论
海洛因(化学名称:二乙酰吗啡)是阿片受体结合物,长期吸食海洛因可引起中枢神经系统发生严重的器质性疾病,其典型病变为海绵状白质脑病(SLE)[6]。1982年Wolters等[2]首次报道了海洛因海绵状白质脑(HSLE)的病理特征和临床症状,其主要作用小脑白质、脑干胼胝体、内囊、脑干等损伤,组织结构出现海绵状和空泡样改变。海洛因具有特异性神经毒素,可破坏额叶灰质、扣带和枕叶皮质,导致神经元细胞凋亡,线粒体功能障碍,突触缺陷,细胞内钙超载,线粒体膜电位(MMP)升高和ATP水平降低等[7-9]。在长期滥用海洛因情况下,机体中枢神经系统会持续受损,特别是神经细胞可发生广泛的病理改变,其中小脑颗粒神经元凋亡是其典型的病变特征,这是中毒性脑病的基本病理变化,亦属于特殊类型的中毒性脑病,对其发生原因机制目前尚不清楚。


a: 对照组; b: 海洛因成瘾10 d组; c: 海洛因成瘾20 d组; d: 海洛因成瘾30 d组; e: 海洛因成瘾40 d组

本课题建立大鼠海洛因成瘾模型,在海洛因作用下大鼠小脑神经元细胞数量明显减少,神经细胞内出现多个小空泡,多个小空泡可以合并较大腔隙,周围炎症细胞浸润不明显,这种改变与神经细胞凋亡结构相似。在海洛因成瘾组中神经元细胞核染色质和胞内细胞器密集,线粒体和粗面内质网均有轻度肿胀。在延长海洛因给药时间(海洛因成瘾40 d组)时,小脑组织结构松散,神经细胞突起减少、胞体皱缩,神经元胞浆破碎、线粒体肿胀或崩解,嵴排列紊乱或断裂,有部分出现空泡化,核固缩,染色质颜色加深。该细胞突起呈高度水肿,围绕毛细血管的突触出现疏松状的网眼状和海绵状外观,这与Kriegstein等[10]和Yin等[11]研究的海洛因可致神经细胞变性坏死结果较为相似。随着海洛因给药时间的延长,小脑神经元细胞凋亡数量逐渐增多,这进一步证实了海洛因海绵状白质脑病(HSLE)的存在。因此,本研究认为海洛因成瘾的大鼠主要以SLE为主要病变,病理表现主要是神经元细胞变性并伴有细胞凋亡形式。
细胞凋亡程序的激活受多种因素影响, 但凋亡信号通路却比较保守和单一,主要两种途径调控:内在线粒体途径和外在死亡受体途径。死亡受体Fas的配体是Fas配体(FasL),肿瘤坏死因子受体1(TNFR1)的配体为TNF-α,它是研究较为明确的死亡受体和配体[12],TNF-α是肿瘤坏死因子,在调控机体免疫和细胞凋亡过程中发挥重要作用,还可诱导机体对肿瘤组织发挥作用而导致细胞坏死。有研究报道,过量表达的TNF-α可导致帕金森病(PD)、中风及阿尔茨海默氏病(AD)等病理性改变,这主要是细胞凋亡过程发生紊乱[13]。TNF在与受体进行结合后,不但可活化FADD-Caspase-8 通路,还可以激活NF-κB 通路和C-jun/JNK信号通路,主要是与TRAIL结合发挥细胞凋亡过程。TNF-α蛋白的表达可受到相关因子调控和阻碍,抑制TNF-α蛋白的产生可以相应减少细胞凋亡的发生,海洛因作用大鼠脑组织细胞是否会干预TNF-α表达,是否会导致细胞发生凋亡,有待证实。Rho是小G 蛋白超家族的一员,可调控生物体一系列生命现象,比如有丝分裂、肌肉收缩强度、肿瘤细胞浸润和增殖以及细胞凋亡等,并在机体组织中广泛存在,其过表达可导致生长锥塌陷和突起回缩,抑制则可促使细胞突起生长[14]。Rho因子是C-jun/JNK信号传导途径的上游信号,可与p21激活的丝/苏氨酸激酶(p21-activatingkinase,PAK) 结合,磷酸化而激活c-jun/JNK凋亡信号路径。有研究者在Ras/Raf诱导的果蝇肿瘤模型中发现异常增殖,主要是Rho激酶对JNK与Raf起协同作用,同时,可特异性减轻脑血管痉挛[15]、改善脑血流代谢、缩小梗死体积[16]和改善神经功能缺损[17],但其是否调控海洛因作用神经系统的过程尚未完全阐明。非受体酪氨酸激酶Abl家族的重要成员C-AbI蛋白广泛存在哺乳动物细胞中,可调节细胞周期、DNA重组修复和细胞凋亡,从而决定细胞在此氧化应激反应中的生存与凋亡。在细胞外刺激因子(如紫外线和TNF-α应激损伤)的作用下,C-AbI与转录因子NF-kB的抑制因子IkBa相互作用并增强IkBa的稳定性,并促进其进入细胞核与NF-KB结合抑制后者的转录活性,从而诱导细胞凋亡[18-19]。因此,Rac途径中的Rho蛋白和旁路途径中的C-AbI是否参与海洛因作用大鼠脑组织细胞损伤的过程,是否诱导了神经元凋亡,基于以上问题,本课题组研究结果:在海洛因成瘾组中TNF-α蛋白在胞质以及胞膜上呈现高表达状态,且随着注射海洛因时间的延长而明显增多,与海洛因的给药时间和剂量呈依赖关系,这种依赖关系也使神经元细胞的凋亡数量随海洛因药物的增加而增多,因此说明TNF-α参与了海洛因致神经元凋亡的过程,在一定程度发挥了死亡受体调控凋亡的相关作用。在海洛因成瘾组Rho 蛋白亦显著上调,并随着给药时间的延长,Rho 蛋白表达量呈现上升趋势,具有明显的时间依赖关系,这进一步也表明Rho蛋白也参与了海洛因致神经元凋亡过程。有研究表明C-AbI激活后,能够对细胞正常生理活动产生影响,可引发细胞周期阻滞,严重时可诱发细胞发生凋亡现象 。但是,课题组在研究C-AbI蛋白时发现,在长时间海洛因作用大鼠过程中,小脑组织中基本无表达,高浓度海洛因作用大鼠时,C-AbI蛋白亦无表达,与对照组没有显著差异,这表明C-AbI在海洛因致神经元损伤过程中可能没有发挥调控作用,这结果与Avram等[22]研究认为C-AbI具有抗凋亡的作用不一致。那么C-AbI在海洛因致神经元凋亡过程究竟发挥怎样的作用还需本课题组进一步深入研究证实。
本课题组在前期研究结果中发现,凋亡过程中相关因子P-C-Jun、cytc、Caspase-8等蛋白与TNF-ɑ、Rho蛋白在海洛因作用大鼠时间和浓度变化趋势基本相似,由此我们认为JNK/C-Jun 与TNF-α、Rho是相互作用的结果,这与Yarza等[20]观点相一致。在海洛因作用下,激活JNK激酶可上调TNF-α因子的合成,而TNF-α因子与JNK可以起到双向调节作用,因此反过来它又可以促进JNK 的进一步活化,从而形成双向循环使其效应进一步放大。Rho 蛋白亦可能是与PAK相结合,使其磷酸化而被激活,从而进一步使C-jun/JNK凋亡信号通路激活而发挥凋亡作用。本课题在体外培养神经元细胞,海洛因长期作用后而导致TNF-α升高的结果与动物实验长期吸食阿片类物质(海洛因)导致TNF-α蛋白升高相一致,进一步明确了阿片类物质可直接影响TNF-α表达。这一定程度说明了死亡受体途径和神经酰胺途径对激活JNK信号通路在海洛因致神经元细胞凋亡过程中起促凋亡作用。TNF-α和Rho因子可作为治疗靶向因子,为临床上预防海洛因吸食者发生神经系统及因滥用而发生猝死提供临床诊疗依据,也为法医学上因为海洛因滥用发生脑卒中提供理论依据。而C-AbI因子在此过程中变化不明显,提示旁路激活途径在海洛因致神经元细胞凋亡过程中可能未发挥作用,这还需课题组深入研究和进一步探索。
