表面脱乙酰化甲壳素颗粒固定溶菌酶及酶学性质研究
2019-04-01,,,,,,
,,,,,,
(青岛科技大学化工学院,山东青岛 266042)
溶菌酶可催化降解细菌细胞壁中肽聚糖的β-1,4-糖苷键以发挥抗菌作用[1],它广泛存在于细菌、真菌、植物、鸟类和哺乳动物中,是脊椎动物体内重要的免疫因子。溶菌酶被广泛用于食品防腐保鲜[2-3]、疾病(白血病、肾病、脑膜炎、肿瘤等)的临床诊断[4-7]、眼部和口腔等的抗菌药物[8]以及抗肿瘤药物等[9-10]。
然而,游离溶菌酶的稳定性较差,且分离纯化成本高,使其应用受到极大限制,而将溶菌酶固定化则可部分解决上述问题。溶菌酶的固定化方法一般包括物理法和化学法。物理法尽管也可获得较好的固定化效果[11-12],但稳定性普遍较化学法低。化学法以共价法为主,如将溶菌酶共价固定于羊毛载体[13]、介孔硅[14]、壳聚糖[15]、氧化石墨烯[16]、AB-8大孔树脂[17]、聚四氟乙烯膜[18]、尼龙66[19]、纤维素膜[20]等。
壳聚糖是甲壳素部分脱乙酰的衍生物,具有生物相容性、低毒性和抗菌活性[21-22],其分子中的游离氨基可通过双功能试剂戊二醛与溶菌酶发生偶联。但壳聚糖溶于酸性溶液[23],不利于溶菌酶(最适pH为酸性)的固定化,因此,本文将甲壳素颗粒进行表面脱乙酰,得到具有一定机械强度的不溶性固定化载体,并将溶菌酶固定于表面脱乙酰化的甲壳素颗粒上,与载体一起共同构成环境友好型抗菌材料,旨在用于食品包装、清洁用品、创口辅料等中,以延长其保藏期。
1 材料与方法
1.1 材料与仪器
甲壳素(来源于雪蟹) 山东莱州市海力生物制品有限公司;溶菌酶(E.C.3.2.1.17,来源于蛋清,活力153000 U/mg) Sigma-Aldrich(L2879)公司;3-甲基-2-苯丙噻唑啉酮腙(MBTH) Sigma-Aldrich公司;二硫苏糖醇(DTT)、半脱乙酰壳聚糖(脱乙酰度为49.8%,1H-NMR) 实验室自制[24];其它试剂均为分析纯 国药集团化学试剂有限公司。
SHZ-82水浴恒温振荡器 常州国华电器有限公司;FE 20数字酸度计 梅特勒-托利多仪器有限公司;UNICO 2100紫外-可见光分光光度计 尤尼柯(上海)仪器有限公司;移液器 赛默飞世尔(上海)仪器有限公司。
1.2 底物溶液的配制与固定化方法
1.2.1 底物溶液的配制 以2 mg/mL的半脱乙酰度壳聚糖底物溶液为例,称取200 mg半脱乙酰度壳聚糖于烧杯中,用0.2 mol/L、pH为4.5的HAc-NaAc缓冲溶液充分溶解,调节pH至4.5,用容量瓶定容至100 mL,转移至试剂瓶中于4 ℃储藏备用。
1.2.2 固定化方法
1.2.2.1 甲壳素载体的活化 将甲壳素颗粒(20~40目)按1∶20 (w/v)的比例置于20% NaOH中,于90 ℃水浴分别加热一定时间后,立即用流水冷却至室温,抽滤,用蒸馏水反复洗涤以脱除NaOH,抽干后,将其浸泡在0.2 mol/L的乙酸溶液中过夜,然后用蒸馏水洗至中性,抽干,按照1∶20 (g/mL)的比例浸入一定浓度、一定pH的戊二醛溶液中,于25 ℃恒温水浴中反应3 h,而后置于冰箱中14 h,用水反复洗涤以除去残留戊二醛,抽干备用。
1.2.2.2 酶偶联 将已活化的载体按1∶20 (g/mL)浸入溶菌酶溶液中,于4 ℃过夜,过滤(取滤液测定残留蛋白浓度),用缓冲液洗涤固定化酶,直至滤液中蛋白浓度为0。
1.2.2.3 固定化条件的正交试验设计 根据本实验前期的研究结果[24-25],分别以脱乙酰时间(A)、戊二醛浓度(B)、载体活化pH(C)为三因素,根据表1的水平设置,按照1.5.1和1.5.2的方法进行溶菌酶的固定化,以蛋白利用率、活力回收率、保藏稳定性经过归一化处理后计算得到的综合评分Y′作为考察指标进行正交试验,以优化载体活化条件。给酶量为0.5 mg/mL,酶液pH为4.5。
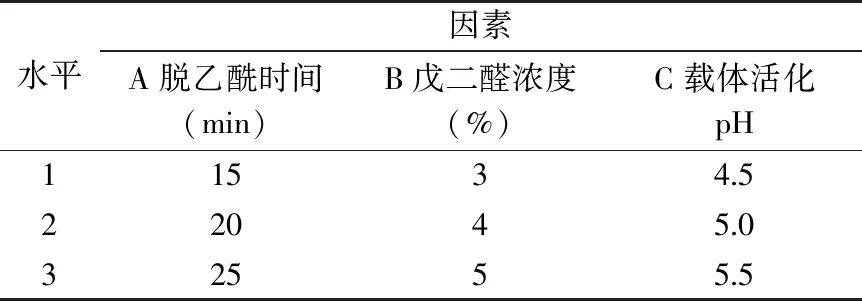
表1 载体活化正交试验因素水平表Table 1 Factors and levels used in orthogonal test for activation of carrier
1.3 蛋白浓度的测定与蛋白利用率的计算
1.3.1 蛋白浓度的测定 按照Folin酚法[26]配制Folin甲和Folin乙,取1 mL蛋白溶液与5 mL Folin甲充分混匀,于25 ℃下反应10 min,再加入0.5 mL Folin乙,立即混匀,于25 ℃反应30 min后,测定750 nm处吸光度值。
1.3.2 标准曲线的绘制 首先配制250 μg/mL牛血清白蛋白溶液,继而将其稀释并配成0、25、50、100、150、200、250 μg/mL蛋白溶液,根据1.3.1的方法测定蛋白质浓度,以蛋白质浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.3.3 蛋白利用率的计算 蛋白利用率是指固定化过程中结合蛋白质的量占总给酶蛋白的百分比。
蛋白利用率(%)=(酶液中酶蛋白初始总质量-固定化后残液中酶蛋白质量)/酶液中酶蛋白初始总质量×100
式(1)
1.4 酶活力的测定方法
1.4.1 N-乙酰氨基葡萄糖浓度的测定及标准曲线的绘制 参照文献[27]的方法,稍加修改。取2 mL葡萄糖溶液于试管中,加入2 mL,0.5 mol/L NaOH的溶液,充分混匀后,取三个1.2 mL作三个平行样,分别加MBTH试剂600 μL,混匀,于80 ℃水浴加热,趁热加入1.2 mL的硫酸铁铵试剂,充分混匀,冷却至室温于620 nm测吸光度值。
首先配制19.25 mg/mL N-乙酰氨基葡萄糖溶液,继而将其配制成0、12.43、24.86、37.30、49.73、62.16、74.59、87.03 μmol/L 8个稀释梯度的N-乙酰氨基葡萄糖溶液,根据上述方法测定吸光度值,作浓度-吸光度值标准曲线。
1.4.2 游离溶菌酶活力的测定 根据文献的方法[28]稍加修改。将预热至35 ℃的9.9 mL的底物溶液与0.1 mL,0.5 mg/mL(以0.2 mol/L的HAc-NaAc溶解)的溶菌酶溶液混合,置于35 ℃水浴摇床中酶解30 min后,从中取2 mL酶解液迅速加入到2 mL 0.5 mol/L NaOH溶液中以终止酶解反应,按照1.4.1的方法测还原糖浓度。以9.9 mL壳聚糖溶液和0.1 mL,0.2 mol/L的HAc-NaAc溶液为空白对照。
溶菌酶活力单位被定义为在上述条件下,每分种内转化成1 μmol/mL相当于N-乙酰氨基葡萄糖的量为1个酶活力单位。
1.4.3 固定化溶菌酶活力的测定 在锥形瓶中,按照1 g固定化酶/20 mL底物溶液的比例加入已预热至35 ℃的底物溶液,置于35 ℃的水浴摇床中酶解30 min,从中取上清液2 mL迅速加入到2 mL 0.5 mol/L NaOH溶液中,充分混匀,按照1.4.1的方法测定还原糖浓度。以底物溶液代替酶解液重复如上操作作为酶解空白。
1.4.4 活力回收率计算 活力回收率是指固定化酶的活力所占给酶总活力的百分比。

式(2)
1.4.5 保藏稳定性计算 保藏稳定性是指固定化酶在保存15 d后所占初始固定化酶活力的百分比。

式(3)
1.5 综合评分的计算
为使正交试验结果的各指标处于同一数量级,消除各指标量纲,以便综合评分,需首先分别进行归一化处理[29]。设同一指标中,最大值为Ymax,对应100分;最小值为Ymin,对应0分,则相应的指标值:
式(4)
1.6 固定化对溶菌酶性质的影响
1.6.1 固定化对溶菌酶最适pH的影响 参照1.4.3的方法,分别测定固定化酶在pH为3、3.5、4.0、4.5、5.0、5.5、6.0、6.5条件下的酶活力;参照1.4.2的方法,分别测定游离溶菌酶在pH为3.5、4、4.5、5四个条件下的酶活力。以相对酶活力为指标对比固定化前后最适pH的改变。
1.6.2 固定化对溶菌酶最适温度的影响 参照1.4.3的方法,分别测定固定化酶在温度为35、45、55、65、70、75、80、85、90条件下的酶活力;参照1.4.2的方法,分别测定游离溶菌酶在温度为55、60、65、70、75、80、90条件下的酶活力。以相对酶活力为指标对比固定化前后最适温度的改变。
1.6.3 固定化对溶菌酶Km值的影响 根据1.6.1和1.6.2的实验数据,以及Lineweaver-Burk[30]的原理,作1/v-1/s图,通过线性回归计算并求得Km值。
1.6.4 相对酶活力计算 相对酶活力值是指设最大酶活力为100%,求其他酶活力值相对于最大酶活力值的相对比值。

式(5)
1.7 数据处理
用Excel 2016和SPSS 16.0进行数据处理和方差分析。
2 结果与分析
2.1 标准曲线的绘制
评价酶固定化效率的高低包括蛋白利用率、酶活力回收率及固定化酶的稳定性,其中涉及蛋白浓度的测定和溶菌酶活力的测定,分别采用Folin酚法和MBTH法。尽管Folin酚法比紫外法操作繁琐,但可避开杂质对测定的干扰,其用于蛋白浓度测定的标准曲线如图1所示,其在0~0.25 mg/mL线性范围内的标准曲线为y=2.316x+0.0276,R2=0.9912。在酶活力测定方面,与常用的溶壁微球菌法相比,MBTH法采用在碱性条件下可溶的半脱乙酰壳聚糖为底物,以MBTH试剂取代常用的DNS试剂,使方法更灵敏、更准确、更便捷,其用于酶活力计算的标准曲线如图2所示,其在0~87.03 μmol/L线性范围内的标准曲线为y=0.0101x+0.0095,R2=0.9992。

图1 牛血清白蛋白标准曲线Fig.1 Bovine serum albumin standard curve
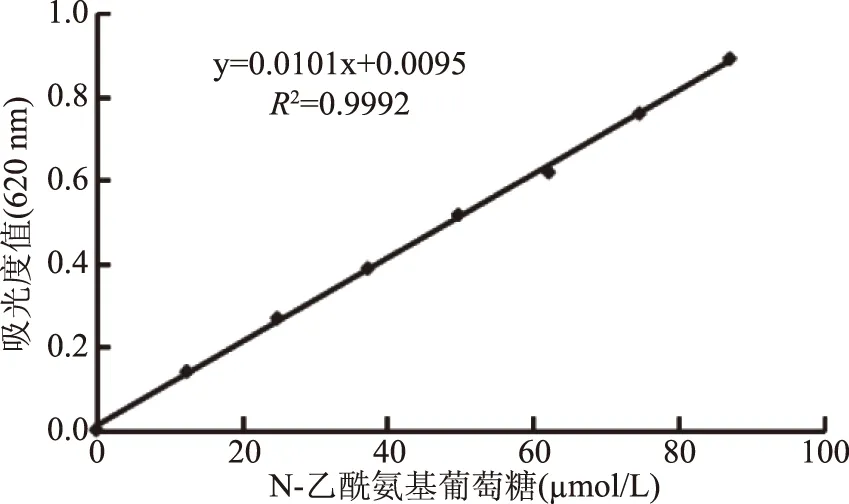
图2 N-乙酰氨基葡萄糖标准曲线Fig.2 N-acetylglucosamine standard curve
2.2 载体活化条件优化
用于酶固定化的载体必须具有良好的机械性能、生物相容性和含有一定反应性的官能团。来源于蟹壳的甲壳素基本具备上述三个条件,但由于甲壳素结构中,乙酰基含量较高,其脱乙酰度,即氨基含量,基本在20%以下,不利于戊二醛与其偶联而形成希夫碱,而将甲壳素颗粒脱乙酰化则可解决上述问题。
正交实验结果见表2,由R值可得,三个因子对指标值的影响次序为A>B>C;由k值可得,最优组合为A3B3C2,恰为正交实验中的第9组。方差分析见表3,脱乙酰时间影响显著(p<0.05),而戊二醛浓度和载体活化pH影响不显著(p>0.05),这与正交试验的分析结果一致。从9号试验组得知,溶菌酶固定化的直观最优条件分别为:脱乙酰时间(A)为25 min,戊二醛浓度(B)为5%,载体活化pH(C)为5.0,在此条件下测得的蛋白利用率为28.7%,活力回收率为91.0%,保藏稳定性为66.0%。由此看来,在固定化实验中,给酶量(0.5 mg/mL)和酶液pH(4.5)的设定均合理。
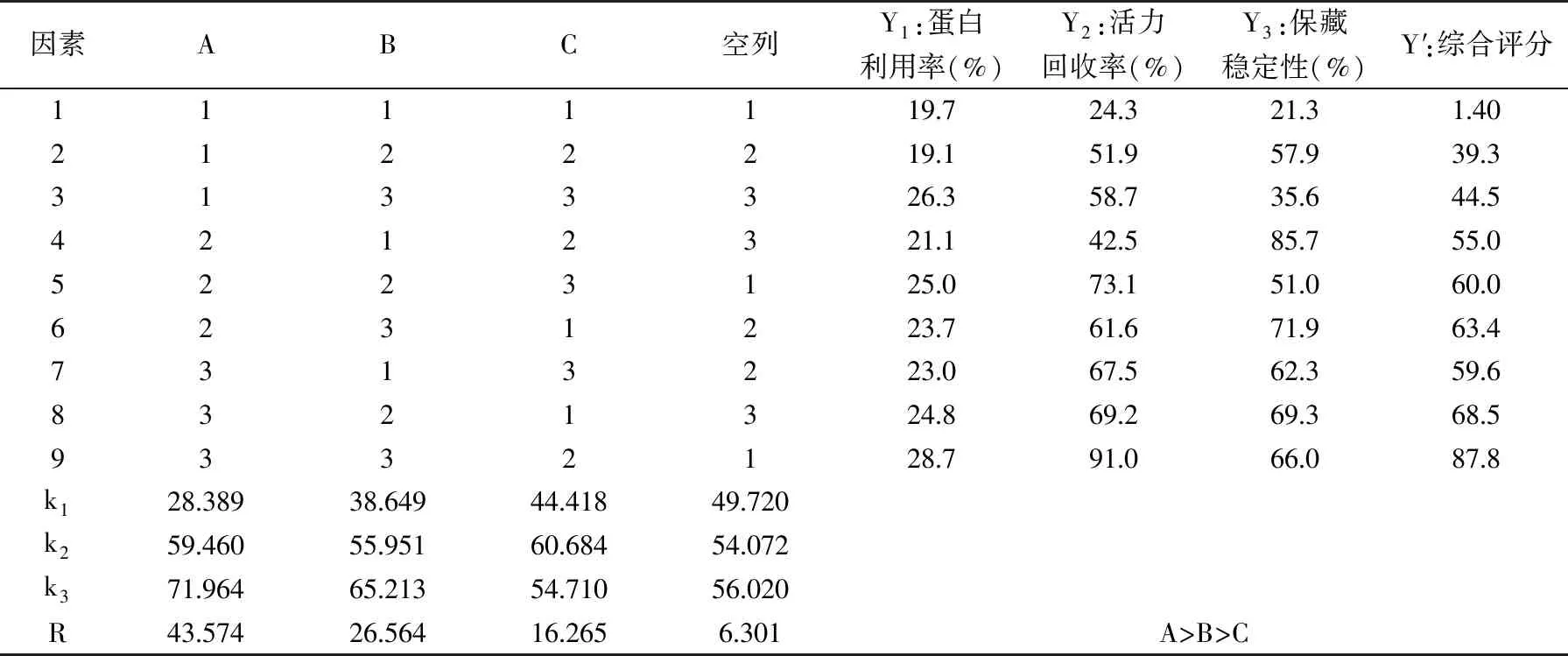
表2 L9(34)正交试验结果Table 2 L9(34)orthogonal test results
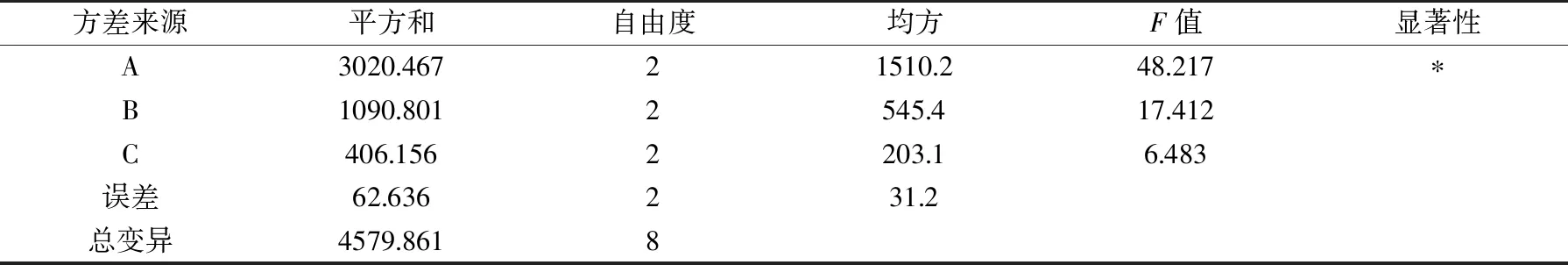
表3 正交试验方差分析表Table 3 Analysis of variance of overall index score
2.3 固定化对溶菌酶活力的影响
溶菌酶经过固定化后其最适的酶解pH和温度都有可能会发生偏移[31],根据其酶学性质的变化可推测溶菌酶与载体的结合方式及其对酶活性中心的影响。
2.3.1 固定化对溶菌酶最适pH的影响 结果如图3所示,游离溶菌酶的最适pH为4,稍有偏离,其活力即明显下降;而固定化后,尽管溶菌酶的最适pH为3.5,向酸性偏移了0.5个单位,但是,它在较宽的pH范围内仍能体现酶活力。这是因为壳聚糖为阳离子载体,在将溶菌酶固定化后会使酶微环境的pH增大,只有降低外围环境的pH抵消这一影响,才能使酶反应的微环境达到最适的pH。此现象与其它以壳聚糖为载体的酶固定化结果相一致[32]。Jiang等[33]将溶菌酶物理吸附于几丁质晶须,并考察了其抗菌活性,该文采用的固定化溶菌酶的活力测定方法为溶壁微球菌法,文中并无相关酶学性质研究,而本文以半脱乙酰壳聚糖为底物研究固定化溶菌酶的酶学性质尚属首例。
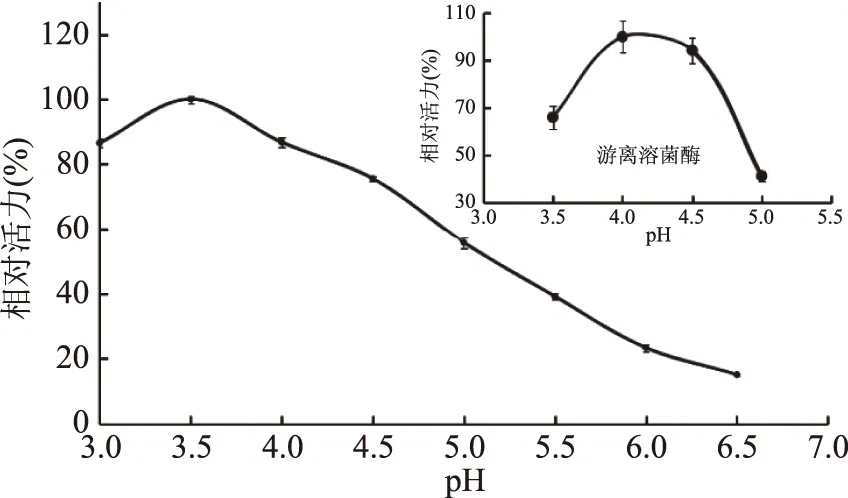
图3 固定化对溶菌酶最适pH的影响Fig.3 Effect of immobilization on the optimum pH of lysozyme
2.3.2 固定化对溶菌酶最适温度的影响 如图4所示,游离溶菌酶的最适温度为75 ℃,在70~75 ℃范围内保持较高活力;而固定化溶菌酶的最适温度为80 ℃,且在70~90 ℃范围内维持较高的活力达95%,体现较高的温度稳定性。这可能是由于酶与载体的共价结合位点使溶菌酶的活性中心在高温下仍能维持应有的空间构象,从而使溶菌酶发挥较高活力。郭庆启等[17]以戊二醛为交联剂,将溶菌酶固定于AB-8大孔树脂上,其最适温度虽然也升高5 ℃,但45 ℃后酶活力显著降低。潘军军等[34]将溶菌酶固定于羊毛织物上,但并未研究固定化酶的最适温度,考察了固定化溶菌酶在40 ℃下的热稳定性,保温100 min后仍保持96%的热稳定性。
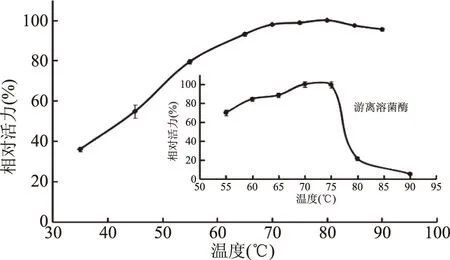
图4 固定化对溶菌酶最适温度的影响Fig.4 Effect of immobilization on the optimum temperature of lysozyme
2.3.3 固定化对溶菌酶Km值的影响 Km值表示酶对底物的亲和力,Km值越小说明酶对底物的亲和力越大,越有利于溶菌酶发挥催化活力。如图5所示,溶菌酶经固定化后,其表观Km值(2.69 mg/mL)比游离酶的(1.75 mg/mL)明显增大。说明溶菌酶分子表面的固定位点较多,固定化后一定程度上束缚了酶与底物之间的相互作用,这是共价固定化酶的普遍现象,但本实验中Km值的变化幅度并不大,如图5所示,因此,可认为固定化结合位点及其数量既达到了提高溶菌酶热稳定性的作用,又没有显著影响溶菌酶的酶解性能。目前尚未发现与本文所做的固定化溶菌酶的Km值测定类似的报道。
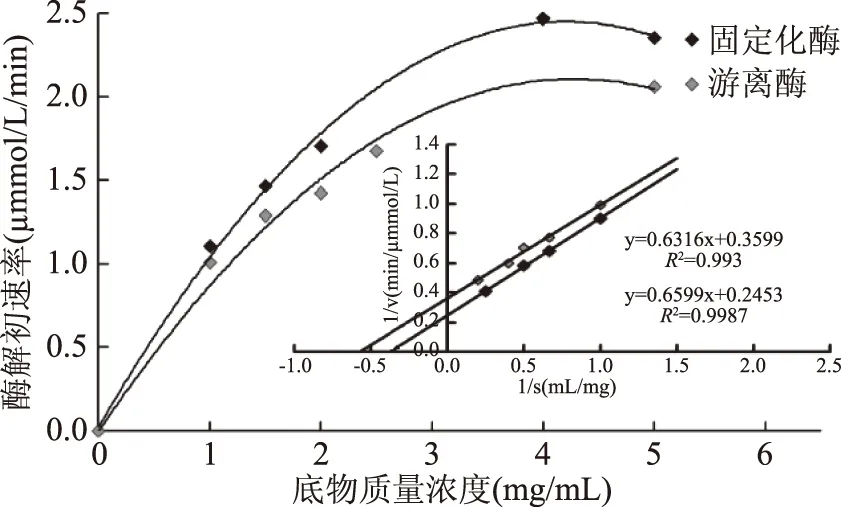
图5 固定化对溶菌酶Km值的影响 Fig.5 Effect of immobilization on the Km of lysozyme
3 结论
本文以具有一定机械性能的雪蟹甲壳素颗粒为载体,对其表面部分脱乙酰,使其与戊二醛发生交联后再固定溶菌酶,固定化的最佳脱乙酰时间(A)为25 min,戊二醛浓度(B)为5%,载体活化pH(C)为5.0,且其影响因素A>B>C。所得到的固定化酶的表观最适pH由4.0降至3.5;最适温度由75 ℃升高至80 ℃,且在70~90 ℃仍保持95%活力;Km为2.69 mg/mL明显大于游离酶的1.75 mg/mL;且15 d稳定性保持66%。其兼顾了溶菌酶的抗菌、稳定与应用性能,与载体一起共同构成环境友好型抗菌材料,使其在食品包装、清洁用品、创口辅料[35]等领域具有广阔的应用前景。
