蒸制时间对滇黄精色泽、可溶性成分及糖含量的影响
2019-04-01,,,,*
,,,,*
(1.广西百色农业学校,广西百色 533000;2.曲靖师范学院化学与环境科学学院,云南曲靖 655011)
滇黄精(PolygonatumkingianumColl. et Hem-sl)是百合科(Liliaceae)黄精属(PolygonatumMill.)植物,主产于云南,在四川、贵州、广西等地也有分布,生长在海拔2000~3900 m的阴湿林地和灌木丛中。滇黄精是中药黄精的3个基源品种之一[1]。黄精是我国传统中药之一,自古为药食兼用,2012年国家卫计委公布黄精既为食品又是药品。它的治疗和保健作用已被我国两千多年的临床实践所证实,主要功效为降血糖、降血脂、预防动脉粥样硬化、保护心脑血管、补益肾精、滋阴润肺、增强免疫功能、延缓衰老、改善记忆功能、防止老年痴呆、抗抑郁、抗炎等[2-6]。
生黄精会刺激咽喉,导致口舌麻木,故需炮制后入药或食用,以消除其刺激性,降低毒性,使其滋而不腻,同时增强其补脾润肺益肾的作用[7-9]。黄精经过炮制后,糖性变浓,质地变软,略带甜味,易吸潮,口感变好,可直接食用或泡水饮用。目前对黄精炮制后成分研究,集中在主要活性成分黄精多糖、黄精低聚糖及皂苷方面[10-11]。黄精多糖对大肠杆菌、金黄色葡萄球菌和藤黄球菌均具有明显的抑制作用[12-13],是兴奋免疫的主要活性成分[14-15],还具有显著的抗骨质疏松作用和抑制α-葡萄糖苷酶的作用[16-18]。黄精的营养价值十分丰富,近年来在保健食品等领域的开发应用逐渐增加[19],受到食品行业的广泛关注。滇黄精炮制宜直接蒸制加工成饮片[20],其工序短成本低,易推广,为此本文研究了蒸制滇黄精的时间对色泽、可溶性成分、还原糖、葡萄糖、粗多糖的影响,同时试验了模拟胃肠道环境后糖的变化情况,为炮制和深入开发功能性黄精产品提供参考依据。
1 材料与方法
1.1 材料与仪器
滇黄精 云南曲靖市煜欣农林生物科技有限公司药材种植基地提供;胃蛋白酶 猪胃粘膜,Potency:1∶3000,USP,南京都莱生物技术有限公司;胰酶粉 Potency:1∶4000,BR,上海瑞永生物科技有限公司;葡萄糖、苯酚等试剂均为分析纯。
TU-1810紫外分光光度计 北京普析通用仪器有限责任公司;AL204-IC电子分析天平 梅特勒-托利多仪器(上海)有限公司;LD-4台式离心机 常州天瑞仪器有限公司;QL-866漩涡混合器 海门市其林贝尔仪器制造有限公司;PS-40超声波仪 深圳市超艺达科技有限公司;WHY-2往返水浴恒温振荡器 江苏省金坛市大地自动化仪器厂;DHG-9145A电热鼓风干燥箱 上海一恒科学仪器有限公司;202-0恒温干燥箱 北京市永光明医疗仪器有限公司;LC-ZFG002蒸饭柜 广东乐创电器有限公司;安稳免调码血糖仪 三诺生物传感股份有限公司。
1.2 试验方法
1.2.1 干燥及蒸制 新鲜滇黄精清洗干净,切片(厚度约2 mm),日晒干燥,混匀,得滇黄精干片。取干片约500 g,粉碎,过80目筛,在105 ℃干燥箱中烘至恒重,得未蒸制检测样,放于干燥器中备用。取干片约2.5 kg,加入约5 kg纯水,间隔约30 min翻动一次,吸完水后,放入蒸饭柜进行蒸制。蒸制到12、24、48、72、96 h时,混匀后分别取出约500 g,在105 ℃鼓风干燥箱中烘干,粉碎,过80目筛,再在恒温干燥箱中烘至恒重,得蒸制不同时间的检测样,放于干燥器中备用。
1.2.2 色泽试验 分别准确称取1 g检测样,分别置于100 mL容量瓶中,加入50 mL纯水,放入沸水浴中1 h,再放入240 W超声仪中超声处理20 min,冷却定容,过滤(前约10 mL弃之),取0.5 mL滤液再定容到10 mL容量瓶,于200~600 nm扫描,确定最大吸光波长,同时检测最大吸光波长下的吸光度和284 nm波长下的吸光度。
1.2.3 可溶性成分的检测 参照GB 5009.3-2016。
醇可溶性成分含量的检测:精密称取3 g检测样,置于50 mL离心管中,加入80% vol乙醇30 mL,旋涡振荡3 min,放入240 W超声仪中超声30 min,取出后离心15 min(4500 r/min),清液中含醇可溶性成分。不溶物再加入80%vol乙醇同法重复提取3次,合并乙醇清液到已在105 ℃恒重的150 mL烧杯中,放入70 ℃鼓风干燥箱中除去乙醇后,再放入105 ℃恒温干燥箱中烘至恒重,计算80% vol乙醇可溶性成分的质量分数。
水可溶性成分含量的检测:上段中得到的醇提不溶物用40 mL纯水代替80% vol乙醇30 mL同法提取、除水、冷却、称重,直至恒重,得到水可溶性成分,计算水可溶性成分的质量分数。计算公式:
可溶性成分的含量(%)=[恒重后烧杯和可溶性成分的质量(g)-恒重烧杯的质量(g)]/原料质量(g)×100
残渣含量的检测:水提取后的不溶物转入到105 ℃恒重后的称量瓶中,在105 ℃干燥箱中烘至恒重,计算残渣占检测样的质量分数。
试验精密度为在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。结果取两次独立检测结果的平均值。
1.2.4 淀粉、糊精的检测 在50 mL离心管中称取1.0 g未蒸制检测样干粉加水25 mL,沸水浴中加热15 min,离心10 min(4500 r/min),取清液10 mL,加入1 d碘溶液摇匀,观察是否有淀粉或糊精与碘溶液反应后呈现的蓝色或红色。
1.2.5 葡萄糖、还原糖的检测 精密称取1 g检测样干粉,置于10 mL容量瓶,加约8 mL纯水,超声处理10 min,纯水定容,用安稳免调码血糖仪检测葡萄糖含量,精密度为在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%,平均值为检测结果。
精密称取1~1.5 g检测样干粉,置于250 mL容量瓶中,加50 mL纯水,置于240 W超声仪中超声15 min,缓慢加入0.03% vol乙酸溶剂配制成的0.219 g/mL乙酸锌溶液5 mL和0.106 g/mL的亚铁氰化钾溶液5 mL,加纯水至刻度,混匀,静置30 min,用滤纸过滤,弃去初滤液约10 mL,取后续滤液按照GB5009.7-2016中第一法检测和计算还原糖含量。精密度为在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的5%,平均值为检测结果。
1.2.6 模拟胃、肠道环境后葡萄糖、还原糖的检测 参照文献[21],精密称取0.5~1 g待检测样干粉(未蒸制、蒸制12 h的称0.8~1 g,蒸制24、48、72、96 h的称0.5~0.8 g),置于100 mL组培瓶(称重)中,加入人工胃液9 mL(人工胃液:取稀盐酸16.4 mL(约2 mol/L),加水稀释成1000 mL,加入胃蛋白酶10 g,摇匀后,即得)放入37 ℃的摇床水浴1 h取出。用浓度为0.5%的氢氧化钠溶液调整pH=6.8后,加入人工肠液9 mL(取磷酸二氢钾3.4 g,加水250 mL使溶解,用0.1 mol/L氢氧化钠溶液调节pH至6.8;加水稀释至500 mL,加入胰酶5 g,即得)。放入37 ℃的摇床,水浴1 h取出,补充水到50.00 g(除去组培瓶质量)。用血糖仪检测葡萄糖的含量。没有加样品的为空白,同法同步操作检测葡萄糖含量,计算扣除。
同上述方法模拟胃、肠道环境处理后转入250 mL容量瓶,再同1.2.5中还原糖的检测方法检测还原糖含量。没有加样品的为空白,同法同步操作检测还原糖,计算扣除。检测精密度同1.2.5中要求。
1.2.7 粗多糖的检测 参照SN/T 4260-2015中的方法,以每毫升葡萄糖质量为横坐标(μg),吸光度(A)为纵坐标,制定标准曲线,得线性回归方程:Y=0.0096X-0.0065,R2=0.9999。
1.2.7.1 测定液的制备 精密称取0.5 g检测样,置于50 mL的离心管中,加纯水5 mL旋涡振荡使之充分分散润均,然后加入20 mL无水乙醇(此时乙醇浓度为80% vol),旋涡振荡5 min,然后放置于140 W的超声仪中,超声30 min后取出离心15 min(4500 r/min),不溶物加入80%vol乙醇15 mL同法旋涡振荡分散、超声、离心,不溶物再同法重复一次。不溶物用水洗出转移到250 mL容量瓶中,加水约至200 mL。然后放置于140 W的超声仪中,超声30 min,加水定容,滤纸过滤(初滤液10 mL弃之),得样品测定液。
1.2.7.2 回收率检测液的制备 分别精密称取0.5 g蒸制12、48 h的检测样,同上述测定液处理方法操作,操作至不溶物用水洗出转移到250 mL容量瓶后再在容量瓶中加入精密称取的标样葡萄糖0.05 g,加水约至200 mL,然后超声、定容、过滤(初滤液10 mL弃之),得回收率测定液。
1.2.7.3 回收率检测确定空白样 取蒸制12 h测定液各1 mL,分别置于20 mL具塞试管中按SN/T 4260-2015标准中“比色测定”进行检测,空白样分别采用纯水、1.0 mL纯水代替1.0 mL 5%的苯酚、1.0 mL纯水代替1.0 mL测定液、5.0 mL纯水代替硫酸、测定液1.0 mL加纯水6.0 mL进行空白样的考查。空白样采用与测定液相同的步骤平行进行处理后使用。分别计算葡萄糖含量。蒸制48 h的同法检测考查空白样。
取回收率测定液各1 mL,分别置于20 mL具塞试管中同测定液试验方法进行检测。通过使用上述中不同空白样的检测结果计算葡萄糖的回收率,从而确定最佳的空白样。
1.2.7.4 粗多糖的检测 取1 mL样品测定液于20 mL具塞试管中按SN/T 4260-2015标准中“比色测定”进行检测。未蒸制和蒸制12 h的空白样用1.0 mL纯水代替1.0 mL测定液,其余的空白样则用1.0 mL纯水代替1.0 mL 5%的苯酚,空白样与试样的测定平行进行,采用相同的分析步骤。检测精密度控制在重复性条件下的两次独立检测结果的绝对差值不超过算术平均值的10%,平均值为检测结果。
粗多糖计算公式:
注:W为粗多糖含量(g/100 g);m1为标准曲线回归方程计算得到的糖量(μg);m2为样品质量(g);V1为样品定容体积(mL);V2为比色测定所移取样品测定液的体积(mL);0.9为葡萄糖换算成粗多糖的校正系数(计算回收率时用葡萄糖计,不乘0.9)。
1.2.7.5 模拟胃肠道环境后粗多糖的检测 分别精密称取0.2~0.5 g(未蒸制、蒸制12 h的精密称0.2~0.3 g,蒸制24、48、72、96 h的精密称0.3~0.5 g)待检测样于50 mL离心管中,同1.2.6的方法和步骤进行胃、肠道模拟过程,其中加入的人工胃液、人工肠液修改为3 mL。模拟胃、肠环境后在离心管中加入80% vol乙醇28 mL,旋涡振荡混匀后置于140 W超声仪中超声30 min,取出离心15 min(4500 r/min),不溶物加入80% vol乙醇15 mL旋涡混匀后超声处理10 min,取出离心15 min(4500 r/min),不溶物再同法重复一次。不溶物用50~100 mL水洗出转移到250 mL锥形瓶中,以下步骤按SN/T 4260-2015中“比色测定”检测粗多糖。空白样、精密度同上述粗多糖的检测。
1.2.8 数据分析 检测数据采用IBM SPSS Statistics 21进行蒸制不同时间(同一列内)可溶性成分、糖含量的t检验分析。用Excel中无重复双因素方差分析,模拟胃肠道环境前后(列间)的差异性。
2 结果与讨论
2.1 色泽试验结果与讨论
黄精色泽随蒸制时间的延长而变深,蒸制48 h后的黄精干片肉眼难以区分色泽差,见图1。处理液通过紫外扫描比较,蒸制12 h后各样品最大吸光度的波长向长波移动,蒸制12 h最大吸光度波长为279.5 nm,蒸制96 h为286.5 nm,吸光度值与蒸制时间成线性关系,表1中λmax的线性方程为y=0.0164x+0.1725(y为吸光度,x为蒸制时间),R2=0.9934,说明长波呈色物质的含量随蒸制时间的延长而增加。黄精蒸制会产生5-羟甲基糠醛,有报道5-羟甲基糠醛是一种对身体有害的物质[22],但也有报道5-羟甲基糠醛在治疗疾病药物中的应用[23-25]。5-羟甲基糠醛会进一步反应生成一些结构不明的黑色素(类黑精)[26],有研究表明黄精炮制后得到的类黑精类成分具有较好的抗氧化活性,有益肾、健脾的作用,增加了功能性成分的含量,增强了生理作用[27],文献报道5-羟甲基糠醛在284 nm波长下具有非常好的线性关系[28],所以比较284 nm处吸光度值可说明生成5-羟甲基糠醛的变化。表1中λ(284 nm)的线性方程为y=0.0161x+0.1713(y为吸光度,x为蒸制时间),R2=0.9933。由此表明蒸制时间越长生成的长波呈色物质越多,5-羟甲基糠醛也越多。从生理功能方面评价,蒸制时间的延长是有益的。

图1 蒸制不同时间黄精色泽比较Fig.1 The color of Polygonatum kingianumof various streaming time
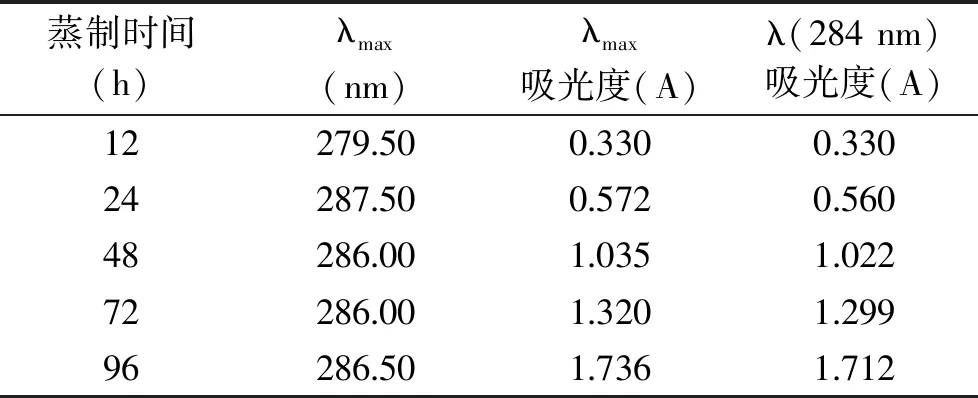
表1 色泽检测结果Table 1 The results of color detection
2.2 可溶性成分含量检测结果与讨论
80%vol乙醇可溶解单糖、低聚糖、色素、氨基酸等。水可溶解粗多糖、蛋白质、矿物质等。了解可溶性成分与蒸制时间的关系,对指导黄精炮制和产品开发有积极的意义。由表2可知,乙醇可溶性成分与水溶性成分含量随蒸制时间的延长呈现相反的对应关系。蒸制24、48 h乙醇可溶性成分最多,超过70%,蒸制12、24 h的差异极显著(p<0.01),蒸制24、48 h的差异不显著(p>0.05)。未蒸制的水溶性成分最高,蒸制导致水溶性成分先减少后增加,未蒸制到蒸制12 h时减少约7%,蒸制12~48 h继续减少约15%,变化极显著(p<0.01),蒸制24、48 h水溶性成分最少,低于10%,两者之间差异不显著(p>0.05),蒸制到72 h水提取物增加显著(p<0.05)。醇、水不溶性残渣在蒸制12 h时含量最高,差异极显著(p<0.01)。继续蒸制到24 h残渣含量下降,差异极显著(p<0.01),再继续蒸制到48 h差异变化不显著(p>0.05)。由表2可知需得到醇溶性成分高的滇黄精产品,蒸制时间应控制在24~48 h,需得到水溶性成分多的产品不应蒸制。蒸制会造成成分损失,由表2可知残渣含量多,总质量则相对低,蒸制时间对总质量变化影响不显著(p>0.05),通过乙醇提取物、水溶性提取物、残渣和总质量的考查可推测挥发性成分的变化情况,蒸制导致总质量减少的原因有待深入研究。
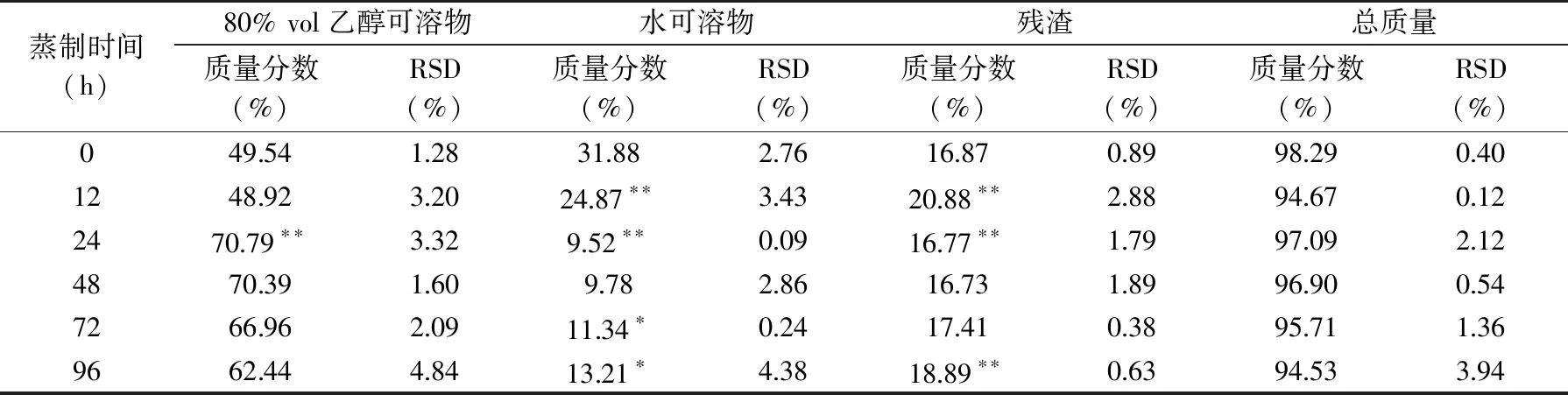
表2 蒸制不同时间黄精可溶物及残渣含量的检测结果Table 2 The content results of soluble substance and residue of Polygonatum kingianum with various steaming time
2.3 葡萄糖、还原糖、淀粉、糊精、粗多糖检测结果与讨论
2.3.1 葡萄糖 糖尿病主要是遗传和不良生活习惯导致的内分泌疾病,是由于胰岛素缺乏或者胰岛功能受损,以及肝脏、骨骼肌、脂肪等靶组织对葡萄糖的摄取量减少,而引发的一系列以高血糖为特征的代谢紊乱综合症[29]。目前控制糖尿病的方法主要采用注射胰岛素和控制葡萄糖的摄入量。如果功能性成分能增加胰岛素的产生或降低肠道对葡萄糖的吸收,就可达到控制高血糖病症的目的。由表3可知,蒸制48 h内葡萄糖增加较快,从12~48 h,变化极显著(p<0.01)。蒸制48 h后葡萄糖含量下降,原因可能是葡萄糖生成黑色素等成分所致。生黄精及其炮制品中含有小分子蔗糖和由半乳糖、阿拉伯糖、木糖、鼠李糖和葡萄糖组成的多糖[30-31],模拟胃肠道环境后可能产生葡萄糖。试验表明模拟胃肠道环境后葡萄糖含量有所增加,但与未蒸制的组间比较变化不显著(p=0.08)。蒸制96 h滇黄精再模拟胃肠道环境后的葡萄糖达到7.33%,与没有蒸制的比较增加约7%,与未模拟胃肠道的比较增加约3.8%,但葡萄糖含量相比其他常见食材则要低很多[21],说明滇黄精加工的食品是糖尿病人的理想选择。
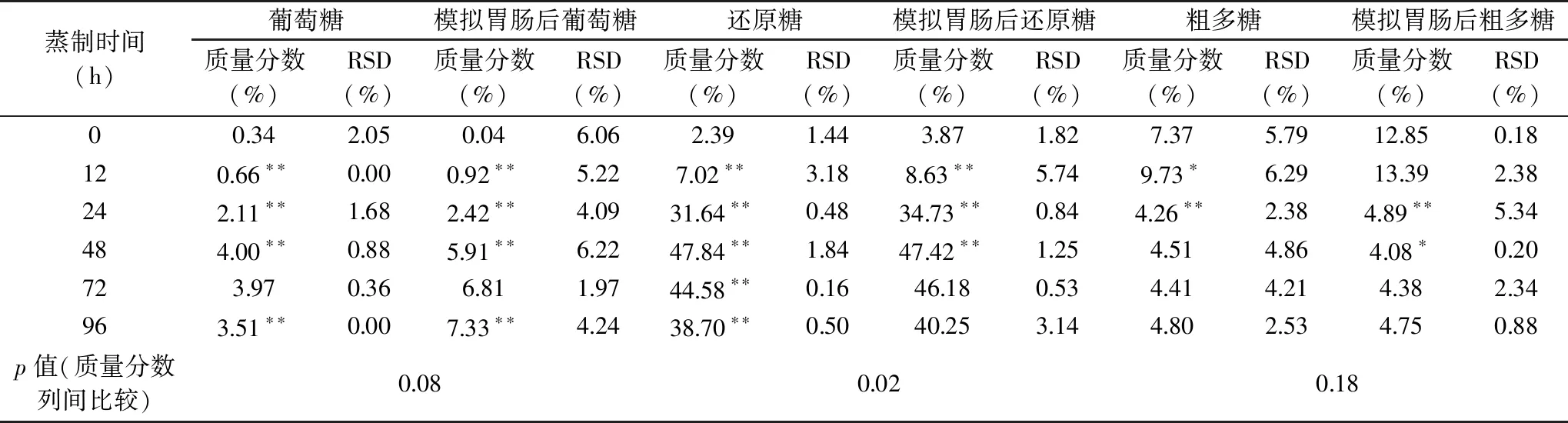
表3 糖含量的检测结果Table 3 The content results of sugar with various steaming time
2.3.2 还原糖 蒸制导致还原糖含量先增加后减少。蒸制到48 h还原糖含量达到最高47.84%,与没有蒸制的比对增加约20倍,蒸制后还原糖含量变化都极显著(p<0.01)。蒸制48 h后还原糖含量逐渐下降,减少原因可能是还原糖转化为类黑精或挥发性成分所致。模拟胃肠道环境前后两组间差异显著(p=0.02),变化规律基本相同。
2.3.3 淀粉和糊精 检测结果表明滇黄精中不含淀粉或糊精,符合SN/T4260中规定检测粗多糖不能含淀粉、糊精的要求。有相关报道黄精中含淀粉[32],可能是其它品种的黄精。
2.3.4 粗多糖 黄精蒸制后呈现褐色,导致粗多糖样品测定液有颜色,为此选择蒸制12 h(色泽较浅)和蒸制48 h(色泽较深)检测样进行回收率的考查。用考查回收率的方法确定最佳使用的空白样。空白采用纯水、1.0 mL纯水代替1.0 mL 5%的苯酚、1.0 mL纯水代替1.0 mL测定液、测定液1 mL加纯水6 mL、5.0 mL纯水代替硫酸。蒸制48 h黄精样品中葡萄糖的平均回收率分别为107.22%、100.28%、104.89%、107.24%、107.21%,平均回收率RSD分别为2.62%、2.79%、2.74%、2.68%、2.67%。蒸制12 h黄精样品葡萄糖的平均回收率分别为91.03%、90.69%、95.35%、91.04%、91.09%,平均回收率RSD分别为0.15%、0.15%、0.10%、0.15%、0.06%。为此最合理的空白选择是,测定液颜色较深(蒸制24 h后)的应选择用1 mL水代替苯酚作为空白,未蒸制及蒸制12 h颜色浅的应选择1 mL水代替样品作为空白。
有文献报道滇黄精中黄精多糖含量最高7.265%,最低为3.124%,云南蒙自市、保山县产的滇黄精中多糖含量分别为5.787%、3.124%[33],检测结果表明云南曲靖市产的滇黄精粗多糖为7.37%,含量较高。
蒸制到12 h,粗多糖从7.37%增加到9.73%,变化显著(p<0.05),继续蒸制粗多糖含量快速降低,从蒸制12~24 h粗多糖含量下降到4.26%,变化极显著(p<0.01)。蒸制24 h后随蒸制时间的延长粗多糖含量变化不显著(p>0.05),基本保持稳定。多糖含量减少,主要是因为黄精中的糖类成分和氨基酸多肽蛋白类成分在高温下发生了十分复杂的美拉德反应所致[27]。模拟胃肠道环境前后粗多糖的组间差异性不显著(p=0.18)。因此说明如果要在肠道中有更多具有降血糖功能性的粗多糖[19,34],则黄精的蒸制时间不宜超过12 h。
3 结论
滇黄精蒸制时间越长色泽越深、5-羟甲基糠醛越多,需要得到益肾、健脾功效的产品建议增加蒸制时间。蒸制48 h黄精可溶性成分及还原糖含量较高,是开发饮品类产品的好选择。蒸制会导致黄精粗多糖含量显著降低(p<0.05),如果开发粗多糖功效方面的产品蒸制时间应控制在12 h内。蒸制会导致供肠道吸收葡萄糖含量增加,但总量比其它常见食材的低。研究结果可供滇黄精的炮制和开发相关功能性产品提供蒸制时间的参考。
