红树莓籽黄酮微胶囊工艺优化及其体外模拟胃肠消化
2019-04-01,,*,,,,,,,*
,,*, ,,,,,,*
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.朝阳本色有机食品有限公司,辽宁朝阳 122312;3.辽宁新大地实业发展集团有限公司,辽宁沈阳 110168)
红树莓(RubusideausL.)属蔷薇科悬钩子属聚合类浆果,又称马林、山莓和覆盆子等,果实营养丰富,有着“黄金浆果”美誉[1-2]。红树莓皮薄多汁,极不易贮运,多被加工为果汁和果酒等,而副产物红树莓籽多被丢弃,造成资源浪费。红树莓籽富含黄酮类化合物[3],具有抗肿瘤、抗菌、降血脂和降血压等功效[4-6]。黄酮类化合物溶解性低,稳定性差[7],易受pH、温度、光照及添加剂影响被氧化分解,限制了其应用范围。
微胶囊技术是采用成膜材料将分散均匀的目的物包埋成微小粒子的一种微型包装技术,能够减少外界因素对芯材影响[8],提高稳定性。复凝聚法制备微胶囊是将两种带相反电荷胶体混合,聚电解质复合物沉积在芯材周围形成微胶囊[9],此法条件温和,操作简便,控释性好[10]。明胶是一种带正电荷的蛋白质,具有高相容性、乳化性及凝胶性[11],羧甲基纤维素钠(sodium carboxymethylcellulose,CMC)属一种纤维素衍生物,具有良好的溶解性、抗拮性和分散性[12-13],两者复合可形成凝聚物,用作微胶囊壁材。近年来,精油、维生素及色素等微胶囊研究报道较多[10,13],而黄酮类化合物相关研究主要集中于提取、纯化和药理活性等方面[3-4],以明胶和CMC为壁材通过凝聚反应包埋红树莓籽黄酮微胶囊尚未见报道。
因此,本试验以红树莓籽黄酮为芯材,明胶和CMC为壁材,通过响应面法优化复凝聚制备红树莓籽黄酮微胶囊工艺,旨在提高黄酮稳定性,扩大其应用范围。其次,将红树莓籽黄酮及其微胶囊进行水分含量、休止角、溶解度、粒径、差示扫描量热(differential scanning calorimetry,DSC)及体外胃肠消化分析,探究黄酮微胶囊理化特性及缓释效果,为其在食品领域应用提供理论依据。
1 材料与方法
1.1 材料与仪器
红树莓籽 大连中超食品有限公司;明胶、单干酯、CMC 食品级,广州市涛升化工有限公司;转谷氨酰胺酶(Transglutaminase,TG酶) 食品级,上海康达食品工程有限公司;胃蛋白酶、胰蛋白酶 分析纯,Sigma公司;猪胆盐 生化试剂,上海蓝季科技发展有限公司;亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、石油醚、甲醇 分析纯,天津市大茂化学试剂厂。
UV-2700紫外-可见分光光度计 日本岛津有限公司;Nano-ZS90激光粒度仪 英国马尔文公司;PYRIS DIAMOND TG/TA热分析仪 美国PE公司;DSCQ2000差示扫描量热仪 美国TA仪器公司;GT-100高通量组织研磨仪 北京格瑞德曼仪器设备有限公司;RE-52旋转蒸发仪 上海亚荣生化仪器厂;ALPH1-2LDPLUS真空冷冻干燥机 北京奥创兴业有限公司。
1.2 试验方法
1.2.1 红树莓籽黄酮提取 水分含量为3.8%红树莓籽在1200 r/min下研磨1 min,过60目筛,采用石油醚在料液比1∶10 g/mL、温度40 ℃下脱脂4 h,混合物抽滤分离,自然风干成粉;红树莓籽脱脂粉在料液比1∶30 g/mL、乙醇浓度80%、提取温度50 ℃下,提取2 h,抽滤,取滤液在55 ℃下旋蒸除醇,冷冻干燥成粉备用[14]。
1.2.2 红树莓籽黄酮微胶囊制备 分别配制一定质量分数明胶与CMC;取一定量红树莓籽黄酮于无水乙醇溶解后与明胶混匀,加入2%壁材总质量的单干酯,3000 r/min下乳化1 min,于一定温度水浴中缓慢加入CMC混匀,10%醋酸溶液调pH至4.5,300 r/min搅拌反应30 min;10% NaOH溶液调pH至6.5,10 ℃冰浴下加入TG酶固化1 h,静置、沉降、洗涤抽滤、真空冷冻干燥、粉碎得到红树莓籽黄酮微胶囊样品[15]。
1.2.3 红树莓籽黄酮微胶囊制备单因素实验
1.2.3.1 壁材配比选择 在壁材浓度1.5%、芯壁比1∶5 (w∶w)、反应温度40 ℃条件下,考察壁材配比(明胶∶CMC)分别为5∶1、7∶1、9∶1、11∶1、13∶1 (w∶w)对微胶囊包埋效果影响,根据包埋率选取最佳壁材配比。
1.2.3.2 壁材浓度选择 在壁材配比(明胶∶CMC)9∶1、芯壁比1∶5、反应温度40 ℃条件下,考察壁材浓度分别为0.5%、1.0%、1.5%、2.0%、2.5%对微胶囊包埋效果影响,根据包埋率选取最佳壁材浓度。
1.2.3.3 芯壁比选择 在壁材配比(明胶∶CMC)9∶1、壁材浓度1.5%、反应温度40 ℃条件下,考察芯壁比分别为1∶3、1∶4、1∶5、1∶6、1∶7 (w∶w)对微胶囊包埋效果影响,根据包埋率选取最佳芯壁比。
1.2.3.4 反应温度选择 在壁材配比(明胶∶CMC)9∶1、壁材浓度1.5%、芯壁比1∶5条件下,考察反应温度分别为30、35、40、45、50 ℃对微胶囊包埋效果影响,根据包埋率选取最佳反应温度。
1.2.4 响应面优化试验 在单因素实验基础上,选取对包埋效果影响较大的芯壁比(A)、壁材浓度(B)、反应温度(C)为因素,包埋率为响应值,采用Design-Expert 8.0.6软件Box-Behnken设计优化微胶囊制备工艺,因素及水平见表1。
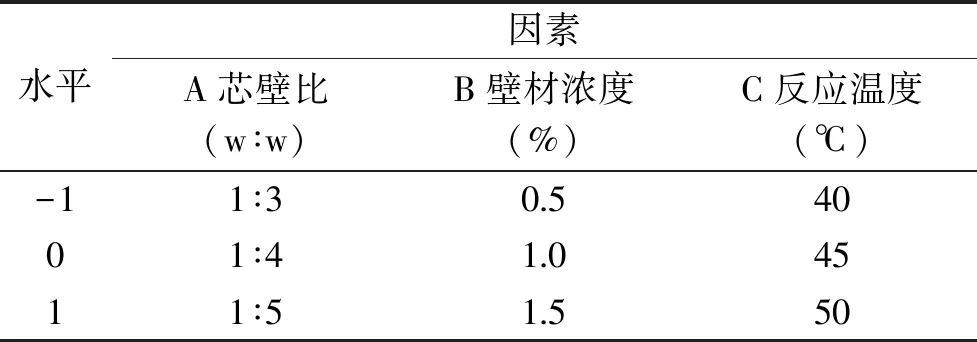
表1 响应面试验因素水平表Table 1 Factors and levels of response surface methodology
1.2.5 微胶囊包埋率测定 称取25 mg红树莓籽黄酮微胶囊于无水乙醇中溶解,反复振荡洗涤,过滤,滤液定容至25 mL,滤液中黄酮含量即为微胶囊表面黄酮含量;称取25 mg红树莓籽黄酮微胶囊于60%乙醇中溶解,反复振荡洗涤过滤,滤液定容至25 mL,滤液中黄酮含量即为微胶囊中黄酮含量[16]。微胶囊包埋率计算见公式(1)。

式(1)
1.2.6 黄酮微胶囊理化特性测定 水分含量测定参照GB5009.3-2016[17],休止角测定参照刘安然[18]方法,溶解度测定参照夏慧亭[19]方法,粒径测定参照廖霞等[20]方法,DSC测试参照刘成祥等[21]方法。
1.2.7 红树莓籽黄酮微胶囊体外胃肠模拟消化试验
1.2.7.1 体外模拟胃消化 分别称取0.25 g红树莓籽黄酮和0.50 g红树莓籽黄酮微胶囊,于10 mL生理盐水混匀后,加入4 mL的0.1 mol/L盐酸溶液和4 mL的8 mg/mL胃蛋白酶溶液,调pH至2.0,同时,以生理盐水替代酶液作空白对照,于37 ℃恒温水浴振荡器中分别消化0、0.5、1.0、1.5、2.0、2.5 h,取样后在4 ℃、8000 r/min条件下离心10 min,取上清液测定红树莓籽黄酮浓度[22-23]。
1.2.7.2 体外模拟肠消化 分别向体外胃消化2.5 h的黄酮及黄酮微胶囊胃消化液中加入1 mol/L的NaHCO3调pH至7.0,加入6 mL肠消化液(0.3 g胰酶和1.9 g猪胆盐溶于60 mL pH为7.0的0.1 mol/L NaHCO3-Na2CO3缓冲溶液),同时做肠液空白对照,于37 ℃恒温水浴振荡器中分别消化0.0、0.5、1.0、1.5、2.0、2.5、3.0 h,取样后在4 ℃、8000 r/min条件下离心10 min,取上清液测定红树莓籽黄酮浓度[24]。
1.2.8 黄酮含量测定 采用硝酸铝法[3],在波长510 nm处绘制的芦丁标准曲线为y=7.75x+0.047,R2=0.9996,线性关系良好,根据此标准曲线计算红树莓籽黄酮浓度。
1.2.9 数据处理 采用Microsoft Word 2003软件对数据进行绘图,SPSS 22.0软件进行显著性分析,水平为0.05。
2 结果与分析
2.1 红树莓籽黄酮微胶囊制备单因素实验结果分析
2.1.1 壁材配比对黄酮微胶囊化的影响 壁材配比对黄酮微胶囊包埋效果影响如图1所示,当明胶和CMC质量比在5∶1~9∶1内,包埋率显著升高(p<0.05),是因体系正负电荷差距逐渐缩小,凝聚效果逐渐增强;当壁材配比为9∶1时,包埋率最高,是因体系中正负电荷数较接近,复凝聚状态较佳[9];壁材配比在9∶1~13∶1时,包埋率显著降低(p<0.05),是因明胶比例过多,凝聚物流动性变差,易形成空囊。因此,选取最佳壁材配比(明胶∶CMC)为9∶1。

图1 壁材配比对微胶囊包埋率影响Fig.1 The effect of different wall ratios on the embedding rate of microcapsule注:不同小写字母表示差异显著(p<0.05),图2~图4同。
2.1.2 壁材浓度对黄酮微胶囊化的影响 壁材浓度对微胶囊包埋效果影响如图2所示,壁材浓度在0.5%~1.0%内,包埋率显著升高(p<0.05),是因随壁材浓度增加,芯材与壁材接触率增大,黄酮包埋效果逐渐增强;当壁材浓度为1.0%时,微胶囊包埋率达到最高;壁材浓度在0.5%~2.5%内,包埋率显著降低(p<0.05),是因壁材浓度过高,体系黏度过大,微胶囊相互碰撞粘连,导致芯材泄露[16]。因此,选取最佳壁材浓度为1.0%。

图2 壁材浓度对微胶囊包埋率影响Fig.2 The effect of different wall material concentrations on the embedding rate of microcapsule
2.1.3 芯壁比对黄酮微胶囊化的影响 芯壁比对微胶囊包埋效果影响如图3所示,当芯壁比为1∶3时,包埋率较低,是因芯材浓度过高,囊壁较薄,易出现裂缝,引起芯材渗透;芯壁比在1∶3~1∶4时,包埋率显著升高(p<0.05),是因随壁材浓度升高,囊壁厚度增加,芯材损失逐渐减少;当芯壁比1∶4~1∶7时,包埋率显著下降(p<0.05),是因芯材浓度过低,微囊形状不稳定,易聚集黏连[20],包埋率降低。因此,选取最佳芯壁比为1∶4。
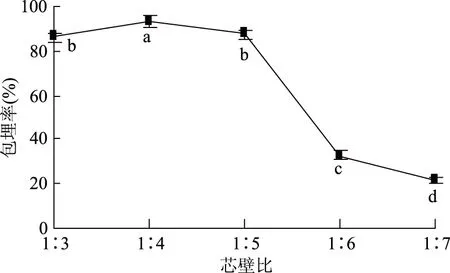
图3 芯壁比对微胶囊包埋率影响Fig.3 The effect of core/wall material ratios on the embedding rate of microcapsules
2.1.4 反应温度对黄酮微胶囊化的影响 反应温度对微胶囊包埋效果影响如图4所示,反应温度在30~45 ℃内,包埋率显著上升(p<0.05),是因随温度升高,壁材间凝聚力增大,交联反应增强;反应温度45 ℃时,包埋率达到最高;反应温度45~50 ℃内,包埋率显著降低(p<0.05),是因温度过高促使壁材扩散速率增大,不利于包埋,其次,对黄酮具有破坏作用[25]。因此,选取最佳反应温度为45 ℃。
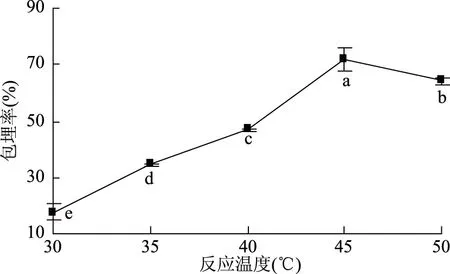
图4 反应温度对微胶囊包埋率影响Fig.4 Effect of reaction temperatures on the embedding rate of microcapsules
2.2 响应面优化试验结果分析
2.2.1 模型建立与显著性分析 根据表1响应面因素与水平,通过Box-Behnken设计得到17组试验,方案及结果见表2。
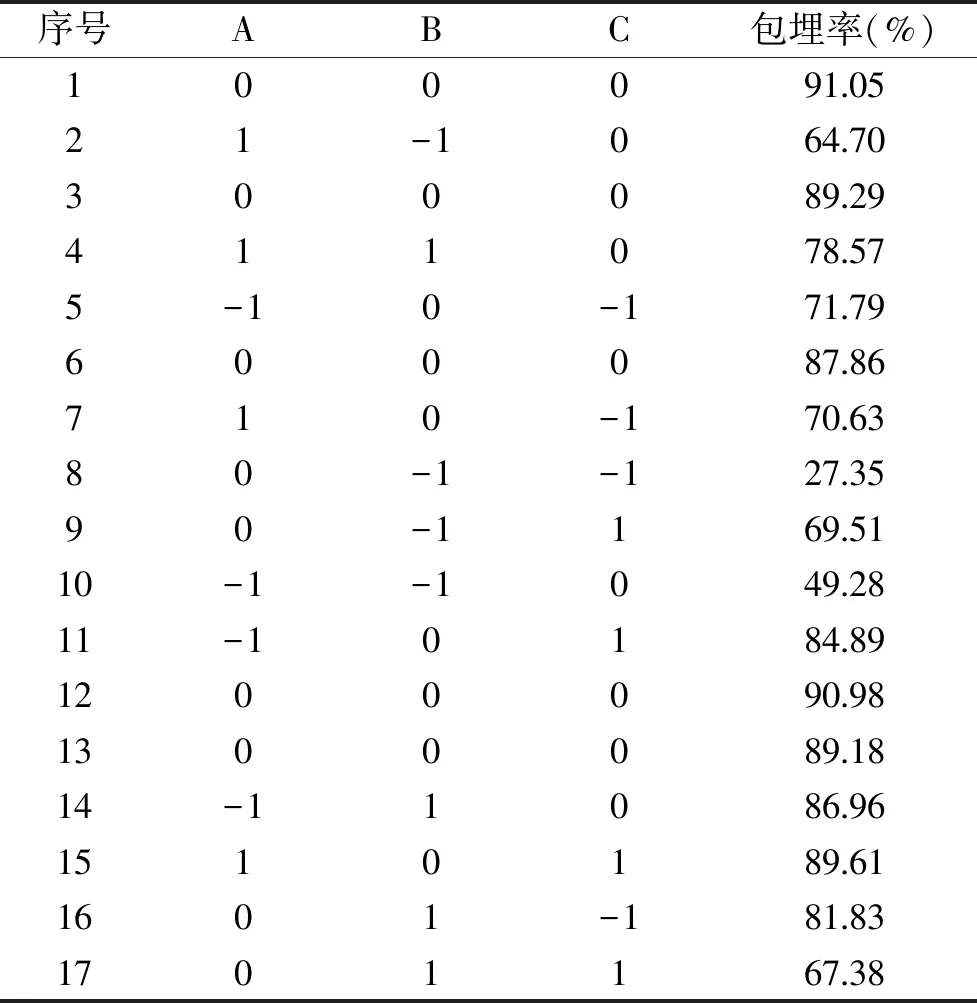
表2 响应面试验设计方案及结果Table 2 Experimental design and results for response surface analysis
利用响应面软件对表2数据进行分析,得到响应面试验模型回归系数及显著性检验结果见表3。
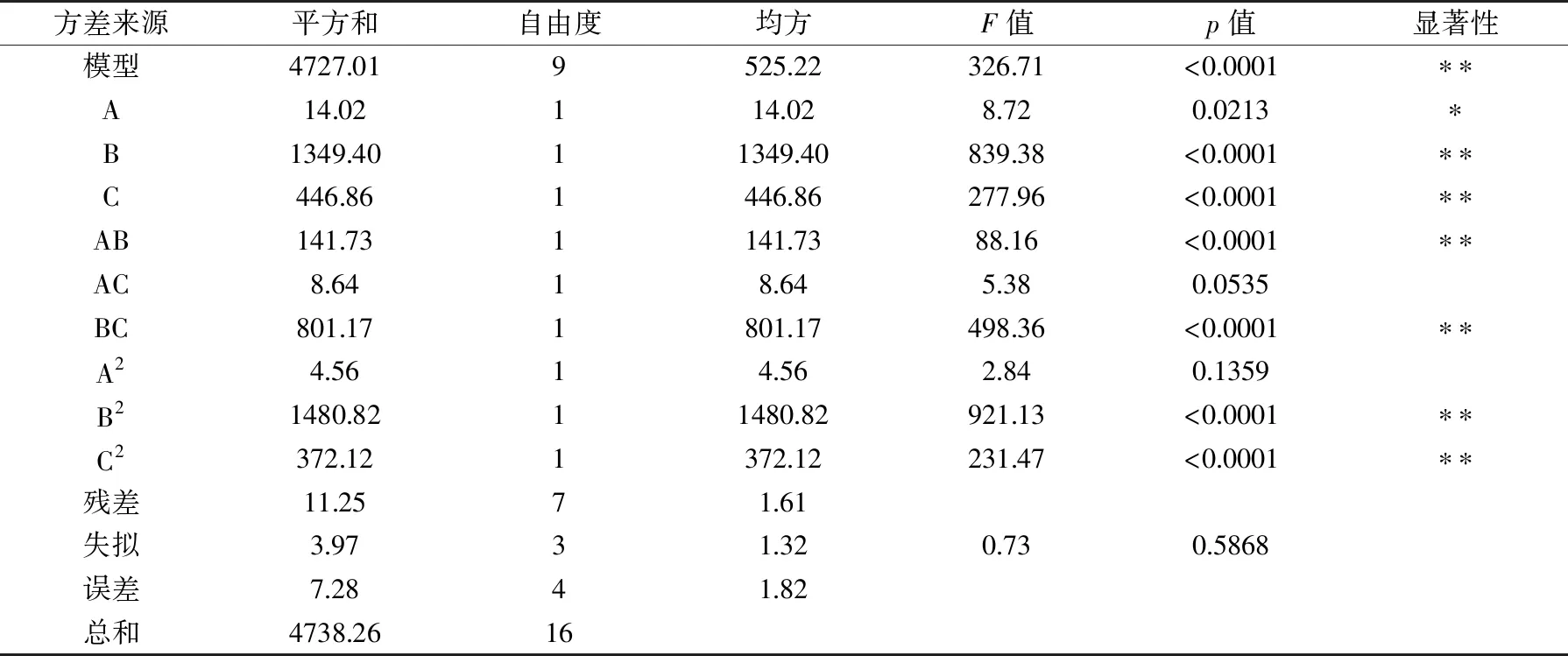
表3 模型回归系数显著性检验结果Table 3 Analysis of variance for the fitted regression model
2.2.2 响应面交互作用分析 各因素交互作用对红树莓籽黄酮包埋率影响等高线和响应面图见图5,响应面坡度越陡峭,等高线越扁,均说明微胶囊包埋率对各因素变化较敏感,各因素对包埋率的影响显著。由图a和图c可知,AB和BC等高线图形均较扁,说明交互项AB和BC对黄酮微胶囊包埋率影响极显著;图b和图d可知,AB响应面陡峭程度低于BC响应面坡度,说明交互项BC对微胶囊包埋率影响程度高于AB,故交互项对微胶囊包埋率影响大小依次为BC>AB,BC和AB对微胶囊包埋效果影响极显著。其次,由图b可知,当芯壁比取零水平时,包埋率随壁材浓度增大呈先升高后降低趋势,且变化幅度较大,当壁材浓度取零水平时,芯壁比对包埋率影响较小;同理,由d可知,反应温度对包埋率变化趋势影响程度低于壁材浓度,但高于图b中芯壁比对微胶囊包埋率影响程度,故各因素对包埋率影响大小依次为B>C>A,与模型显著性检验结果一致。此外,所选因素参数范围内包埋率均存在极值,可对红树莓籽黄酮微胶囊化最佳工艺进行预测。
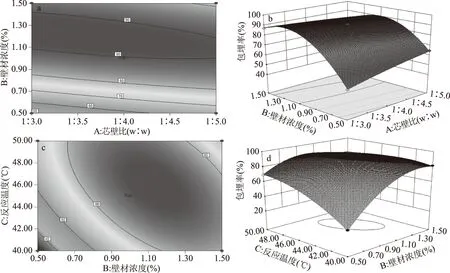
图5 各因素交互作用等高线和响应面图Fig.5 Response surface and contour plots of interation of various factors
2.2.3 验证试验结果分析 响应面优化红树莓籽黄酮微胶囊最佳制备条件:芯壁比1∶4.55、壁材浓度1.01%、反应温度45.53 ℃,此条件下黄酮微胶囊包埋率理论值为91.07%。根据实际操作,调整工艺条件为芯壁比1∶4.6、壁材浓度1%、反应温度46 ℃,三组平行试验表明微胶囊包埋率为92.38±0.16%,相对误差1.44%<5%,说明响应面优化红树莓籽黄酮微胶囊制备工艺结果可靠。
2.3 红树莓籽黄酮微胶囊理化特性
红树莓籽黄酮微胶囊水分含量5.26%、休止角31.3°、溶解度91.54%、平均粒径546 nm、玻璃化转变温度145.75 ℃,说明此微胶囊产品含水量低、粘度小、流动性佳、溶解度高、粒度均匀、玻璃化转变温度高,故复凝聚法制备的黄酮微胶囊具有良好贮藏性、流动性和溶解性。
2.4 红树莓籽黄酮微胶囊体外消化释放性评价
2.4.1 红树莓籽黄酮微胶囊体外胃消化释放性评价 红树莓籽黄酮及其微胶囊体外胃消化释放情况如图6所示,体外胃消化0~2.5 h内,未包埋的黄酮释放量显著升高(p<0.05),是因强酸下胃蛋白酶促进了黄酮释放,与陆俊等[26]研究结果中黄酮胃消化释放量变化趋势相似。胃消化0~0.5 h内,微胶囊黄酮释放量增加不显著(p>0.05),是因微胶囊表面未被包埋的少量黄酮释放造成,消化至0.5~2.5 h时,微胶囊黄酮释放量显著升高(p<0.05),是因壁材逐渐被水解,黄酮释放出来。胃消化至2.5 h黄酮及微胶囊中黄酮释放量分别达77.31和21.88 mg/g,未包埋黄酮释放量明显高于微胶囊中黄酮释放量,是因芯材被包埋于壁材中,避免了直接与胃酸接触[27],降低了黄酮释放,说明微胶囊在胃液中对黄酮有一定缓释作用,避免了黄酮降解损失。
2.4.2 红树莓籽黄酮微胶囊体外肠消化释放性评价 红树莓籽黄酮及其微胶囊肠消化释放情况如图7所示,肠消化0~2.5 h内,未包埋的黄酮释放量显著升高(p<0.05),随后显著降低(p<0.05),说明黄酮在胃消化阶段未完全释放被消化,肠消化液继续促进了黄酮释放;肠消化0~2.5 h内,微胶囊黄酮释放量显著升高(p<0.05),随后趋于平稳,且肠液中黄酮释放量显著高于胃液黄酮释放量,是因胰蛋白酶为蛋白质水解酶,可水解部分微胶囊壁材,从而导致黄酮释放量升高[28]。廖霞等[8]研究的槲皮素微胶囊包埋前后肠消化过程中释放量变化趋势相似。体外肠消化至3 h,未包埋的黄酮及其微胶囊黄酮释放量分别为158.48和112.51 mg/g,是肠消化0 h的2.05和5.14倍,说明黄酮微胶囊胃消化过程中对黄酮起到缓释作用,在肠消化过程被大量释放,利于黄酮被人体吸收利用。
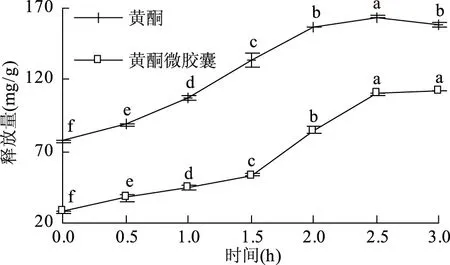
图7 模拟肠消化过程中黄酮释放量的变化Fig.7 Changes in the release of flavonoids during simulated intestinal digestion
3 结论
通过单因素及响应面试验优化复凝聚法制备红树莓籽黄酮微胶囊工艺,通过单因素实验确定壁材配比对微胶囊包埋效果影响较小,故选取芯壁比、壁材浓度和反应温度进行响应面优化,确定最优工艺参数为:芯壁比1∶4.6、壁材浓度1%、反应温度46 ℃,此条件下包埋率92.38%;微胶囊水分含量、休止角、溶解度、粒径及玻璃化转变温度分别为5.26%、31.3°、91.54%、546 nm和145.75 ℃,说明微胶囊产品具有较好的贮藏性、流动性和溶解性。体外胃消化2.5 h黄酮包埋前后释放量分别为77.31、21.88 mg/g,未包埋黄酮释放量为微胶囊中黄酮释放量3.53倍;体外模拟肠消化3.0 h,黄酮包埋前后释放量分别为158.48、112.51 mg/g,分别为肠消化0 h的2.05和5.14倍,表明此黄酮微胶囊制备工艺提高了黄酮在胃消化过程中的缓释作用,促使其在肠消化过程中释放出来,进而被人体吸收利用。
