冷诱导金黄色葡萄球菌环境胁迫耐受性及生物被膜控制
2019-04-01,,,,,,
,,,,, ,
(南京农业大学食品科技学院,江苏南京 210095)
近年来,我国速冻食品微生物安全受到广泛关注,有馅食品如速冻饺子在生产、储藏、销售过程中受微生物污染的可能性最大,而金黄色葡萄球菌(Staphylococcusaureus)是速冻食品中常检出的食源性致病菌[1-2]。研究表明,金黄色葡萄球菌在-18 ℃冷藏96 d过程中,亚致死率增加但细胞死亡率却逐渐变缓,说明亚致死细胞对冷胁迫耐受性较强[3-5]。金黄色葡萄球菌可以通过冷休克蛋白(CSP)的表达而有效地适应温度的降低,这种冷休克反应对金黄色葡萄球菌在低温下生存起了重要作用[6]。Onyango等[7]研究发现,金黄色葡萄球菌在4 ℃可形成小菌落突变体,其生长形态和超微结构发生改变且对氨基糖苷类药物耐受性增强。冷胁迫环境可使金黄色葡萄球菌蛋白组代谢组发生变化[8]。
虽然关于食源性致病菌对多种环境胁迫产生交叉抗性的报道已有很多。但对于金黄色葡萄球菌经冷诱导后对其他环境耐受性的研究较少。肠炎沙门氏菌在5 ℃胁迫5 h后,其对酸性环境的耐受性增强[9]。Cebrián等人研究发现在低浓度的酸、碱、过氧化氢以及45 ℃温度条件下处理一定时间的金黄色葡萄球菌,对更极端的同源环境耐受性增强[10]。Singh等[11]发现对酸具有强适应性的沙门氏菌能在60 ℃胁迫条件下保持较高存活率。金黄色葡萄球菌能在工作台和器皿表面形成生物被膜,会对外界刺激因素如高温高盐、强酸强碱、紫外线、抗生素、消毒剂、杀菌剂等产生抗性[12-13]。
为了控制金黄色葡萄球菌在冷冻食品中的污染传播,本文研究了低温敏感性不同的金黄色葡萄球菌经冷诱导后对其他环境胁迫(高温、酸、碱、高渗、消毒剂)的抗性变化,同时研究了冷冻食品分离株生物被膜的形成和有效控制方法,为冷冻食品工业安全控制提供理论支持。
1 材料与方法
1.1 材料与仪器
金黄色葡萄球菌(S.aureus,CICC10201) 中国工业微生物菌种保藏管理中心;金黄色葡萄球菌(S.aureus,W3) 分离自市售冷冻鱼丸样品;胰蛋白胨大豆肉汤培养基(TSB)、营养肉汤培养基(NB) 北京陆桥技术有限公司;氯化钠、30%过氧化氢、乙醇 分析纯,南京化学试剂有限公司;84消毒液、雕牌洗洁精 南京苏果超市。
1300-A2生物安全柜 赛默飞世尔科技公司;AR512电子精密天平 奥豪斯(上海)公司;LDZX-50 KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;WH-3微型旋涡混合仪 上海沪西分析仪器厂;HYL-A全温摇瓶柜 太仓市强乐实验设备厂;5418高速离心机 Eppendorf;DK-8D型电热恒温水槽 上海森信实验仪器有限公司;隔水式电热恒温培养箱 上海跃进医疗器械厂;BCD-215YD海尔冰箱 海尔集团。
1.2 实验方法
1.2.1S.aureus耐冷冻能力的研究 分别取10 μLS.aureusCICC10201及S.aureusW3于4 mL离心管37 ℃ 180 r/min过夜培养,调整菌液终浓度为OD595=0.5后,以1%(v/v)接种量接种到新鲜培养基中,37 ℃ 180 r/min培养5 h。将所得菌液分装于1.5 mL/管离心管中,冻藏于-20 ℃冰箱内。每隔7 d取一个冻藏的离心管测定其菌落数,测定8周。
1.2.2S.aureus的冷诱导S.aureusCICC10201及S.aureusW3经TSB液体培养基过夜培养后,调整菌液终浓度为OD595=0.5,按1%(v/v)接种量接种至50 mL新鲜培养基中,37 ℃ 180 r/min振荡培养5 h后,6000 r/min离心5 min,用2 mL灭菌生理盐水重悬菌液后,分别置于4 ℃冰箱中,冷胁迫5 h。
1.2.3 冷诱导S.aureus环境胁迫抗性研究
存活率(%)=胁迫前细菌数/胁迫后细菌数×100
式(1)
降低的细菌数(lg CFU/mL)=lg(胁迫后细菌总数)-lg(胁迫前细菌总数)
式(2)
1.2.3.1 高温胁迫 将2 mL冷诱导的S.aureusCICC10201及S.aureusW3菌体细胞悬液分别置于45、50、55、60 ℃水浴处理30 min后,快速置于冰上冷却30 s,平板稀释涂布,测定细菌数计算存活率,计算方法见式(2)。
1.2.3.2 酸胁迫 取2 mL未经诱导及冷诱导后菌株S.aureusCICC10201及S.aureusW3菌悬液,6000 r/min离心5 min,去上清,得到的菌体分别重悬于2 mL高压灭菌的pH为2.5、3.5、4.5、5.5的HCl溶液中室温静置1 h[11]。平板稀释涂布,统计活菌数并计算存活率。
1.2.3.3 碱胁迫 取2 mL未经诱导菌株及冷诱导后菌株的菌悬液(冷诱导时间增加至24 h),6000 r/min离心5 min,去上清,得到的菌体分别重悬于2 mL高压灭菌的pH为8.5、9.5、10.5、11.5的NaOH溶液中室温静置1 h。平板稀释涂布,统计活菌数并计算存活率。
1.2.3.4 高渗透压胁迫 取2 mL未经诱导菌株及冷诱导后菌株的菌悬液,6000 r/min离心5 min,去上清,得到的菌体分别重悬于2 mL高压灭菌的25%、30%、35%氯化钠溶液中,模拟S.aureus可能遇到的高渗环境,室温静置1 h,平板稀释涂布,统计活菌数并计算存活率。
1.2.3.5 酒精胁迫 取2 mL未经诱导菌株及冷诱导后菌株的菌悬液,6000 r/min离心5 min,去上清,得到的菌体分别重悬于2 mL浓度为10%、20%、30%、40%的酒精溶液中处理5 min。平板稀释涂布,测定细菌数并计算存活率。
1.2.3.6 过氧化氢胁迫 取2 mL未经诱导菌株及冷诱导后菌株的菌悬液,6000 r/min离心5 min,去上清,得到的菌体分别重悬于2 mL用30%过氧化氢 与无菌水配制的10、15、20、25 mmol/L 过氧化氢溶液中室温静置30 min,后平板稀释涂布,统计活菌数并计算存活率。
1.2.4 生物被膜形成能力的变化及控制
1.2.4.1 菌株的挑选 以NB培养基为基础,使用96孔板结晶紫染色法[14]衡量两株分离株S.aureusCICC10201及S.aureusW3的生物被膜形成能力。菌株按1%(v/v)接种量接种到96孔微量细胞培养板中,每孔含菌悬液200 μL。每个样品设6个重复,同时12孔不接菌的原始培养基为对照。37 ℃培养24 h后弃去培养基,无菌水洗3次,加入200 μL结晶紫染色30 min。倒去染色液,使用无菌水洗去浮色,晾干后每孔加200 μL 95%乙醇,室温放置15 min[13]。用酶标仪在595 nm处测得样品OD值,选取OD值最大的菌株进行下一步实验。
1.2.4.2 消毒剂和清洁剂对S.aureus生物被膜的清除作用 取培养24 h的96孔板,弃去培养基,无菌水洗3次后,在不同孔中分别加入无菌水(对照),不同浓度的84消毒液(1.00%、0.50%、0.25%),洗洁精(2%、5%、10%),过氧化氢(0.5%、1.5%、3.0%),酒精(20%、40%、80%)浸泡处理30 min,倒出浸泡液,用无菌水清洗3次,后续实验同1.2.4.1。
1.3 数据处理
每个实验重复3次,实验数据经SPSS软件进行单因素方差分析,结果用Excel 2007软件绘图。
2 结果与讨论
2.1 冷冻对S. aureus存活率的影响
如图1,随着冷冻时间的增长,标准菌株存活率显著低于分离株(p<0.05)。S.aureusW3经-20 ℃ 8周冷藏后,细菌数发生变化不明显,对于冷胁迫具有较强的耐受性。而对于标准菌株S.aureusCICC10210,对-20 ℃耐受能力,较冷胁迫不同时间的分离株均差,冻藏8周后,菌体数下降2.27 lg CFU/mL,存活率不到1%。S.aureus已被证明能在多种环境条件下生存,在极端环境中通过改变细胞代谢和结构维持生存状态[15]。冷冻食品分离株S.aureusW3较标准菌株S.aureusCICC10201在-20 ℃环境下的存活率更高,体现了其极强的抗冷冻胁迫调节能力。这意味着一旦速冻食品污染了耐冷菌株,发生食品安全事故的概率较高。

图1 -20 ℃长期冷藏对S. aureus菌体数的影响Fig.1 Effect of low temperature(-20 ℃)on the cell number of S. aureus
2.2 冷诱导对菌株环境胁迫抗性的影响
2.2.1 冷诱导后S.aureus对高温耐受性的变化 如图2A,45 ℃下耐冷冻菌株S.aureusW3具有较高存活率,未经冷诱导前存活率高达98.12%,显著高于对照标准菌株S.aureusCICC10201(58.93%)(p<0.05)。而经冷诱导后,两株菌的存活率都有所上升,分别达到114.5%(S.aureusW3)及77.35%(S.aureusCICC10201)。50 ℃水浴处理,冷诱导前S.aureusW3存活率依然高达88.36%,而标准菌S.aureusCICC10201仅为37.11%。经冷诱导后,存活率增长,分别达94.14%和55.61%。随着温度升高,不同处理组的两株菌的存活率都快速下降,冷诱导前S.aureusW3在55 ℃高温下,存活率达9.2%,而标准菌存活率为5.23%。由于在60 ℃处理0.5 h后,各组菌存活率均不足1%,细菌数降低量都在3 lg CFU/mL左右,无显著差异(p>0.05)(图2B)。由此可见,冷诱导可使菌株对高温的耐受性增强,而耐冷菌株较标准株的高温耐受性更强。已被证实暴露在亚致死温度(冷诱导)中对高温具有更强耐受性的菌种有大肠杆菌[16]、单核细胞增生李斯特氏菌[17]、小肠结肠炎耶尔森菌[18]和植物乳杆菌[19]。因此在冷冻食品工业中,应考虑冷诱产生的细菌高温抗性,建立高效的杀菌措施,保证耐冷菌株完全灭活。

图2 冷诱导前后S. aureus在高温胁迫下的存活率Fig.2 Survival rate of S. aureus at high temperature before and after cold induction注:A:两株菌冷诱导前后对高温存活率变化;B:60 ℃处理后各组降低的细菌数。*代表差异显著,p<0.05,图3~图8同。
2.2.2 冷诱导S.aureus对酸耐受性的变化 酸对去除蔬菜、肉制品表面食源性致病微生物有良好的效果[20-21]。由图3可知在pH3.5~5.5条件下,四组存活率极高,均超过80%,分离株与标准株存活率未有显著差异(p>0.05)。在室温下pH4.5、pH5.5处理1 h后,未经冷诱导的两株菌均有增殖现象,存活率超过100%,经冷诱导后,两株菌在弱酸条件下的存活率都有所下降。在pH5.5条件下,冷诱导后的两组菌存活率分别下降20.0%和21.4%。在pH4.5条件下,冷诱导后S.aureusW3存活率下降不显著(p>0.05),但标准株S.aureusCICC10201存活率下降16.7%。在pH3.5条件下,冷诱导后两组菌存活率分别下降18.0%和16.8%。在较低pH条件下(pH=2.5),标准菌株的存活率(17.7%)显著高于分离株(3.22%)(p<0.05)。以上结果表明,冷诱导S.aureus对弱酸环境的敏感性增强,同时分离株对pH2.5环境下的耐受性低于标准菌株。有研究表明,不同温度条件下乙酸和柠檬酸对芝麻酱中S.aureus存活率有影响。在低温(10 ℃)条件下比37 ℃条件下S.aureus对酸的耐受能力更强[22],这可能与酸种类、处理方式不同有关。本研究采用的酸处理为无机酸,而文献报道中所用的是有机酸。另有研究证实[9],5 ℃ 5 h诱导的鼠伤寒沙门氏菌产生酸抗性,使其在pH4.0条件下存活率提高。这可能与阴性菌和阳性菌对酸反应不同有关,实际生产过程中也需注意可能存在交叉抗性的情况。

图3 冷诱导前后S. aureus在酸性胁迫下的存活率Fig.3 Survival rate of S. aureus before and after cold induction under acid stress
2.2.3 冷诱导S.aureus对碱耐受性的变化 如图4,冷诱导5 h后,pH9.5S.aureusW3与pH8.5S.aureusCICC10201的存活率无显著差异(p>0.05)。通过增加冷诱导时间至24 h,观察冷诱导后两株菌对碱胁迫耐受性变化。随着诱导时间的加长,两株菌的存活率均有所提高。S.aureusW3在诱导5、24 h后在pH8.5的条件下存活率分别提高了12.44%和16.84%。在pH9.5条件下存活率分别提高了3.9%和18.4%。且在较高pH条件下(pH10.5),存活率提高更为显著(p<0.05),为18.6%和33.8%,冷诱导前在该pH条件下不能生长。对于标准菌株S.aureusCICC10201,在冷诱导后其对碱耐受性也有略微增长。虽然分离株在pH8.5及9.5的条件下存活率较标准株低,但在pH10.5的条件下存活率显著高于标准株(p<0.05)。国内外对于冷诱导后S.aureus碱耐受性提高的报道较少。仅有研究表明,S.aureus在pH9.5的环境中暴露0.5 h会使部分细菌产生碱适应性,这与蛋白质及RNA的合成有关[23]。

图4 冷诱导前后S. aureus在碱胁迫下的存活率Fig.4 Survival rate of S. aureus beforeand after cold induction under alkaline stress注:A为S. aureus W3冷诱导前后对碱胁迫存活率变化;B为S. aureus CICC10201冷诱导前后对碱胁迫存活率变化。
2.2.4 冷诱导S.aureus对氯化钠耐受性的变化 食品环境及S.aureus侵袭感染过程中都可能遇到高渗环境。S.aureus对氯化钠耐受性较高,可能与其细胞壁合成和盐应激蛋白有关[24-25]。随着氯化钠浓度的增加,各组存活率逐渐降低(图5),但冷诱导前耐冷菌S.aureusW3与标准菌的存活率无显著差异(p>0.05)。25%(w/v)氯化钠处理后,经冷诱导的两株菌存活率下降,分别降低了9.2%和20.3%。在30%(w/v)氯化钠处理后,经冷诱导的两株菌存活率分别降低24.09%和22.1%。在35%(w/v)氯化钠处理后,经冷诱导后的两株菌存活率分别下降13.08%和9.1%。冷诱导后高渗环境的存活率显著下降(p<0.05),这可能与冷诱导造成的部分S.aureus细胞亚致死有关,使其对氯化钠的耐受性降低。

图5 冷诱导前后S. aureus在氯化钠胁迫下的存活率Fig.5 The survival rate of S. aureus before and after cold induction under hypertonic condition
2.2.5 冷诱导S.aureus对酒精耐受性的变化 如图6A,经10%、20%酒精胁迫,两株菌的存活率均超过50%,且诱导前后无显著差异(p>0.05)。10%酒精处理后,各组存活率均达80%以上。但经20%酒精胁迫后,标准株较分离株S.aureusW3存活率高。而在超过30%酒精浓度下,菌体大量死亡,特别是在40%酒精浓度下,已检测不到活菌存在。根据30%酒精处理菌株的降低的细菌数(图6B)可知,未经诱导的两株菌菌体数分别下降了4.95和4.86 lg CFU/mL,而经诱导后的两株菌菌体数下降了3.03和2.79 lg CFU/mL,存活率显著提高(p<0.05)。由此可得,经冷诱导后的S.aureus对30%浓度的酒精产生交叉抗性。国内外对于冷诱导后S.aureus对酒精耐受性提高的报道较少。但有学者研究了其他环境因素诱导食源性致病菌产生酒精抗性。如Chiang等[26]研究发现,酸适应性副溶血性弧菌对8%的酒精耐受性提高。

图6 冷诱导前后S. aureus在酒精胁迫下的存活率Fig.6 Survival rate of S. aureus before and after cold induction under alcohol stress注:A为经酒精处理后不同组的存活率;B为在30%酒精处理后各组降低的菌体数。
2.2.6 冷诱导S.aureus对过氧化氢耐受性的变化 过氧化氢是食品加工过程中常用的器械消毒剂,其杀菌机理是产生活性氧作用于细胞DNA、脂质和蛋白。如图7所示,耐冷菌株S.aureusW3对双氧水的耐受性高于标准菌株S.aureusCICC10201,在各浓度处理后,其存活率均高于50%。经冷诱导后,S.aureusW3对过氧化氢的耐受性变化不显著(p>0.05),而标准菌株在冷诱导后存活率显著(p<0.05)降低,对过氧化氢的敏感性增强。有研究表明,sigB基因与过氧化氢抗性的产生相关,特殊的调节子例如PerR也可能调控S.aureus应激作用[27]。
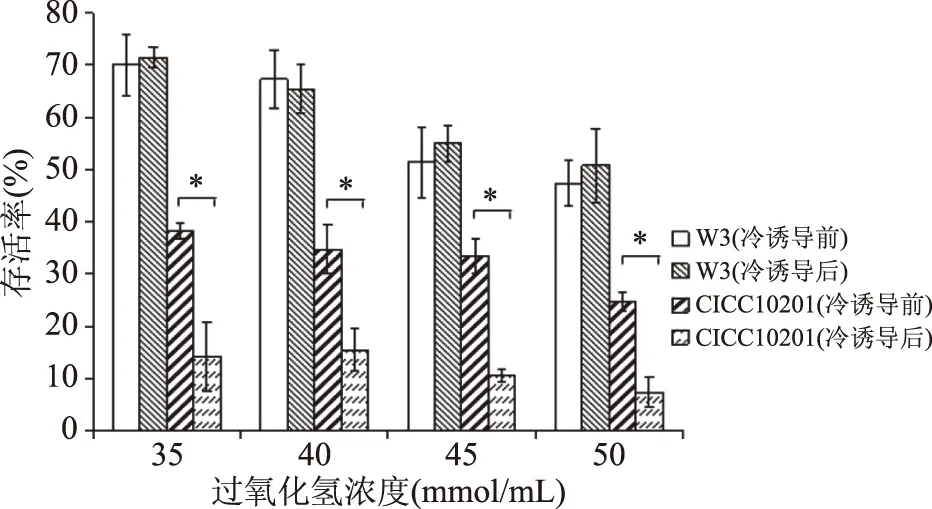
图7 冷诱导前后S. aureus在过氧化氢胁迫下的存活率Fig.7 Survival rate of S. aureus under hydrogenperoxide stress before and after cold induction
2.3 生物被膜形成能力的变化及控制
生物被膜是微生物抵抗外界不良生活环境的一种特殊生长方式[28-29]。S.aureus具有一定粘附性,因此可在器物表面及食品表面[30]形成生物被膜,生物被膜较游离菌体更难被清除。结果表明S.aureusW3的生物被膜OD595值为2.7,而S.aureusCICC10201的值为0.5,因此S.aureusW3作为冷冻食品分离株比标准具有更强的生物被膜形成能力。
运用不同浓度的洗洁精(w/v)、84消毒水(v/v)、酒精(v/v)和双氧水(v/v),对分离株S.aureusW3形成的生物被膜进行清除(图8)。各梯度稀释的洗洁精对S.aureusW3形成的生物被膜均有一定清除作用,与未添加洗洁精相比,其吸光度均有显著下降(p<0.05)。不同浓度的洗洁精之间均有显著差异(p<0.05)。84消毒液(主要成分为次氯酸钠)对S.aureusW3形成的生物被膜也有一定清除作用,与对照相比,经30 min处理后各实验组生物被膜吸光度均显著下降(p<0.05)。1%的84消毒水对其生物被膜的清除作用好于10%的洗洁精。酒精对其生物被膜清除没有明显效果(p>0.05)。0.5%~3%的过氧化氢对其生物被膜也有一定清除作用,但效果较高浓度的洗洁精和84消毒水差。对于该菌,1%的84消毒水能够有效地清除生物被膜,酒精几乎没有清除作用。
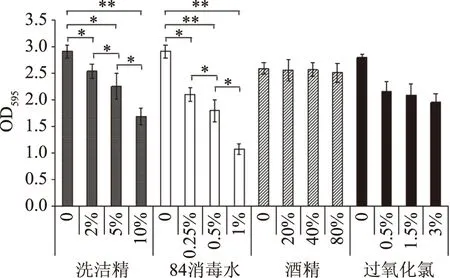
图8 不同消毒剂对分离菌S.aureus W3生物被膜的清除作用Fig.8 Scavenging effect of different scavengers on S.aureus W3 biofilm of cold resistant bacteria注:** 代表差异极显著,p<0.01。
3 结论
冷冻食品中分离得到的S.aureusW3较标准菌株S.aureusCICC10201在-20 ℃环境下的存活率更高,经8周冷冻后,细菌数几乎没有下降,体现了其极强的抗冷冻胁迫调节能力。
S.aureusW3对高温(50 ℃)、碱(pH10.5)、过氧化氢的耐受性均较标准菌株S.aureusCICC10201更好,但对酸(pH2.5)敏感性较高。冷诱导会使S.aureusW3和S.aureusCICC10201对于高温、碱、酒精产生交叉抗性。同时,冷诱导会使这两株菌对某些压力环境的敏感性增强。如经冷诱导后,对酸、氯化钠及过氧化氢的生存能力显著下降。1%的84消毒水可有效去除冷冻食品分离株S.aureusW3形成的生物被膜。以上研究表明,利用冷诱导后S.aureus对酸、高渗及过氧化氢敏感性增强的特点,可有效控制S.aureus在冷藏食品工业中的污染和传播。
