高钙菜黄酮的分级分离各级分的抗氧化活性
2019-04-01,,,,,*
, , ,,,*
(1.西南科技大学生命科学与工程学院,四川绵阳 621010;2.四川省生物质资源利用与改性工程技术研究中心,四川绵阳 621010)
高钙菜(SedumaizoonL.),属于景天科草本植物,又称景天三七、费菜和养心草等。高钙菜是一种极具开发潜力的蔬菜,除具有丰富蛋白质、脂肪、维生素和钙等营养价值外,还含有较多的黄酮类、多酚类及生物碱等活性物质[1-3]。高钙菜的醇提物具有止血抗菌、活血化瘀、收缩血管和兴奋心脏的作用[4-5]。而作为高钙菜醇提物中的主要活性成分——黄酮类化合物,具有清除自由基、抗氧化、抗炎症、预防糖尿病和冠心病、降低心血管疾病发生概率的作用[6-10],但是目前,国内外学者对于高钙菜黄酮类化合物的研究主要集中于提取工艺的优化、抑菌性和抗氧化活性的研究,但对于高钙菜总黄酮的分级分离和构效关系的影响报道较少。

1 材料与方法
1.1 材料与仪器
高钙菜 采自西南科技大学试验田,经吴叶青副教授鉴定为高钙菜;芦丁对照品 南京替斯艾么中药研究所;DPPH·、叔丁基羟基茴香醚(BHA)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS) Sigma Aldrich 公司;2,4,6-三吡啶基三嗪(TPTZ) 上海源叶生物科技有限公司;抗坏血酸、乙酸乙酯、三氯甲烷、正丁醇、乙醇、三氯乙酸、铁氰化钾等 均为分析纯。
紫外-可见光分光光度计 日本Hitachi公司;真空冷冻干燥机 美国Thermosavant 公司;旋转蒸发仪RE-52B 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 高钙菜黄酮各级分的制备 高钙菜经50 ℃常压干燥粉碎过40目筛预处理之后,在条件为料液比(高钙菜粉末:80%乙醇溶液)1∶40 g/mL、提取温度85 ℃、提取时间2.9 h、乙醇浓度80%下提取高钙菜总黄酮,萃取液于45 ℃减压浓缩至无醇味后用1/3体积石油醚萃取,获得水相,加入3倍体积无水乙醇,低温静置过夜沉降多糖、蛋白质等杂质,离心(5000 r/min,10 min)后将上清液真空浓缩除去乙醇后依次用1/3体积的氯仿、乙酸乙酯及正丁醇对高钙菜总黄酮进行分级萃取,得到极性不同的各级分,45 ℃旋转蒸发除去有机溶剂后真空冷冻干燥,得不同极性组分的黄酮类化合物粉末,即水、氯仿、乙酸乙酯及正丁醇相粉末,以分析其抗氧化活性[14]。
1.2.2 DPPH自由基清除活性测定 参考Luo和李志平等[15-16]的方法,并加以修改。向25 mL比色管中依次加入2 mL不同浓度样液、3 mL 0.1 mmol·L-1的DPPH·溶液,摇匀,室温暗处静置30 min,于517 nm处测定吸光值Ai;以等体积去离子水代替DPPH溶液或样液,其他不变,测定吸光值Aj和Ac。以Vit C和BHA作为阳性对照(1.2.3~1.2.7同此处)。按下式(1)计算DPPH·清除率(K)。
式(1)
1.2.3 羟自由基清除活性测定 参考Mao等[17]的方法,并加以修改。向25 mL比色管中依次加入0.60 mL 6 mmol·L-1FeSO4溶液、2 mL不同浓度样液或去离子水、0.60 mL 6 mmol·L-1H2O2溶液,混匀,静置10 min,加入0.60 mL 6 mmol·L-1水杨酸乙醇溶液,混匀,静置10 min后于510 nm处测出不同样液吸光值Ai和吸光值Ac。同时将水杨酸用蒸馏水代替,测得吸光值Aj。按下式(2)计算·OH清除率(R)。
式(2)

式(3)
式中:A2为样液最终吸光值;A1为样液初始吸光值;t为反应时间。
式(4)
1.2.5 总抗氧化能力测定 采用FRAP法[20]。标准曲线的绘制:于比色管中依次加入浓度为0、0.1、0.2、0.4、0.6、1.0 mmol·L-1的硫酸亚铁溶液各60 μL,加入6.0 mL FRAP工作液,混匀后37 ℃水浴准确反应10 min,593 nm波长处测定吸光值(A),由吸光值(y)和硫酸亚铁浓度(x)做回归直线得y=0.1919x-0.0232,决定系数R2=0.9990,x为FeSO4浓度(mmol·mL-1);样液测定:取不同浓度黄酮样液替代硫酸亚铁溶液按照上述方法测定吸光值(Ai),根据标准曲线计算样液的FRAP值。按下式(5)计算样液的FRAP值。
式(5)
1.2.6 还原力测定 参考Köksal等[21]的方法,并略作修改。在25 mL比色管中加入不同浓度样品液2 mL,依次加入2.5 mL磷酸盐缓冲液(pH6.6,0.2 mol·L-1),2.5 mL 1%铁氰化钾,摇匀,50 ℃水浴20 min后,加入2.5 mL 10% TCA,离心(3000 r/min,10 min),吸取2.5 mL上清液与2.5 mL蒸馏水和0.5 mL 0.1% FeCl3混匀,室温静置10 min,于700 nm处测定吸光值。
1.2.7 ABTS+·清除率测定 参考Saipriya[22]的方法,并加以修改。在25 mL比色管中依次加入40 μL 不同浓度样液及4 mL ABTS+·测定液,充分振荡,准确反应10 min,于734 nm处测定吸光值Ai。试验以去离子水代替ABTS+·测定液,测定吸光值Aj。同时以去离子水代替样液,测定吸光值Ac。按下式(6)计算ABTS+·清除率。

式(6)

1.3 各级分黄酮初步鉴定
1.3.1 红外光谱分析 取0.5 mg干燥后的各级分粉末,并以1∶150比例与干燥的溴化钾粉末,置于玛瑙研钵中研磨,直到完全研细混匀,将研制好的粉末均匀放入压膜器内,抽真空获得样品薄片。用傅里叶变换红外光谱仪以溴化钾粉末为空白压片作为参比,在波数范围为4000~400 cm-1,分辨率4 cm-1,扫描次数为4次的条件下扫描红外光谱,绘制红外光谱图。以芦丁作为对照样品[23]。
1.3.2 显色反应 各级分显色反应参考文献[24]
1.3.2.1 盐酸-锌粉反应 吸取1 mL样品甲醇溶液,加入少量Zn粉,充分摇匀,再加入几滴浓盐酸,微热1~2 min,观察并记录颜色。
1.3.2.2 四氢硼钠反应 吸取1 mL样品乙醇溶液,加入1 mL 2% NaBH4甲醇液,1 min后,再加入几滴浓硫酸,观察并记录颜色。
1.3.2.3 铝盐 往样液中加入1% Al(NO3)3溶液,置于紫外灯下观察荧光并记录结果。
1.3.2.4 镁盐 在滤纸上滴加数滴样液,以1% 醋酸镁甲醇溶液为显色剂,55 ℃下加热干燥,置于254 nm紫外灯下观察并记录颜色。
1.3.2.5 浓硫酸 吸取1 mL样液并滴入数滴浓硫酸,观察并记录颜色。
1.4 数据处理
所有样品均做三次平行,使用Origin 8.5和SPSS 22.0软件进行数据处理和分析,测定结果用平均值±标准偏差表示。显著性分析(统一浓度不同组别)采用单因素方差分析(ONE WAY ANOVA)进行Duncan新复极差法分析,p<0.05为差异显著,p<0.01为差异极显著。
2 结果与讨论
2.1 不同溶剂萃取级分的DPPH自由基清除能力
DPPH·是一种醇溶液呈紫色的稳定自由基,其孤对电子可与抗氧化剂提供的电子配对,使其颜色褪去或消失,且褪色程度与电子数量成定量关系,常用于评价抗氧化成分的体外抗氧化性[25]。由图1可知,各级分对DPPH·清除率在0~0.1 mg·mL-1浓度范围内随高钙菜总黄酮浓度增高而增大。在低浓度时,乙酸乙酯相和Vit C即可达到较高的清除率,而氯仿相和正丁醇相均浓度达到0.04 mg·mL-1后才显示出显著的清除能力,但均显著大于水层的清除率(p<0.05);在高浓度时,乙酸乙酯相、氯仿相和正丁醇相对DPPH·的清除率差异不大,且均显著优于水相(p<0.05)。在浓度为0.1 mg·mL-1时,乙酸乙酯相、氯仿相和正丁醇相的DPPH·清除率分别高达94.86%±0.62%、96.11%±0.66%和95.07%±0.84%,与Vit C(95.78%±0.04%)相当,且由该曲线的整体趋势可知各级分萃取层(水相除外),对DPPH·的清除效果显著好于BHA(p<0.05),与Vit C差异不大,显示出较强的DPPH·清除活性。

图1 各级分对DPPH自由基的清除率Fig.1 Scavenging rate of various fractions against DPPH radical
2.2 不同溶剂萃取级分的羟自由基清除能力
·OH是目前对生物体毒性最大、危害最强的自由基[26]。由图2可知,各萃取层对·OH具有较强清除作用,且浓度范围为0~0.5 mg·mL-1时,其清除能力随高钙菜总黄酮浓度的增强而增大。当黄酮浓度为0.5 mg·mL-1时,乙酸乙酯相的清除率可达到98.35%±2.70%,与Vit C的·OH清除能力相当,显著大于BHA(p<0.05)。但随着浓度的增加,BHA与Vit C的清除率趋于稳定,可能是浓度过高已达到最佳的清除效果。其中,当浓度为0~0.5 mg·mL-1时,各萃取相中乙酸乙酯相的清除率最强,氯仿相次之,然后是正丁醇相,水相最低。

图2 各级分对羟自由基的清除率Fig.2 Scavenging rate of various fractions against ·OH
2.3 不同溶剂萃取级分的超氧阴离子自由基清除能力


图3 各级分对超氧阴离子自由基的清除率Fig.3 Scavenging rate of various fractions against
2.4 不同溶剂萃取级分的总抗氧化能力
酸性条件下,黄酮类化合物可以还原Fe3+-TPTZ产生蓝紫色的Fe2+-TPTZ,由吸光值测定FRAP值,两者呈正相关[27]。由图4可知,当总黄酮浓度为0~0.2 mg·mL-1时,各萃取相的总抗氧化能力与其呈正相关。在测定范围内,Vit C具有较高FRAP值,显著高于各萃取相和BHA(p<0.05)。除阳性对照的强总抗氧化能力外,在浓度在0~0.2 mg·mL-1范围内,各级分总抗氧能力由强到弱依次为:乙酸乙酯相>氯仿相>正丁醇相>水相。
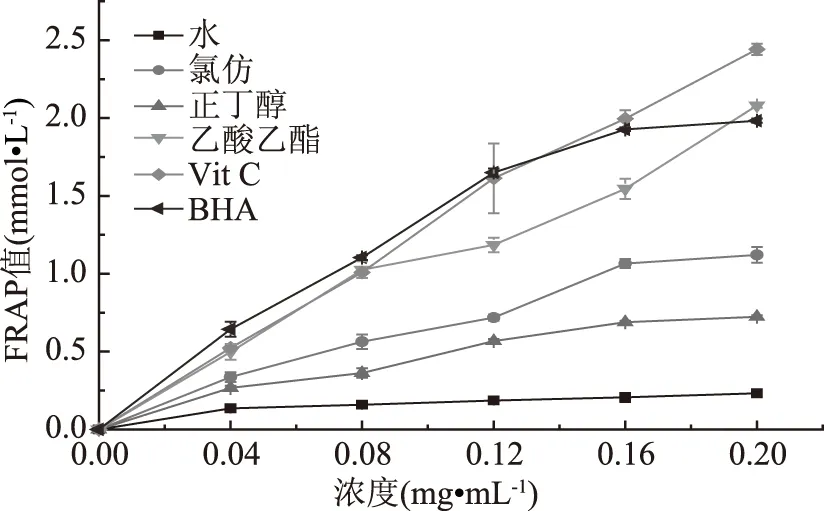
图4 各级分的FRAP值Fig.4 The FRAP value of various fractions
2.5 不同溶剂萃取级分的还原能力
还原力测定体系中,铁氰化钾法可检测受试物发生自氧化的能力,是评价抗氧化活性的重要指标。黄酮类化合物可通过给电子作用将Fe3+还原成Fe2+,产生普鲁士蓝,并在700 nm处有最强吸收峰,通过测定吸光值的大小即可表征待测物的还原能力[28]。由图5可知,各萃取相的还原力在黄酮浓度为0~0.2 mg·mL-1内呈现线性增长。Vit C还原力最强,且显著高于BHA和各萃取相的还原能力。在0~0.2 mg·mL-1浓度范围内,各萃取相中乙酸乙酯相的还原能力最强,其次为氯仿相、正丁醇相,而水相的还原力最弱。
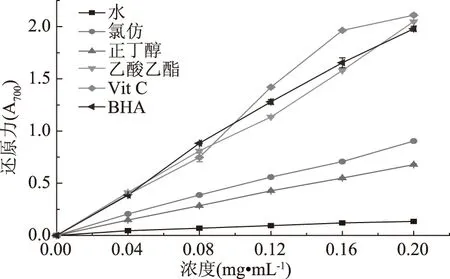
图5 各级分的还原能力Fig.5 Reducing power of various fractions
2.6 不同溶剂萃取级分的ABTS阳离子自由基清除能力
ABTS+·是一种亚稳态离子,醇液中呈现蓝绿色,可与黄酮类化合物反应使其褪色,且褪色程度与自由基清除能力呈正相关,已被广泛应用于天然产物的抗氧化活性的测定[29]。由图6可知,各萃取相的清除率在测定浓度内呈现增长趋势。清除能力最佳的萃取相为乙酸乙酯相,其次为氯仿相,再次为正丁醇相,水相最弱。乙酸乙酯相的半数抑制浓度值IC50为0.15 mg·mL-1,与IC50值分别为0.17 mg·mL-1和0.12 mg·mL-1的Vit C和BHA相近,但显著优于IC50值为0.37 mg·mL-1的氯仿层(p<0.05),表现出强抗氧化活性。

图6 各级分对ABTS阳离子自由基的清除率Fig.6 Scavenging rate of various fractions against ABTS+·
2.7 不同溶剂萃取级分抗氧化活性的综合评价
高钙菜总黄酮提取物各极性萃取物的抗氧化活性呈现出显著的不同趋势,为进一步比较各级分抗氧化活性,本文还分别对各抗氧化指标进行了显著性分析(表1)和综合评价及排序(表2)。

表1 各级分黄酮抗氧化活性Table 1 Antioxidant activity of total flavonoids from various fractions

表2 各级分黄酮综合评分及排序Table 2 Principal component scores and comprehensive scores of all antioxidant indexes
由表2综合评分显示,各级分的抗氧化活性综合评分均小于Vit C,但乙酸乙酯相的综合评分(1.279)高于BHA(1.016),且显著(p<0.05)高于其他萃取相的综合评分。结合表1可知,乙酸乙酯相在·OH和ABTS+·清除能力、总抗氧化能力及还原力指标中表现出明显优势。氯仿相和正丁醇相均对DPPH自由基显示出较强的清除能力,因此也具有很好的抗氧化活性。水相的抗氧化活性较弱。
2.8 各级分总黄酮初步鉴定
2.8.1 红外光谱分析 红外光谱分析可进行定性或定量分析以初步鉴别黄酮类化合物的种类,是目前较为成熟且简单的技术之一。在红外图谱解析中,红外光谱可分为两个区域,即官能团区(4000~1400 cm-1)和指纹区(<1400 cm-1),且分析顺序主要为:先官能团区,后指纹区;先高频区,后低频区;先强峰,后弱峰。
由图7可知,芦丁和各级分总黄酮均在3390~3427 cm-1左右出现宽而强的吸收峰,是-OH的收缩振动,表明存在数目较大的醇羟基或酚羟基;芦丁、正丁醇层、氯仿层和水层在2800~3000 cm-1内出现峰,是-CHn的反对称伸缩振动;芦丁和各级分在1600~1900 cm-1内出现C=O的较强吸收峰,即C=O的伸缩振动;芦丁、乙酸乙酯层、正丁醇层和氯仿层在1450~1650 cm-1内均有2~3个连续峰,是苯环的C=C伸缩振动吸收峰,即黄酮类化合物的特征吸收峰,水层中可能由于极性较差已不含黄酮类化合物;芦丁和各级分在波数为1250~1500 cm-1范围内出现较强吸收峰,是-OH的曲面弯曲振动;芦丁、乙酸乙酯层、正丁醇层和氯仿层分别在1000~1055 cm-1和1200~1300 cm-1内出现=C-O-C的反对称和对称的伸缩振动,而水层则在1060~1150 cm-1出现C-O-C的对称伸缩振动;芦丁和除水以外的各级分均在790~840 cm-1范围内出现芳香烃上的对二取代苯面外弯曲振动;芦丁和各级分均在600 cm-1左右出现取代基引起的峰,但峰位置有所差异,表明取代基有所不同。

图7 芦丁标准品和各级分总黄酮的红外光谱图Fig.7 IR Spectra of rutin and total flavonoids from each extraction part
综上所述,结合官能团区的官能团和指纹区结构差异分析,表明各级分中总黄酮可能为黄酮醇,且在乙酸乙酯层中分布最多,而水层中已不含有黄酮类化合物。水层具备一定抗氧化可能为含有别的物质,其具体成分需待进一步研究。
2.8.2 显色反应 黄酮类化合物具有多种不同结构,可能含有黄酮、黄酮醇、二氢黄酮和橙酮等。黄酮类化合物分子中的酚羟基和γ-吡喃环可与不同化学试剂反应并呈现不同的颜色,根据显色现象可以判断黄酮类化合物的种类。由参考文献[30]和表3相比较可初步判定,乙酸乙酯层和正丁醇层的总黄酮为黄酮醇,进一步证明了红外光谱分析的结构。而氯仿层黄酮种类根据显色反应无法判定,其可能原因是氯仿层颜色太深,遮盖了显色反应中的颜色变化。

表3 各级分总黄酮的显色反应Table 3 Color reaction of total flavonoids from each extraction part
3 结论

