干制速度对无核白葡萄酚类物质和多酚氧化酶细胞化学定位及褐变的影响
2019-04-01,,,,,,,,,,,*
, ,,,,,, ,,,,*
(1.新疆农业科学院农业质量标准与检测技术研究所,新疆乌鲁木齐 830091;2.农业部农产品质量安全风险评估实验室(乌鲁木齐),新疆乌鲁木齐 830091;3.新疆农产品质量安全实验室,新疆乌鲁木齐 830091;4.石河子大学食品学院,新疆石河子 832000;5.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
无核白葡萄在新疆有着悠久的栽培种植和制干历史。据统计,2016年吐鲁番地区种植无核白葡萄约36万亩,占吐鲁番葡萄面积的90%以上,是我国最大的无核白葡萄种植地区[1]。无核白葡萄脱水干制过程中极易褐变[2],不仅有损产品特色,还严重影响了其商品价值和经济效益[3],已成为制约新疆葡萄干产业持续健康发展的关键性问题[4]。
研究表明,无核白葡萄干褐变的主要原因是脱水干制过程中多酚氧化酶和酚类物质反应发生的酶促褐变[5-6]。在健康完好的鲜果粒中,作为底物的酚类物质和多酚氧化酶是分离的,正常情况下,多酚氧化酶在细胞内一种以可溶的形式存在于细胞质中,另一种结合在质体、线粒体、叶绿体等细胞器膜和细胞膜或细胞壁上[7-8],酚类物质分布于液泡中[9-10]。由于酚类物质与多酚氧化酶是呈现区域化分布的,酶与酚类物质不能接触,不会发生褐变。无核白葡萄脱水干制过程中,随着水分的散失,果粒逐渐皱缩紧致,组织结构的改变,同时,葡萄表皮因失水皱缩可能会导致氧气的进入,从而引发酶促褐变的反应。
目前有研究表明:细胞超微结构与褐变密切相关。许传俊等[11]研究发现蝴蝶兰在褐变过程中,细胞内出现黑色絮状物质,细胞膜完整性被破坏。李桂峰[12]对苹果果肉褐变中细胞超微结构和氧化酶活性变化的研究中发现,果肉褐变与氧化酶活性和细胞超微结构有关。刘峰娟等[13]在脱水速度对无核白葡萄果皮褐变和细胞超微结构的影响中,从侧面证明了无核白葡萄褐变时,细胞区室化分布打破,酚类物质与多酚氧化酶接触,从而产生褐变的推测。以上都只是证明了细胞超微结构与褐变有关系,却未从精确的从细胞化学定位的角度观察褐变过程中细胞酚类物质和多酚氧化酶的变化情况。鞠志国等[10]采用组织染色的方法,探讨莱阳荏梨细胞内酚类物质的分布及其与组织褐变的关系,而本文利用透射电镜细胞化学定位的方法,研究不同脱水速度对无核白葡萄细胞中酚类物质和多酚氧化酶的影响,以期解释无核白葡萄采后脱水干制过程中的褐变问题,为提高无核白葡萄干品质提供参考依据。
1 材料与方法
1.1 材料与仪器
无核白葡萄 采自新疆吐鲁番市,挑选成熟,无病虫害,无损伤,大小均匀的果实为实验材料。葡萄果实 可溶性固形物质量分数19%~22%,湿基含水率为79%±0.11%,果实直径为(11.17±0.45) mm,长度为(15.25±0.23) mm,采摘后就进行实验。促干剂(主要成分为碳酸盐、酯类和乳化剂)、磷酸氢二钠、磷酸二氢钠、氯化钠、咖啡因、L-多巴溶液、锇酸、戊二醛乙醇、丙酮、醋酸铀、柠檬酸铅 均为分析纯。
CS101型电热恒温恒湿干燥箱 乌鲁木齐电器设备制造厂;LKB-2188型超薄切片机 瑞典LKB公司;JEOLM-1230型透射电镜 日本电子株式会社。
1.2 实验方法
1.2.1 葡萄的干燥 参照刘峰娟等[14]实验处理方法。无核白葡萄经2.3%促干剂浸泡1 min后分为两组,一组为快速脱水组:将葡萄平铺在干燥箱中进行烘干,处理温度37 ℃,风速1 m/s,达到葡萄干标准的水分含量15%时所用时间为6.45 d;另一组为缓慢脱水组:将葡萄平铺于干燥箱中室温条件下自然脱水,环境温度24 ℃,平均风速0.1 m/s,达到葡萄干标准的水分含量15%时所用时间为24.35 d。在葡萄质量损失0%、20%、40%、60%、80%时取样。
1.2.2 无核白葡萄褐变指数评价 参照林河通等[15-16]介绍的方法。每次随机选取50粒无核白葡萄,根据观察,按照果皮表面褐变面积大小将果皮褐变程度分为6级:1级:无褐变发生;2级:0%<褐变面积<25%;3级:25%≤褐变面积<50%;4级:50%≤褐变面积<75%;5级:75%≤褐变面积<100%;6级:全部褐变。按下式计算褐变发生率。
果皮褐变指数=∑(褐变级数×该级果数)/总果数
1.2.3 多酚氧化酶细胞化学定位的观察 参照文献[17-18]的方法,修改如下:用双面刀片将快速脱水和缓慢脱水处理的不同质量损失的无核白葡萄果皮切成1 mm×1 mm×2 mm大小的块,用2.5%戊二醛溶液(10%福尔马林-乙酸钙配制)在4 ℃条件下固定2 h。用pH7.2的磷酸缓冲液漂洗3次,每次10 min,再分别放入pH6.8多酚氧化酶孵育液室温条件下反应1.5 h,对照组未加多酚氧化酶孵育液在室温条件下反应1.5 h。样品和对照组样品都再用pH7.2的磷酸缓冲液漂洗3次,每次10 min,再用1%锇酸固定1 h,用蒸馏水漂洗3次,每次10 min,用50%、70%、80%、90%乙醇溶液梯度脱水,每次15 min,用100%乙醇脱水2次,每次15 min,再用100%丙酮脱水15 min。用Spurr树脂(Spurr树脂∶丙酮1∶2)渗透包埋12 h,再用Spurr树脂(Spurr树脂∶丙酮2∶1)渗透包埋12 h,再用Spurr树脂(纯Spurr树脂)渗透包埋48 h,70 ℃条件下聚合48 h,修块,切片,透射电镜观察。
多酚氧化酶孵育液:1 mg/mL的L-多巴溶液,用pH6.80.1 mol/L磷酸缓冲液加入2% NaCl配制。
对照液:不含L-多巴溶液。
1.2.4 酚类物质细胞化学定位的观察 参照文献[19-20]的方法略有修改,用双面刀片将快速脱水和缓慢脱水处理的不同质量损失的无核白葡萄果皮切成1 mm×1 mm×2 mm大小的块,样品中加质量分数为0.5%的咖啡因溶液,不加咖啡因溶液作为对照组,用2.5%戊二醛溶液(0.1 mol/L磷酸缓冲液配制,pH7.2)在4 ℃条件下固定2 h,用pH7.2的磷酸缓冲液漂洗3次,每次10 min,再用1%锇酸固定1 h,用蒸馏水漂洗3次,每次10 min,再用醋酸铀染色1.5 h,用50%、70%、80%、90%乙醇溶液梯度脱水,每次15 min,其他步骤同1.2.3,电子染色(醋酸铀和柠檬酸铅)透射电镜观察。
1.3 数据处理
实验数据采用Origin 8.5作图,并采用SPSS 20.0统计软件进行邓肯式多重差异比较,当p<0.05时,差异显著。
2 结果与分析
2.1 脱水过程中无核白葡萄褐变指数的变化
如图1所示,无核白葡萄在质量损失40%时褐变指数由1开始变化。缓慢脱水处理无核白葡萄在质量损失40%时开始发生变化,说明缓慢处理的无核白葡萄开始发生褐变现象,而快速脱水处理无核白葡萄在质量损失60%时变化明显,出现褐变现象,这与刘峰娟等[11]研究结果相一致。缓慢脱水无核白葡萄褐变指数从质量损失40%时一直呈显著性的上升(p<0.05),褐变指数从1增大到5.24。而快速脱水葡萄褐变指数从质量损失60%时呈现缓慢增长,褐变指数从1增大到2.91。说明快速脱水方式能有效的减少无核白葡萄褐变。
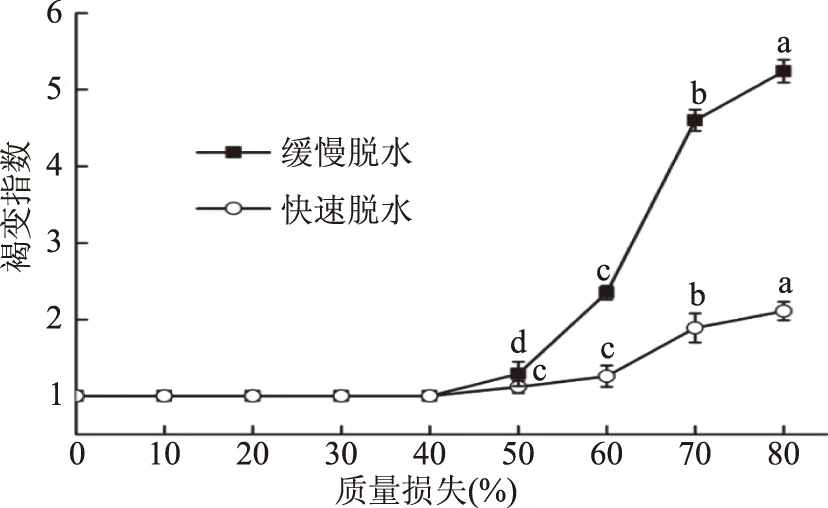
图1 脱水过程中无核白葡萄褐变指数的变化Fig.1 Changes in browning index of Thompson seedless grapes during dehydration注:不同字母表示差异性显著(p<0.05)。
2.2 新鲜无核白葡萄酚类物质和多酚氧化酶细胞化学定位观察
如图2所示,在电子显微镜下可以观察到完整的细胞结构和细胞壁,细胞壁整齐,厚度一致,呈现明-暗-明的分区结构,叶绿体呈椭圆形,大多靠近细胞壁,叶绿体表面有完整的双层膜结构,被膜清晰,清晰的片层结构,片层间隙有大小不同的淀粉颗粒和嗜饿球颗粒。内质网紧贴叶绿体或液泡。线粒体呈圆形或椭圆形,数量多,双层膜结构,多数线粒体与叶绿体镶嵌紧密,脊数量多。液泡数量多,液泡膜完整。
许多研究者研究表明[9-10]:酚类物质存在于液泡中。从图2A1~A4可知,新鲜无核白葡萄样品的细胞结构中可以看到液泡中含有许多黑色颗粒物质。而对照组的液泡中却未看到黑色颗粒物质,即可说明液泡中的黑色物质即为酚类物质。在新鲜的无核白葡萄的液泡中酚类物质主要分布于液泡的中央,液泡膜附近分布较少。
许多研究者研究表明[7-8]:多酚氧化酶可溶形式存在于细胞质中,结合形式存在于质体、线粒体、叶绿体等细胞器膜和细胞膜。从图2B1~B4可知,新鲜无核白葡萄样品的细胞结构中可以看到细胞质、液泡膜、叶绿体膜上有许多黑色颗粒,对照组的细胞质中及膜上都未看见黑色颗粒,说明细胞质中和膜上的黑色颗粒即为多酚氧化酶。

图2 新鲜无核白葡萄果皮酚类物质和多酚氧化酶细胞化学定位观察Fig.2 Cytochemical localization of phenolics and polyphenol oxidase of pericarp of fresh Thompson seedless grapes注:A1~A2新鲜无核白葡萄果皮酚类物质;A3~A4对照组无核白葡萄果皮酚类物质;B1~B2新鲜无核白葡萄果皮多酚氧化酶;B3~B4对照组无核白葡萄果皮多酚氧化酶;下脚标数字表示电镜倍数不同。CW.细胞壁;Cy.细胞质;M.线粒体;ChI.叶绿体;ER.内质网;OG.嗜饿颗粒;SG.淀粉颗粒;V.液泡。
2.3 快速和缓慢脱水质量损失20%时无核白葡萄酚类物质和多酚氧化酶细胞化学定位
如图3A1~A4所示,快速脱水质量损失20%时,无核白葡萄细胞壁和细胞膜结构完整,叶绿体和线粒体数量多,双层膜结构完整,个别叶绿体双层膜稍有破损,能清晰的看到叶绿体的片层结构,叶绿体上含有许多淀粉颗粒和嗜饿颗粒。图3A1~A2中液泡膜结构完整,少量的酚类物质开始存在于液泡膜附近,但大部分酚类物质存在于液泡中央位置。图3A3~A4中细胞膜和细胞质上存在有多酚氧化酶颗粒。
如图3B1~B4所示,缓慢脱水质量损失20%时,无核白葡萄细胞壁和细胞膜结构完整,出现质壁分离现象,有细胞壁稍微变形,部分叶绿体和线粒体双层膜裂解,部分液泡膜裂解,液泡中酚类物质主要存在于液泡膜附近,少量的酚类物质存在于液泡中央。与新鲜的无核白葡萄相比,缓慢脱水质量损失20%时,细胞结构已有差异,部分叶绿体线粒体的双层膜已裂解。缓慢脱水的无核白葡萄结构完整,部分叶绿体线粒体双层膜裂解,液泡膜裂解,多酚氧化酶存在于液泡膜、线粒体膜、叶绿体膜上。

图3 快速和缓慢脱水质量损失20%时无核白葡萄果皮酚类物质和多酚氧化酶细胞化学定位Fig.3 Cytochemical localization of phenolics and polyphenol oxidase ofpericarp of dried Thompson seedless grapes with mass loss of 20% by fast and slow dehydration注:A1~A2快速脱水质量损失20%酚类物质;A3~A4快速脱水质量损失20%多酚氧化酶;B1~B2缓慢脱水质量损失20%酚类物质;B3~B4缓慢脱水质量损失20%多酚氧化酶;下脚标数字表示电镜倍数不同。CW.细胞壁;Cy.细胞质;M.线粒体;ChI.叶绿体;ER.内质网;OG.嗜饿颗粒;SG.淀粉颗粒;V.液泡。
2.4 快速和缓慢脱水质量损失40%无核白葡萄酚类物质和多酚氧化酶细胞化学定位
如图4A1~A4所示,快速脱水质量损失40%无核白葡萄在透射电镜下细胞结构完整,细胞壁排列整齐,稍有松驰,有个别已发生变形,细胞膜完整,质壁分离现象明显,线粒体叶绿体膜结构已裂解,叶绿体膨胀,片层变得疏松,细胞核结构完整,液泡膜完整,液泡中酚类物质存在于液泡中央,酚类物质还未有流出的迹象。
如图4B1~B4所示,缓慢脱水的无核白葡萄结构已松弛,明-暗-明的结构已完全看不出,质壁分离现象显著,线粒体叶绿体等细胞器变少,叶绿体片层非常疏松,片层结构已模糊,液泡膜破裂,部分液泡已融合,液泡中酚类物质部分已流出,说明细胞区室化作用已打破,酚类物质与多酚氧化酶已接触。而且缓慢脱水的无核白葡萄在质量损失40%时褐变指数已开始发生变化,这也说明了酶促褐变开始发生。这与刘峰娟等[13]研究的猜测结果相吻合。

图4 快速和缓慢脱水质量损失40%无核白葡萄果皮酚类物质和多酚氧化酶细胞化学定位Fig.4 Cytochemical localization of phenolics and polyphenol oxidase of pericarpofdried Thompson seedless grapes with mass loss of 40% by fast and slow dehydration注:A1~A2快速脱水质量损失40%酚类物质;A3~A4快速脱水质量损失40%多酚氧化酶;B1~B2缓慢脱水质量损失40%酚类物质;B3~B4缓慢脱水质量损失40%多酚氧化酶;下脚标数字表示电镜倍数不同。CW.细胞壁;Cy.细胞质;M.线粒体;ChI.叶绿体;ER.内质网;OG.嗜饿颗粒;SG.淀粉颗粒;V.液泡;N.细胞核;NO.核仁。
2.5 快速和缓慢脱水质量损失60%无核白葡萄酚类物质和多酚氧化酶细胞化学定位
如图5A1~A4所示,快速脱水质量损失60%的葡萄细胞壁完全松弛变形,质壁分离现象显著,细胞器减少,线粒体膜结构消失,部分破裂,出现空泡。叶绿体膜结构裂解,片层模糊不清,膨大肿胀,液泡膜部分降解,液泡出现融合现象。从图5A1~A2可以看出液泡中部分酚类物质流出。细胞区室化作用打破。从图5A3~A4可以看出细胞质中的多酚氧化酶与液泡紧贴,液泡膜遭到破坏,酚类物质流出与多酚氧化酶作用发生褐变作用。快速脱水质量损失60%葡萄褐变指数也显著上升,这也验证了细胞区室化打破,酚类物质与多酚氧化酶发生了褐变。
如图5B1~B4所示,缓慢脱水质量损失60%的葡萄细胞壁变形扭曲,甚至有断裂,质壁分离显著,细胞内没有完整的细胞器结构,叶绿体膜降解,片层明显减少,排列紊乱,膨胀,部分叶绿体已降解。液泡膜降解,小液泡融合。图5B1~B2中酚类物质明显增多且大多数从液泡中流出,这也说明缓慢脱水质量损失60%时褐变指数显著上升的原因。图5B3~B4中多酚氧化酶明显增多,较多的酚类物质与多酚氧化酶反应,导致褐变指数显著性的上升,这与褐变指数变化情况相对应。
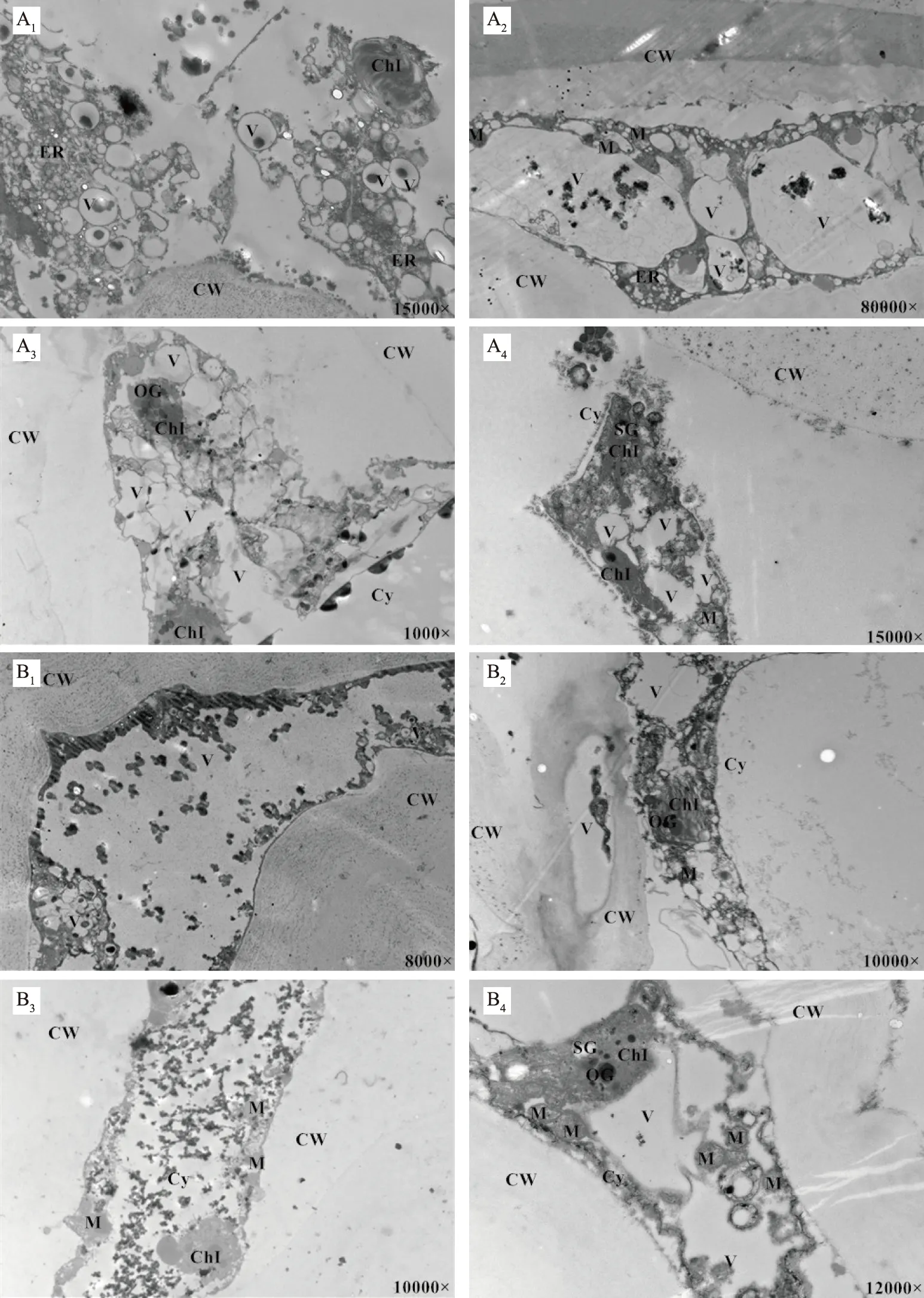
图5 快速和缓慢脱水质量损失60%无核白葡萄果皮酚类物质和多酚氧化酶细胞化学定位Fig.5 Cytochemical localization of phenolics and polyphenol oxidase of pericarpofdried Thompson seedless grapes with mass loss of 60% by fast and slow dehydration注:A1~A2快速脱水质量损失60%酚类物质;A3~A4快速脱水质量损失60%多酚氧化酶;B1~B2缓慢脱水质量损失60%酚类物质;B3~B4缓慢脱水质量损失60%多酚氧化酶;下脚标数字表示电镜倍数不同。CW.细胞壁;Cy.细胞质;M.线粒体;ChI.叶绿体;ER.内质网;OG.嗜饿颗粒;SG.淀粉颗粒;V.液泡。
2.6 快速和缓慢脱水质量损失80%无核白葡萄酚类物质和多酚氧化酶细胞化学定位
如图6A1~A4所示,快速脱水质量损失80%的葡萄细胞壁变形,断裂,细胞膜破裂降解,细胞内细胞器减少,线粒体出现空洞,内容物流出,解体,叶绿体扭曲变形甚至部分已解体,细胞器残片及颗粒遍布细胞中。图6A1~A2中液泡膜已破裂,酚类物质完全流出。图6A3~A4中细胞结构已分不清,多酚氧化酶颗粒与细胞器降解物溶为一体已成为黑色聚合物。
如图6B1~B4所示,缓慢脱水质量损失80%葡萄细胞结构已破坏,细胞壁变形断裂降解,细胞内多数细胞器结构已不存在,只能看见少量线粒体叶绿体轮廓,内容物已降解,细胞器降解的物质分布在细胞中,酚类物质和多酚氧化酶反应的黑色颗粒也和细胞器降解物充满细胞中。

图6 快速和缓慢脱水质量损失80%无核白葡萄果皮酚类物质和多酚氧化酶细胞化学定位Fig.6 Cytochemical localization of phenolics and polyphenol oxidase of pericarpof dried Thompson seedless grapes with mass loss of 80% by fast and slow dehydration注:A1~A2.快速脱水质量损失80%酚类物质;A3~A4.快速脱水质量损失80%多酚氧化酶;B1~B2缓慢脱水质量损失80%酚类物质;B3~B4缓慢脱水质量损失80%多酚氧化酶;下脚标数字表示电镜倍数不同。CW.细胞壁;Cy.细胞质;M.线粒体;ChI.叶绿体;ER.内质网;OG.嗜饿颗粒;SG.淀粉颗粒;V.液泡。
3 讨论与结论
在本研究中,快速脱水无核白葡萄在6.02 d就达到了葡萄干水分含量的要求,而缓慢脱水无核白葡萄需要24.12 d才能达到葡萄干水分含量的要求。当组织受损时这种空间隔离区室化被打破,多酚氧化酶与底物接触发生作用,产生黑色和褐色物质,从而导致组织酶促褐变[21-22]。缓慢脱水无核白葡萄在质量损失40%时开始发生酶促褐变,褐变指数从1开始发生显著性的变化(p<0.05),而快速脱水无核白葡萄在质量损失60%时才开始发生褐变,褐变指数变化缓慢。缓慢脱水质量损失40%时细胞结构已发生明显的变化,特别是部分液泡膜已破裂,酚类物质流出引起酶促褐变,在质量损失60%时,缓慢脱水无核白葡萄液泡膜已完全破裂,酚类物质流出,褐变加剧,褐变指数也明显上升。此时液泡中酚类物质也明显的增多。这与张利娟等[23]研究发现30 ℃热风干制第8 d总酚含量有所增加,且与葡萄出现明显的褐变相符,与本研究结果相同。缓慢脱水质量损失80%时细胞结构已完全破坏,褐变严重,褐变指数已达5.24。而快速脱水质量损失40%时细胞结构变化差异不大,此时液泡膜未破裂,酚类物质未流出,褐变未发生。在质量损失60%时,快速脱水葡萄液泡膜部分破裂,酚类物质流出,引起褐变。相比缓慢脱水而言,快速脱水能较好的保持细胞的完整性,较低的褐变指数。
综上所述,无核白葡萄在采后脱水干制过程中,细胞结构破坏使定位于液泡中的酚类物质流出,与定位于细胞质、液泡膜、叶绿体膜、细胞膜、线粒体膜上的多酚氧化酶反应引起果皮褐变。脱水速度的不同对果皮褐变的影响也不同。快速脱水的无核白葡萄能更好的保持细胞的完整性,能更好的减少褐变的发生,也能缩短无核白葡萄制干的时间,节约成本,提高无核白葡萄干的品质。
