发酵麦麸对面包膳食纤维组成及烘焙特性的影响
2019-04-01OmediJacobOjobi
,,,, ,,,,*,Omedi Jacob Ojobi
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.张家港福吉佳食品股份有限公司,江苏张家港 215631;3.华南理工大学轻工与食品学院,广东广州 510641)
麦麸是一种成本低廉且富含膳食纤维的小麦加工副产品[1]。麦麸因富含膳食纤维、维生素C及矿物质等成分而具有极高的营养价值,用麦麸制作的面包中氨基酸、膳食纤维等成分得到强化,但麦麸会对面包质构、风味和口感产生不良影响而使其在烘焙工业中利用率低[2-3]。目前,人们已经采用酶制剂和生物发酵技术来改善麸皮的加工和营养特性。发酵麦麸富含天然纤维素酶,主要来源于麦麸中残留的微生物酶、谷物内源酶和发酵菌株分泌的胞外酶,其活力受到麦麸来源、磨粉工艺及菌株特性等影响[4]。
目前,主要研究通过乳酸菌或酵母菌发酵营造特殊环境(如低pH)来激活麦麸内源酶降解细胞壁,而关于利用食品安全级菌株分泌胞外酶降解麦麸鲜有报道[5]。在已有报道中关于高产内、外切葡聚糖酶及木聚糖酶的微生物多为黑曲霉[6]、木霉[7]及芽孢杆菌[8]等,均难以直接用于食用麦麸发酵,因此优选高产纤维素酶的食品级微生物成为发酵麦麸中不溶性纤维素和木聚糖有效降解研究的关键方向。
本研究选用具有β-葡萄糖苷酶生产能力的马克斯克鲁维酵母发酵麦麸,研究发酵麦麸中纤维素酶活力变化及其对面包中膳食纤维组成及烘焙特性的影响,为开发高品质、天然营养的高膳食纤维面包提供理论参考。
1 材料与方法
1.1 材料与仪器
小麦麸皮(其中膳食纤维、蛋白质、水分及灰分含量分别为45.31%、16.91%、14.44%和4.10%) 河北省辛集市福之园面业有限公司;高筋粉 中粮面业鹏泰有限公司;商业马克斯克鲁维酵母ATCC36534 上海一研生物科技有限公司;木聚糖酶(酶活为88600 U/g) 荷兰皇家帝斯曼集团;对硝基苯基-β-D-吡喃葡萄糖苷(pNPG)、对硝基苯纤维二糖苷(pNPC)、对硝基苯(pNP)(分析纯) 阿拉丁试剂(上海)有限公司;乙酸盐缓冲液(pH5.0)、磷酸盐缓冲液(PBS)(pH7.4) 上海雷布斯网络科技有限公司;羧甲基纤维素钠(CMC-Na)、D-木糖(化学纯)、碳酸钠(Na2CO3)、氢氧化钠(NaOH) 国药集团化学试剂有限公司;YM肉汤培养基 杭州百思生物技术有限公司。
H1850R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;JYD-9OOL超声波细胞粉碎机 上海之信仪器有限公司;TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司;10ND冷冻干燥机 宁波新芝生物科技有限公司;CT3型质构仪 美国Brookfield公司;HP扫描打印机 惠普中国有限公司;SM-25搅拌机、SPC-40SP醒发箱、SM-503电烤炉 新麦机械(无锡)有限公司。
1.2 实验方法
1.2.1 酵母菌产酶特性测定 马克斯克鲁维酵母(K.marxianus)以冻干粉形式保存在安瓿瓶中,4 ℃保存。靠近酒精灯火焰,取少量灭过菌的YM肉汤悬浮管内的菌粉轻晃摇匀形成菌悬液。吸取全部菌悬液涂布在YM固体培养基上,于30 ℃培养48 h,再接种到YM肉汤中连续活化2代,取10 mL活化的酵母菌肉汤冷冻离心(4000×g,10 min),保留上清液。用PBS洗涤菌泥2次,然后悬浮在5 mL PBS中,保留1 mL悬浮液。将剩余悬浮液用超声波细胞粉碎机破碎处理20 min(功率450 W,间隔5 s),保留1 mL破碎液,将剩余部分冷冻离心(10000×g,10 min),破碎上清液保留,破碎沉淀用PBS洗涤2次,并重新悬浮于1 mL PBS中[9]。经以上处理可得到上清液、菌体沉淀、破碎液、破碎上清液和破碎沉淀中的β-葡萄糖苷酶,然后分别测定其中β-葡萄糖苷酶活力。将5 mL活化的酵母菌培养液冷冻离心(4000×g,10 min),用PBS洗涤菌泥后置于105 ℃烘箱恒重[9],用于计算酶活力时的单位转换(U/mL转换为U/g)。
1.2.2 发酵麦麸及面包面团制作 将酵母菌在YM肉汤中连续活化2代,离心(4000×g,10 min)收集菌泥,用无菌生理盐水洗涤两次;按麦麸∶水=10∶9的比例,于30 ℃下发酵48 h制作发酵麦麸(基于小麦粉和生麦麸总量的百分含量,发酵麦麸的发酵时间为24 h),酵母菌初始接种量为1.7×106cfu/g。每6 h取样直接用于酶活测定,剩余部分冷冻干燥(-40 ℃预冷冻,然后真空冷冻干燥48 h,真空度为20 Pa),磨粉过80目筛,用于膳食纤维组成和还原糖含量分析。
按照表1配方分别制作4种麦麸面包面团:麦麸面包/面团(B1/D1),发酵麦麸面包/面团(B2/D2),木聚糖酶麦麸面包/面团(B3/D3)和复合麦麸面包/面团(B4/D4),其中B2和B4中麦麸以湿基形式添加,其水分含量需要扣除。将固体木聚糖酶配制成90 U/mL溶液,在B3和B4中添加2 mL酶溶液。另外干酵母、白砂糖、食盐和黄油添加量分别为3.6、18、3、12 g。

表1 麦麸面包配方Table 1 Formulations of wheat bran enriched bread
将原料(除黄油)投入搅拌机,慢速混合3 min再快速混合2 min形成少量面筋。然后抹上黄油,慢速混合2 min,高速搅拌3 min至面筋完全扩展。静置10 min后分割(90 g/个)、搓圆,再静置10 min后放进恒温恒湿箱(38 ℃,85% RH)发酵90 min,焙烤(上火210 ℃,下火170 ℃)20 min,脱模冷却2 h。将搅拌,醒发后的面团及焙烤冷却后的面包样品冷冻干燥,磨粉过80目筛,正己烷脱脂[10]后用于分析。
1.2.3 纤维素酶活力测定
1.2.3.1 粗酶液提取和酶活的计算 称取5.0 g发酵麦麸,加入20 mL乙酸盐缓冲液(0.1 mol/L,pH5.0),恒温振荡提取1 h(30 ℃,180 r/min),冷冻离心(10000×g,20 min)后,收集上清液4 ℃保存,适当稀释后用于酶活分析[11]。
按式(1)计算酶活,结果表示为每克(g)发酵麦麸中含有的酶活量U,1个酶活力单位(U)表示为:每分钟底物转化为1 μmol产物所需的酶量。
式(1)
式中:E为酶活力(U/g);c为标准曲线上查得产物量(μmol);n为稀释倍数;t为反应时间(min);m为麦麸质量(g)。
1.2.3.2 内切葡聚糖酶活力的测定 将0.5 mL CMC-Na溶液(2%)加入到10 mL试管中,50 ℃预热5 min。加入0.5 mL粗酶液,恒温30 min。结束后加1.5 mL DNS溶液,在沸水中保持5 min,冰水冷却;加水补足至刻度线,在540 nm下测定吸光值。空白组先放入1.5 mL DNS溶液,再加入0.5 mL粗酶液和0.5 mL CMC-Na溶液[11]。在相同条件下,以2.0~12.0 μmol/mL的葡萄糖溶液绘制标准曲线(y=0.1634x-0.1139,R2=0.9993),计算所测定吸光值下的产物量,由式(1)计算酶活。
1.2.3.3 外切葡聚糖酶活力的测定 将100 μL粗酶液与1.8 mL乙酸盐缓冲液(0.1 mol/L,pH5.0)混合,40 ℃保温5 min。后加入100 μL底物pNPC溶液(10 mol/L),空白组用100 μL缓冲液替代粗酶液。准确反应10 min,迅速加入1 mL Na2CO3溶液终止反应,在400 nm处测量吸光值。在该条件下,以0.01~0.06 μmol/mL的pNP溶液绘制标准曲线(y=18.36x+0.0144,R2=0.9999),计算所测定吸光值下的产物量,由式(1)计算酶活。
1.2.3.4β-葡萄糖苷酶活力的测定 将100 μL粗酶液、1.8 mL乙酸盐缓冲液(40 ℃预热)和100 μL底物pNPG(20 mmol/L)混合均匀,40 ℃保温10 min,用1 mol/L Na2CO3溶液终止反应,于400 nm处测定吸光值,以缓冲液作空白对照。以0.01~0.06 μmol/mL的pNP溶液为标样绘制标准曲线(y=18.36x+0.0144,R2=0.9999),计算所测定吸光值下的产物量,由式(1)计算酶活。
1.2.4 膳食纤维组成分析 参照GB 5009.88-2014法[10],干燥样品经过酶解去除蛋白质和淀粉后,经过乙醇沉淀、抽滤(或酶解后直接抽滤),洗涤残渣,干燥称量,分析发酵麦麸及面包中总膳食纤维、可溶性膳食纤维和不溶性膳食纤维含量。
1.2.5 还原糖含量测定 参考GB 5009.7-2016法[12],采用0.1 mol/L NaOH钝化麦麸中的酶,乙酸锌和亚铁氰化钾溶液使蛋白质、淀粉等大分子发生沉淀,过滤后得到澄清透明提取液。采用DNS法在540 nm波长下测定吸光度。以0.2~0.7 mg/mL的葡萄糖溶液绘制标准曲线(y=2.0609x-0.2672,R2=0.9992),计算还原糖的含量。
1.2.6 面包烘焙品质测定 参照GB/T 20981-2007法[13]测定面包(冷却2 h)体积(表示为mL);参照GB 5009.3-2016法[14],测定面包芯水分含量;参考钟京等[15]方法,面包被切成1 cm薄片,用质构仪(TPA模式)对中心完整均匀的两片面包进行质构分析。测定参数:探头型号P/36,测试前速率3.0 mm/s,测试速率1.0 mm/s,测试后速率3.0 mm/s,压缩程度50%,触发力5 g,压缩时间间隔1 s。
1.2.7 面包气孔结构分析 将1.2.2中冷却后(2 h)的面包切成1 cm厚的薄片,用HP扫描仪进行图像收集,分辨率为600 dpi,参考钟京等[15]方法利用Image J对麦麸面包图像进行分析,每片面包样品至少取5个不同点,得到面包的气孔稠密度(CD,cells/cm2)和气孔表面积分率(AF,%)。
1.2.8 阿拉伯木聚糖组成分析 将1.0 g面包样品与20 mL去离子水在摇床中振荡提取水溶性阿拉伯木聚糖(SAX)(20 ℃,150 r/min,30 min),把提取物进行冷冻离心(5000 r/min,10 min)[16]。取1 mL上清液、1 mL去离子水和10 mL新鲜的反应液(1 g间苯三酚溶于5 mL无水乙醇,2 mL盐酸,110 mL乙酸,1 mL 17.5 g/L葡萄糖)到具塞玻璃管。总阿拉伯木聚糖测定是直接将0.1 g麦麸样品悬浮在2 mL去离子水中,再与反应液混合[17]。将玻璃管放入沸水反应25 min,冰水混合物降温,测定吸光值。以D-木糖为标品,横坐标是木糖浓度,纵坐标是两处吸光值之差,两个波长分别为510 nm和552 nm,按式(2)计算阿拉伯木聚糖含量。
式(2)
式中:W为阿拉伯木聚糖含量(mg/g);c为标准曲线上查得木糖含量(mg);0.88为转换因子;n为稀释倍数;m为样品质量(g)。
1.3 数据处理
所有实验至少重复3次,结果表示为(平均值±标准偏差)。采用Microsoft Office Excel 2016进行数据统计分析,应用SPSS 20.0进行显著性分析(p<0.05)。
2 结果与分析
2.1 酵母菌产β-葡萄糖苷酶能力
图1表示从马克斯克鲁维酵母菌体沉淀、上清液、破碎液、破碎上清液、破碎沉淀中得到的β-葡萄糖苷酶的酶活力,其中菌体沉淀中酶活力最高(33.46 U/g),这与大多数乳酸菌产的β-葡萄糖苷酶活力[10,15]相似。培养基上清液中的β-葡萄糖苷酶是由酵母菌产生并分泌到胞外所致,为6.98 U/g。万振堂等[18]从20种乳酸菌中筛选到10株具有产胞外β-葡萄糖苷酶的乳酸菌,其中粗酶液最高酶活可达54.74 U/g,而Pérez-Martín等[9]从红酒样中筛选出35株具有β-葡萄糖苷酶活力的乳酸菌,这些乳酸菌的酶活主要集中在菌体沉淀和破碎沉淀,发酵上清液中未检测到酶活;张哲等[19]对比了5株不同植物乳杆菌产β-葡萄糖苷酶的能力,在上清液和破碎上清液中均没有检测到明显的酶活。超声波处理有助于释放细胞壁、细胞膜间隙酶及胞内酶,破碎液中可检测到的酶活通常高于菌体沉淀[20],这与本研究结果不一致,这是由菌株品种不同所决定的[9]。图1显示破碎液中的β-葡萄糖苷酶活力主要存在于破碎沉淀中,破碎上清液中只有0.74 U/g,说明马克斯克鲁维酵母的β-葡萄糖苷酶主要附着在细胞壁或细胞膜,胞内可溶酶较少。因此,马克斯克鲁维酵母具有产胞外β-葡萄糖苷酶的能力,但大部分属于胞内酶,这部分酶可能是细胞壁、细胞膜结合酶,也可能位于细胞膜与细胞壁间的周质腔中的酶。

图1 酵母菌胞外及胞内产β-葡萄糖苷酶活力Fig.1 Extracellular and intracellular β-glucosidase activity produced by yeast注:图中不同小写字母表示组间存在显著性差异(p<0.05);图3同。
2.2 发酵麦麸中纤维素酶活力变化
图2显示了麦麸发酵过程中内、外切葡聚糖酶及β-葡萄糖苷酶活力变化。整个发酵过程中,内切葡聚糖酶表现出先增加再下降后稳定的趋势,在6 h其活力增加至麦麸初始发酵酶活的3倍,发酵后期(30~48 h)酶活力保持在0.3 U/g。其活力远低于现有文献报道的非食用型菌株,罗奉奉等[8]从土壤中筛选的芽孢杆菌内切纤维素酶活力为14 U/mL;张素敏等[7]选育的里氏木霉内切葡聚糖酶活力高达86 U/g。发酵0~48 h,外切葡聚糖酶活力从2.85 U/g增加至6.06 U/g,增加了1.1倍。发酵前期(0~18 h)β-葡萄糖苷酶活力保持较高的增长速率,一方面是由于内、外葡聚糖酶活力较高,为β-葡萄糖苷酶提供足够的底物;另一方面是由于马克斯克鲁维酵母分泌了大量胞外β-葡萄糖苷酶(如图1)。发酵后期,麦麸中酶作用趋于平衡使β-葡萄糖苷酶活力变化趋缓,但因底物充足仍保持在较高水平。
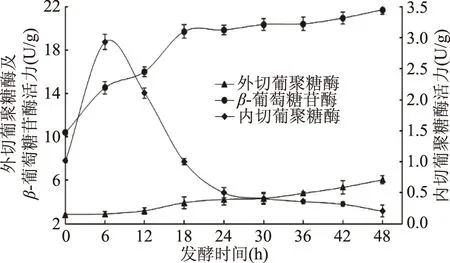
图2 麦麸发酵过程中内、外切葡聚糖酶及β-葡萄糖苷酶活力Fig.2 Changes in enzyme activities of endoglucanase,exoglucanase and β-glucosidase during wheat bran fermentation
2.3 发酵麦麸中膳食纤维含量及还原糖含量变化
图3显示了麦麸发酵过程中膳食纤维含量和还原糖含量变化。发酵麦麸中总膳食纤维含量变化范围为40.65~46.21 g/100 g,可溶性膳食纤维(SDF)变化范围为1.8~5.8 g/100 g,明显低于文献[21],这与麦麸来源及发酵工艺密切相关。发酵过程中,不溶性膳食纤维(IDF)含量持续下降(从0 h的45.38 g/100 g下降至48 h的38.30 g/100 g),主要是因为麦麸中多种纤维素酶(如图2)促进纤维素溶解。发酵0~30 h,可溶性膳食纤维(SDF)含量从0.83 g/100 g持续增加至2.50 g/100 g;发酵30~48 h,SDF含量略有下降,可能是因为发酵后期(30~48 h)IDF溶解速率减缓,外切葡聚糖酶及β-葡萄糖苷酶将现有的SDF降解成二糖或单糖,不在测量范围内[16]。

图3 麦麸发酵过程中IDF、SDF及还原糖含量变化Fig.3 Changes in IDF,SDF and reducing sugar content during wheat bran fermentation
麦麸中还原糖含量约为1.07 g/100 g,主要是葡萄糖和果糖(数据未给出)。发酵6 h,发酵麦麸中还原糖含量急剧增加至15.2 g/100 g,相比0 h提升了13倍,这与发酵麦麸中β-葡萄糖苷酶活力直接相关,且与内切纤维素酶活力变化趋势相同。发酵6 h之后,还原糖含量逐渐下降,且最终浓度维持在3.5~4.0 g/100 g范围内。这是由于马克斯克鲁维酵母利用还原糖生产乙醇,发酵30 h之后,还原糖消耗和积累趋于平衡。这与李锋等[22]研究结果一致。
2.4 麦麸面包制作过程中还原糖含量变化
由表2可知,麦麸面团搅拌后,含有发酵麦麸的面团(D2和D4)中还原糖含量分别为13.95和16.54 g/100 g,显著高于D1和D3(p<0.05),搅拌虽然对还原糖含量有影响,但其差异主要是原料中还原糖含量差异引起的。搅拌后,D1和D3中还原糖含量相当,说明搅拌过程中木聚糖酶对面团贡献极少。尽管醒发过程中酵母会消化还原糖,但在4种面团中还原糖含量都显著增加(p<0.05),说明醒发过程中各种纤维素酶表现出较高活力而作用于纤维素,从而生成了较多的还原糖。马榕灿等[23]也认为发酵前期(0~2 h)是还原糖快速积累的阶段。相比D2和D4,D3中还原糖含量增幅较少,可能是因为木糖占还原糖比例较小。焙烤时,面团中还原糖类和氨基化合物发生美拉德反应生成一些难溶性聚合物,导致4种面团中还原糖含量有所下降。整体而言,相比木聚糖酶,发酵麦麸对面包面团中还原糖含量影响最明显。

表2 面团搅拌、醒发及焙烤后还原糖含量变化Table 2 Changes of reducing sugar content after dough mixing,fermentation and baking
2.5 麦麸面包烘焙学特性
发酵麦麸对面包烘焙学特性的影响如表3所示。除了面团膨胀体积,面包比容还受到面包水分含量(质量)的影响,因此,本研究中仅对比了面包的体积。含有20%麦麸的B1面包含有大量的难溶性纤维素及半纤维素,面筋网络结构较差,面包体积仅为355 mL。相比B1面包,B2和B3面包体积分别提高了8.17%和3.66%,而B4面包提高了12.39%。这是由于AX溶解在水中形成黏稠溶液,提高了气孔膜的延伸性和耐受性,在焙烤过程中泡膜更加稳定、不易破裂[24]。

表3 发酵处理对麦麸面包烘焙学特性的影响Table 3 Effects of fermented treatment on baking properties of wheat bran enriched bread
表3显示,发酵麦麸及木聚糖酶都可以提高面包芯水分含量,可能是因为发酵麦麸中的天然酶及添加的木聚糖酶降低了水不溶性阿拉伯木聚糖(WUAX)交联度,使其溶胀持水能力增强[24];面团搅拌、醒发和焙烤阶段,木聚糖酶持续发挥作用,WUAX降解后其吸附的水分释放出来,重新分布在面包中[25]。值得一提的是,B4面包芯硬度只有267.67 g,这表明B4面包具有较柔软的面包芯结构。这都归因于马克斯克鲁维酵母发酵麦麸中的内源酶、酵母代谢酶及添加的木聚糖酶活力[21]。与B1相比,B2、B3及B4的弹性显著提高(p<0.05),这与面筋强度直接相关,说明发酵麦麸及木聚糖酶(尤其是发酵麦麸)对面筋网络结构有一定的优化作用。
2.6 麦麸面包气孔结构
气孔稠密度(CD)即面包芯单位面积含有的气孔个数,它与面团体系中面筋网络结构的交联程度、蛋白质与淀粉之间的相互作用有关。CD值越大,说明面包芯内部组织越细腻[12,23]。表4显示B2和B4的CD值显著高于B1和B3(p<0.05),这可能是因为发酵麦麸中的纤维素酶降解了难溶性纤维素片段,保护了面筋网络结构的完整性。B2和B3的CD值都显著高于B1(p<0.05),B2和B4间不存在显著差异,这说明发酵麦麸对面包气孔稠密度起决定性作用。

表4 发酵处理对麦麸面包芯气孔稠密度和表面积分率的影响Table 4 Effects of fermented treament on pores density and specific area ratio of wheat bran enriched bread
气孔表面分率可以间接的反映气孔的持气率和稳定性,与气孔的界面性质有关[15]。由表4可知,气孔表面分率大小为B4>B2>B3>B1,这说明木聚糖酶及发酵处理可协同提高面包AF值。此外,面包的气孔表面分率在一定程度上反应了面团的气体包裹量,且与面包体积趋势(如表3)保持一致。制作的4种麦麸面包芯气孔结构如图4所示,B1中气孔分布不均匀,形状不规则,且出现明显破裂成片的现象,这都是因为难溶性纤维素颗粒从空间结构上刺破气孔[27]。B3中气孔破裂现象有所缓解,气孔较大且边缘光滑;而B2和B4中无明显大型不规则气泡,气孔细密,且分布均匀。因此认为,发酵麦麸面包芯更加细腻光滑,面包品质显著提升。
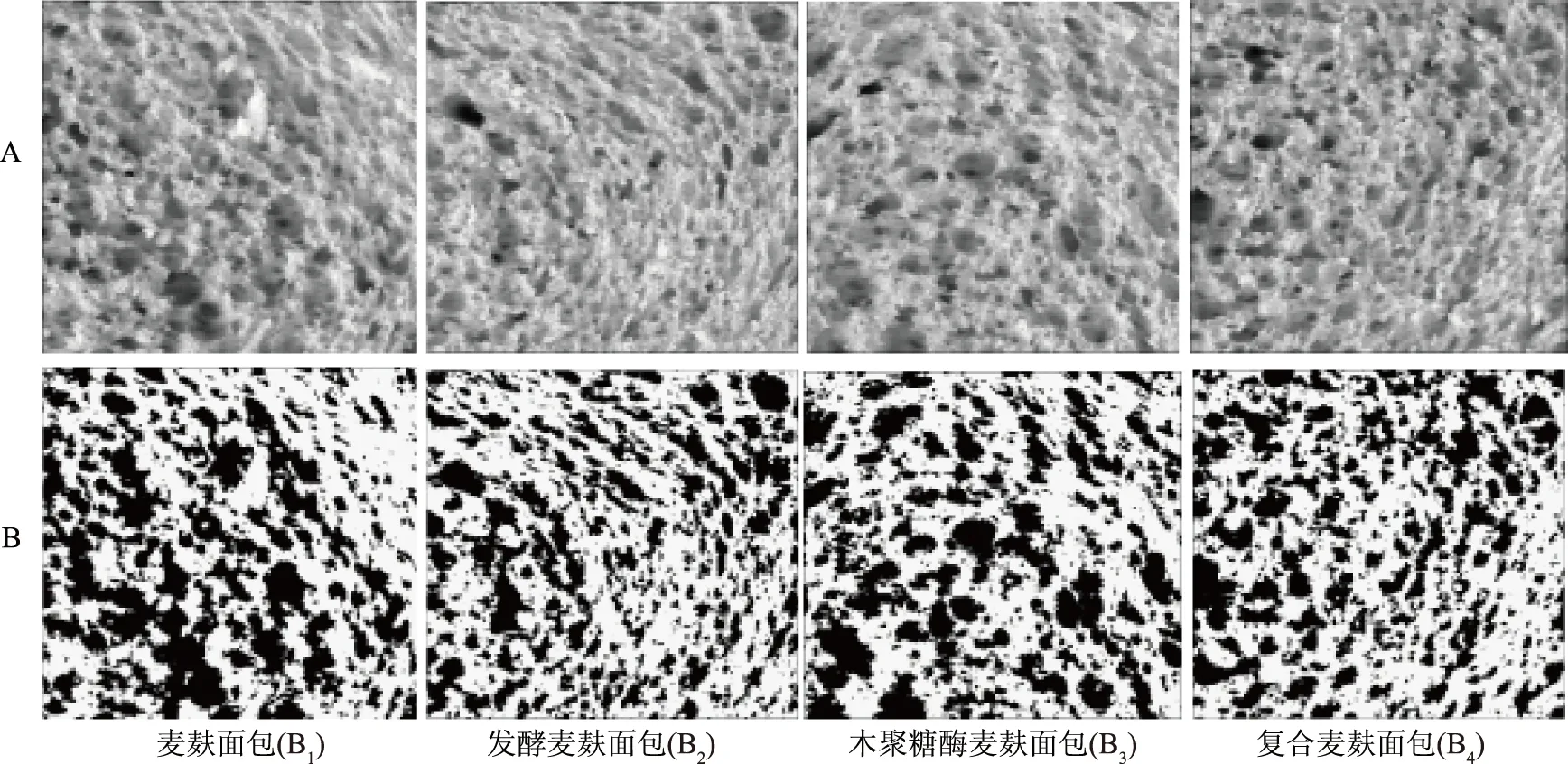
图4 发酵处理对麦麸面包气孔分布的影响Fig.4 Effects of fermented treatment on pores distribution of wheat bran enriched bread注:A是仪器扫描图,B是Image J处理图;图像扫描的分辨率为600 dpi,面包芯扫描图像截取大小为3.0 cm×3.0 cm。
2.7 麦麸面包膳食纤维组成
如表5所示,麦麸和发酵24 h麦麸中TDF含量范围为13.95~14.61 g/100 g。根据EC1924/2006营养与健康法规,将膳食纤维含量超过6%的面包定义为高膳食纤维面包,本研究制作的4种面包中总膳食纤维含量范围为13.95%~14.61%,都属于高膳食纤维面包范畴。尽管发酵麦麸面包中总膳食纤维含量低于麦麸面包,但在4种面包膳食纤维含量不存在统计学(p>0.05)差异。含有发酵麦麸的B2和B4中,SDF含量分别为4.12、4.37 g/100 g,显著高于B1和B3(p<0.05)。

表5 发酵处理对麦麸面包膳食纤维组成的影响Table 5 Effects of fermented treatment on dietaryfiber components of wheat bran enriched bread
2.8 麦麸面包阿拉伯木聚糖组成
阿拉伯木聚糖(AX)是膳食纤维重要的组成部分,表6显示发酵处理对麦麸面包中阿拉伯木聚糖组成产生影响。在4种面包中阿拉伯木聚糖含量范围为18.69~18.87 mg/g,不存在显著差异。B2、B3中可溶性阿拉伯木聚糖(SAX)含量分别为8.62和7.66 mg/g,显著高于B1(p<0.05),说明发酵处理和木聚糖酶有助于阿拉伯木聚糖的降解;而且B4中SAX含量拥有最高值9.73 mg/g,说明发酵处理和木聚糖酶的共同作用能更好地促进阿拉伯木聚糖溶解。

表6 发酵处理对麦麸面包阿拉伯木聚糖组成的影响Table 6 Effects of fermented treatment on araboxylan components of wheat bran enriched bread
3 结论
马克斯克鲁维酵母具有较强的生产胞外β-葡萄糖苷酶的能力。麦麸发酵过程中,外切葡聚糖酶和β-葡萄糖苷酶活力不断提高,而内切葡聚糖酶活力先增加后下降,发酵6 h活力最高;IDF含量不断下降,而还原糖含量在发酵6 h后提升13倍,与内切葡聚糖酶活力变化趋势相同。麦麸面团搅拌、醒发后,还原糖含量不断增加,且D2和D4增加效果最明显。相比B1和B3,B2和B4面包体积显著提高(p<0.05),弹性增强且保水性能好,面包芯气孔更加细腻均匀。制作的4种面包中总膳食纤维(TDF)和阿拉伯木聚糖(AX)含量没有显著差异,而添加发酵麦麸及木聚糖酶都能促进面包中IDF和AX溶解。因此,马克斯克鲁维酵母发酵麦麸作为天然纤维素酶来源,在麦麸面包中具有较好的应用价值。
