胃肠道神经内分泌肿瘤临床资料回顾附与腺癌共存病例分析
2019-03-27忻笑容吴云林罗方秀周郁芬谷雷雷朱时燕
忻笑容, 陈 平, 吴云林, 罗方秀, 谢 玲, 周郁芬, 谷雷雷, 朱时燕
上海交通大学医学院附属瑞金医院北院 1.消化内科;2.病理科,上海 201801
神经内分泌肿瘤(neuroendocrine neoplasms,NENs)是一类起源于干细胞且具有神经内分泌标志物,能够产生生物活性胺和/或多肽激素的肿瘤。可发生于呼吸系统、消化系统等各个部位,其中胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms,GEP-NENs)占NENs中的多数。有文献[1]报道,胃肠道神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms,GI-NENs)占全部NENs的50.6%。DASARI等[2]总结了美国64 971例患者显示,GEP-NENs的发病率约为3.56/10万,且发病率持续上升。但我国尚欠缺完善的NENs相关流行病学资料,临床医师对其认识程度也有差异。
上海交通大学医学院附属瑞金医院北院既往5年经病理证实的NENs患者共21例,其中以直肠为多见。本研究旨在通过分析我院所诊断并治疗的NENs患者的临床特点、病理特征、随访情况等,为今后的临床研究提供流行病学资料,同时提高对此疾病的诊治水平。
1 资料与方法
1.1一般资料收集2013年1月至2018年2月于上海交通大学医学院附属瑞金医院北院诊断为GI-NENs的患者21例。诊断标准参考中国胃肠胰神经内分泌肿瘤病理学诊断共识意见、美国国立癌症网络指南、欧洲神经内分泌肿瘤学会(European Neuroendocrine Tumor Society,ENETS)共识[3]。排除标准:对于临床、病理、随访资料不齐者则予以剔除。
1.2分类及分级标准[3]2010年WHO将NENs分类如下:(1)神经内分泌瘤(neuroendocrine tumor,NET)G1;(2)NET G2;(3)神经内分泌癌(neuroendocrine carcinoma,NEC)(大细胞或小细胞型)G3;(4)混合性腺-神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC);(5)增生性和癌前病变。同时,根据核分裂数和免疫组化染色Ki-67指数予以分级,G1(低级别,核分裂象数1/10高倍视野或Ki-67指数≤2%)、G2(中级别,核分裂象数2~20/10高倍视野或Ki-67指数3%~20%)、G3(高级别,核分裂象数>20/10高倍视野或Ki-67指数>20%)。
1.3资料收集和随访收集所有患者的临床病理资料,包括性别、年龄、诊断时间、临床表现、肿瘤直径及部位、治疗方式、误诊、随访、复发情况等。所有患者定期门诊随访或电话随访,截止时间为2018年3月。
2 结果
2.1一般情况本组患者男13例,女8例,年龄(54.48±12.44)岁(33~70岁)。主要临床表现:排便习惯改变9例(42.9%),腹痛3例(14.3%),发现肿块1例(4.8%),呕血黑便1例(4.8%),乏力1例(4.8%),无症状体检6例(28.6%)。所有病例均无类癌综合征的表现,1例患者为外院行乙状结肠NEC根治术后5年发生腹壁肿块、盆腔、腹股沟淋巴结转移。
2.2诊断及治疗本组21例患者肿瘤位于直肠17例(90.0%),胃2例(9.5%),后腹膜1例(4.8%),乙状结肠1例(4.8%)。病灶直径最大8 cm位于后腹膜,最小直径0.2 cm位于胃体。3例(14.3%)电子内镜白光下误诊为息肉。9例行外科手术治疗,11例行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),1例乙结肠术后转移者行抗肿瘤治疗。外科手术前均行胃镜、肠镜和/或CT、MRI检查。行ESD治疗前均行超声内镜及CT或MRI检查评估,其中3例(3/11,27.3%)术前超声内镜考虑为间质瘤可能。
2.3病理检查本组21例患者的病理结果显示,免疫组化嗜铬粒蛋白A(chromogranin A, CgA)阳性6例(28.6%),突触素(synaptophysin, Syn)阳性20例(95.2%),AE1/AE3阳性13例(61.9%)。G117例(90.0%);G23例(14.3%);G31例(4.8%)(见表1)。
2.4NENs与腺癌共存1例患者,男,34岁,术前胃镜示胃窦巨大增殖性病灶,胃多发隆起性病灶,慢性浅表-萎缩性胃炎(见图1~3)。胃镜活检病理:“胃窦”浅表黏膜慢性炎,活动期,肠化(+),H.pylori(-),“胃体活检标本”NENs,G2型,“胃底活检标本”浅表黏膜慢性炎。经多学科会诊后行全麻下腹腔镜全胃切除术+肠黏连松解术,术后标本肉眼见“全胃切除标本”:胃窦小弯侧见一隆起型肿块,大小10.0 cm×10.0 cm×3.0 cm,肿块累及胃窦前后壁,表面菜花样,切面灰白质韧,小弯侧找到结节9枚,直径0.1~1.5 cm,大弯侧找到结节5枚,直径0.3~0.8 cm(见图4~5)。病理示“全胃切除标本”:胃窦小弯侧腺癌Ⅱ级(隆起型),浸润至浆膜层,侵犯神经,脉管内见癌栓;大弯侧淋巴结1/5枚见癌转移;下切缘、网膜、另送“上切缘”、“第6组淋巴结”1枚、小弯侧淋巴结9枚,均未见癌累及或转移;免疫组化:肿瘤细胞CK20(灶+),CDX-2(+),Her2(0),Ki-67(30%+)。对胃壁结节进一步检查提示“胃体结节”为胃NENs(直径1.5 cm),G2型,浸润至黏膜下层,脉管内见瘤栓,免疫组化:肿瘤细胞AE1/AE3(+),CD56(-),CgA(+),Syn(+),CD34(-),Ki-67(约10%+)(见图6~10)。余胃壁结节均为腺癌转移结节。
另1例患者,男,65岁,术前外院肠镜示直肠乙结肠交界处腺癌,距肛缘9 cm见一直径2 cm黏膜下隆起,于我院行全麻下腹腔镜Hartmann+膀胱修补术(三孔)。术后病理诊断为“乙结肠癌根治标本”:(1)腺癌Ⅱ级(溃疡型),浸润至浆膜外纤维脂肪组织,脉管内见癌栓;(2)NENs,G2(隆起型),浸润至固有肌层;侵犯神经;上切端、下切端、基底切缘,未见癌累及;肠旁淋巴结19枚、“血管根部淋巴结”1枚,均未见癌转移。免疫组化:AE1/AE3(+),CD56(+),Syn(+),CgA(灶+),CDX-2(-),NSE(+),CD34(-),Ki-67(10%+)(见图11~16)。肉眼所见两处病灶相距13 cm,乙状结肠腺癌与直肠NENs(G2)共存。
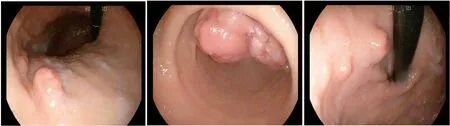
图1 胃体见多发隆起增生性病灶;图2 胃窦见一巨大增殖性病灶,堵塞幽门及部分胃窦腔,镜身无法通过;图3 胃底见多发隆起性病灶Fig 1 Multiple protuberant and proliferative lesions were seen in the stomach; Fig 2 A large proliferative lesion was seen in the antrum of the stomach, blocking the pylorus and part of the stomach; Fig 3 Multiple protuberant lesions were found in the fundus of stomach
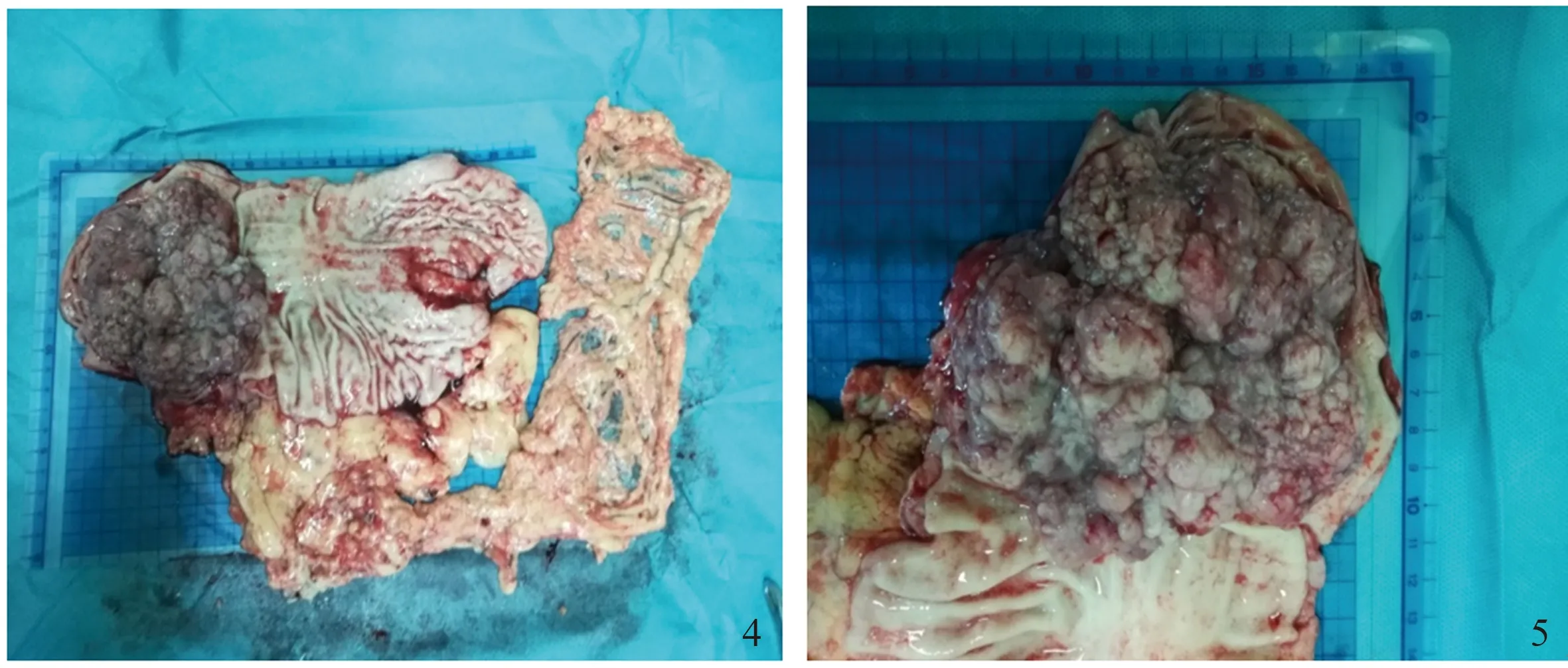
图4~5 全胃切除标本,胃窦见一隆起型肿块,大小10 cm×10 cm×3 cm,表面菜花样,胃壁见多发隆起结节Fig 4-5 In total gastrectomy specimens, a protuberant mass, 10 cm×10 cm×3 cm in size, with cauliflower-like surface and multiple protuberant nodules on the gastric wall was seen in the antrum
2.5随访本组患者4例失访,其余患者随访1~56个月(平均14.7个月)。1例患者为行乙状结肠癌根治术后5年发生腹壁肿块、盆腔、腹股沟淋巴结转移,诊断5个月后死亡。其他患者均未出现复发及转移情况。
3 讨论
1907年德国病理学家OBERNDORFER首次提出“类癌”这一概念,虽然组织学上与恶性肿瘤相似,但生物学行为趋于良性病变。既往认为NENs是一类罕见的疾病,但目前其发病率稳步上升,尤其是胃和直肠的NENs,可能与电子内镜的发展有关[2]。我国尚缺乏大规模的流行病学数据。广州中山大学第一附院回顾总结了1995年至2012年诊治的NENs资料,以pNENs最多,其次是直肠NENs[4]。本组患者发病年龄为(54.48±12.44)岁,男13例,女8例,发生于直肠17例(90.0%),胃2例(9.5%),后腹膜1例(4.8%),乙状结肠1例(4.8%)。目前发现NENs均存在潜在恶性可能,不论病理分级均可发生转移。GI-NENs可发生于消化道各个部位,出现各种非特异性临床表现。肿瘤能产生5-羟色胺代谢产物或多肽激素,如胰高血糖素、胰岛素、胃泌素或促肾上腺皮质激素等。根据分泌激素是否引起临床表现,可分为功能性NENs和非功能性NENs。本组患者均未发生类癌综合征,可能与入组患者肿瘤多发生于直肠有关。因其临床症状不典型,对诊断带来了一定难度。借助常规电子内镜、超声内镜、影像学检查、血清学检查等可对诊断提供佐证。本组患者中,3例电子内镜白光下误诊为息肉,ESD术前超声内镜检查3例考虑为间质瘤可能,提示临床极易误诊,尤其内镜检查医师需加强观察,提高对此类疾病的认识。随着内镜技术的不断发展,不仅对于诊断,对于GI-NENs的治疗也起到了巨大的作用。本组患者11例行ESD治疗,其中1例位于胃体,10例位于直肠,分级均为G1,治疗后均未发生复发或转移。提示体积较小、未累及固有肌层、无转移的NENs仍推荐或考虑内镜下切除。但对于G2型、G3型胃NENs的内镜下治疗,直肠NENs术后随访等问题仍存在一定争议[5]。
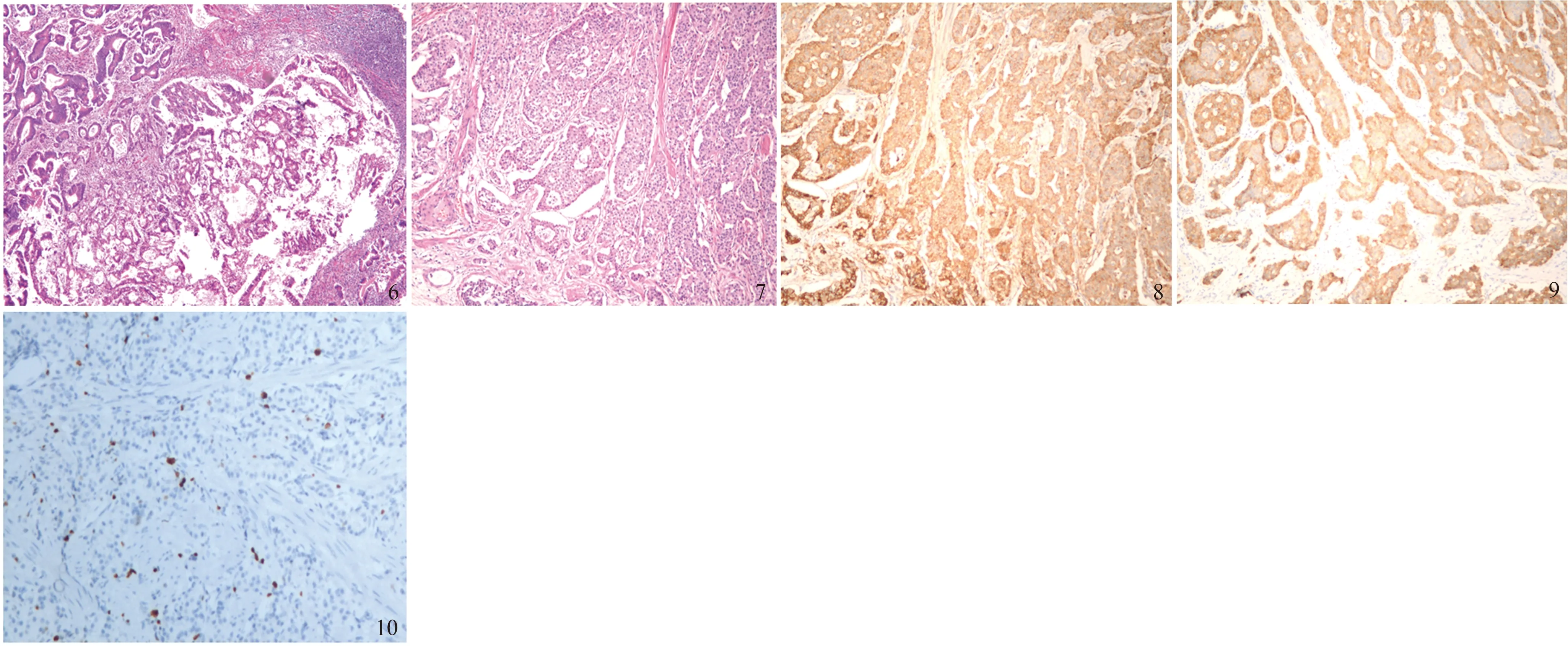
图6胃腺癌HE染色(SP100×);图7胃NENs(G2型)HE染色(SP100×);图8免疫组化CgA(+)(SP100×);图9免疫组化Syn(+)(SP100×);图10免疫组化Ki-67约10%+(SP100×)
Fig6HEstainingofgastricadenocarcinoma(SP100×);Fig7HEstainingofgastricNENs(G2type) (SP100×);Fig8ImmunohistochemicalCgA(+) (SP100×);Fig9ImmunohistochemicalSyn(+) (SP100×);Fig10ImmunohistochemicalKi-67wasabout10%+(SP100×)
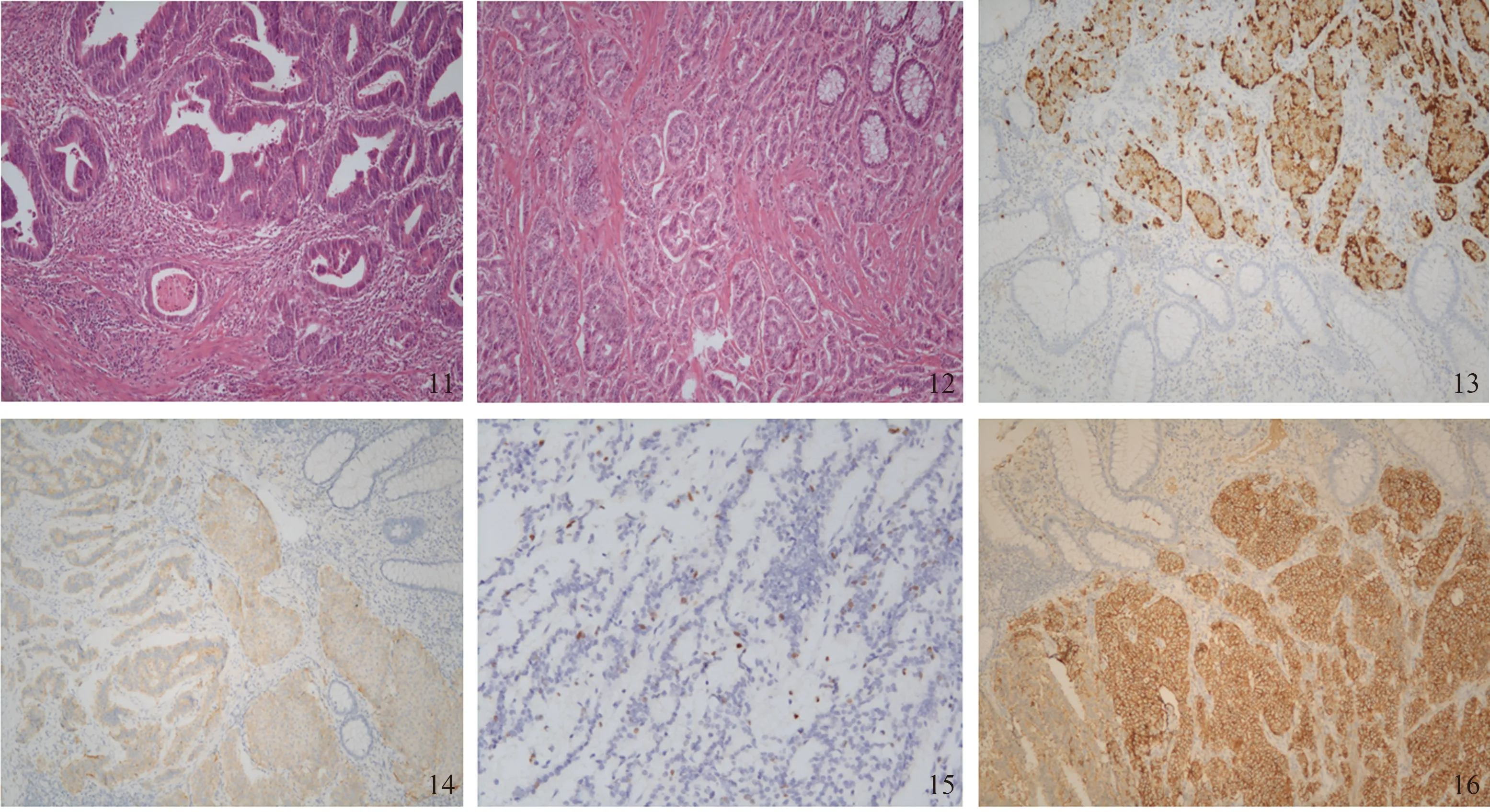
图11 乙状结肠腺癌HE染色(SP 100×);图12 直肠NENs HE染色(SP 100×);图13 免疫组化CgA(灶+)(SP 100×);图14 免疫组化Syn(+)(SP 100×);图15 免疫组化Ki-67(10%+)(SP 200×);图16 免疫组化CD56(+)(SP 100×)Fig 11 HE staining of sigmoid adenocarcinoma (SP 100×); Fig 12 HE staining of rectal NENs (SP 100×); Fig 13 Immunohistochemical CgA (Focus+) (SP 100×); Fig 14 Immunohistochemical Syn (+) (SP 100×); Fig 15 Immunohistochemical Ki-67 (10%+) (SP 100×); Fig 16 Immunohistochemical CD56 (+) (SP 100×)
病理学的诊断依然是NENs的诊断金标准,同时也是分级、分类的准则。免疫组化检查必须包括CgA和Syn;可选项目包括:CD56、特定激素、生长抑素受体2亚型、淋巴血管标志物和p53等。其中CgA特异性好,但后肠NENs多不表达CgA,与本组患者免疫组化结果一致。Syn、CD56和NES敏感性好,但特异性较差。此外,胰岛素瘤相关蛋白1(insulinoma associated protein 1,INSM1)在肿瘤组织中高表达,可能是NENs的新的免疫组化标志物之一[6]。而CD24多见于中肠起源的NENs,对于空回肠NENs的诊断有一定的意义[7]。微小RNA(microRNAs,miRNAs)可能是GEP-NETs潜在的生物标志物[8]。新的、针对不同部位的免疫组化标志物还需进一步的探索,从而对NENs诊断及治疗带来新的方向。
本组患者例数虽不多,但其中发现2例G2NENs与腺癌共存。1例NENs位于胃体,腺癌病灶位于胃窦;另1例NET位于直肠,而腺癌位于乙状结肠,两者相距13 cm。一般相距较近的病灶多考虑同一来源可能,术前根据内镜表现及活检病理,均首先考虑混合性腺-神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)可能。它是指具有腺癌特征,且同时具有NENs形态特征的上皮性肿瘤,每种成分至少各占30%以上,且均为恶性,应分别进行组织学分级。而部分腺癌经神经内分泌通用型的标志物(如CgA、Syn、CD56等)作免疫组织化学染色,有散在分布或灶性分布的阳性细胞,比例不超过30%,且为一致腺癌背景,并不具有独立的神经内分泌成分,称为腺癌伴神经内分泌分化[9]。此2例患者与其也不符合,临床非常罕见。经文献回顾我们发现,有10例左右NENs与腺癌并发的病例报道[10-12]。其发生机制还有待进一步的研究证实。有报道[13]显示,消化道内分泌细胞来源于局部多能胃肠道干细胞。这种复合肿瘤可能在肿瘤发生的早期阶段从共同的假定的前体细胞双向分化而来。此外,NENs的患者发生第二原发性恶性肿瘤的风险非常高,提示高分化NENs可能是继发其他恶性肿瘤的易感因素[14]。
综上所述,在临床工作中应提高对此类疾病的认识,以避免漏诊及误诊。任何NENs均具有潜在恶性,且可能伴发或继发其他恶性肿瘤,在诊治及随访过程中应提高警惕。通过对病例的不断总结,能加强对疾病的认识,而对于NENs的发生机制、新的特异性标志物及靶向治疗技术等还需进一步深入研究。
