有氧糖酵解与肿瘤恶病质的运动防御作用及机制
2019-03-14漆正堂丁树哲
曹 露,漆正堂,丁树哲
(1.华东师范大学 “青少年健康评价与运动干预”教育部重点实验室,上海200241;2.华东师范大学 体育与健康学院,上海200241)
肿瘤细胞即使在氧气充足的环境下,也会选择糖酵解作为主要供能方式,肿瘤细胞这种特殊代谢方式被称为有氧糖酵解(aerobic glycolysis)(Koppenol et al.,2011;Warburg et al.,1956)。肿瘤细胞这一特殊的代谢方式由1924年诺贝尔奖得主 Otto Warburg发现。Warburg观察肿瘤细胞行为发现,环境中有充足的氧气支持线粒体氧化磷酸化,肿瘤细胞还是趋向于酵解葡萄糖生成乳酸,由此提出,导致肿瘤发生的主要原因是细胞由正常的有氧呼吸代谢方式转变为糖酵解(Warburg et al.,1956),这种现象被称为有氧糖酵解或瓦博格效应(Warburg Effect)(图 1)(Gatenby et al.,2004)。Warburg效应与著名的“Pasteur 效应”相反,Pasteur效应是指在正常细胞中氧气抑制糖酵解,细胞代谢方式转为糖酵解一定是在周围环境氧气含量减少的前提下发生。肿瘤有氧糖酵解一直被当时科学界认为是一个悖论,直到细胞培养发现糖酵解速率提高伴随着肿瘤细胞生长增加(Simonnet et al.,2002; Vaupel et al.,1989),瓦博格效应才被接受,并且在临床不同肿瘤中得到了证实。肿瘤为什么选择如此不经济的有氧糖酵解作为主要代谢方式?这个问题尚无明确的答案。现在多数研究都是基于分化组织中没有增殖能力的细胞,但是当研究对象为单细胞生物或者增殖细胞时,就会发现它们与肿瘤细胞有着相同的代谢类型——有氧糖酵解(Vander et al.,2009),有氧糖酵解供能方式能为单核细胞和增殖细胞提供增殖所需的大分子物质,如核苷酸、氨基酸和脂质等。肿瘤细胞亦如此,其具有无限复制的特点(Hanahan et al.,2000),复制增殖过程中需要大量的大分子物质供给,所以肿瘤细胞选择有氧糖酵解这种特殊代谢方式来满足肿瘤细胞增殖需要(Danhier et al.,2017; DeBerardinis et al.,2008;Vander et al.,2009)。
1 有氧糖酵解与肿瘤恶病质
肿瘤恶病质是一组以脂肪、肌肉组织丢失和进行性营养状况恶化为特征的症候群,表现为进行性消瘦、乏力、食欲不振、全身脏器不同程度损害及糖类、脂肪和蛋白质代谢异常等(温宏升 等,2016)。肿瘤恶病质是一种典型的能量平衡失调,能量摄入减少,能量消耗增加。肿瘤生长过程中,肝脏组织中耗能过程——Cori循环过度地激活,导致能量负平衡促使肿瘤恶病质的发生(Koea et al.,1992)。有氧糖酵解是肿瘤发生的因,亦是肿瘤发生的果,有氧糖酵解产生 ATP为肿瘤细胞快速增殖提供能量和大分子物质,其代谢产物乳酸也是导致肿瘤发生、发展以及肿瘤恶病质的“罪魁祸首”,乳酸使肿瘤局部环境酸化,酸性肿瘤微环境有利于肿瘤细胞侵袭周围组织、免疫逃逸、促进肿瘤恶病质发生,同时线粒体也可以氧化乳酸为肿瘤细胞供能,实现肿瘤碳源回收利用。当然,并不是所有的肿瘤细胞的代谢方式都是有氧糖酵解,肿瘤细胞微环境的变化可以使得肿瘤细胞代谢类型重塑,适应环境改变,给肿瘤细胞增殖提供有利的条件(Chen et al.,2008)。研究发现,低氧区域的肿瘤细胞主要是通过糖酵解代谢供能,而富氧区域的肿瘤细胞则是通过线粒体氧化乳酸提供能量(Sonveaux et al.,2008)。
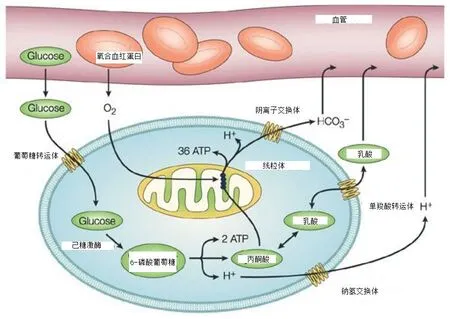
图1 肿瘤细胞代谢类型Figure1. The Metabolism Type of Cancer Cell(Gatenby et al.,2004)
2 有氧糖酵解的细胞信号调控
2.1 致癌基因
致癌基因(oncogenes)是存在于正常细胞内的DNA序列,在正常生理状态下,这段DNA序列不表达或者限制地表达,但发挥着重要的生理作用,一旦受到外界致癌因子(病毒、射线、化学致癌物等)作用,出现超表达,活性突变或者抑癌基因的缺失,成为致癌基因(韩贻仁,1988)。按照原癌基因产物的功能可分为几大类:蛋白激酶类、生长因子类、生长因子受体类、GTP结合蛋白类、核蛋白类和功能未知类。
Myc是存在于大多数组织中促进肿瘤发生的一种强有力的致癌基因,Myc基因家族属于核蛋白类调控基因,其家族成员有 c-Myc、l-Myc、n-Myc等,其中 c-Myc是位于核内的核转录调控因子(吴一飞 等,2008)。已有研究表明,Myc表达是促使肿瘤发生的主要因素,肿瘤发生之后仍需维持 Myc的高表达来促进肿瘤生长(Annibali et al.,2014; Felsher et al.,1999; Shachaf et al.,2004; Soucek et al.,2008)。在有氧条件下丙酮酸经乳酸脱氢酶(LDHA)催化,接受还原性辅酶 I(NADH)上的氢,使丙酮酸还原生成乳酸,并且 LDHA在肿瘤细胞中大量表达。早在1997年,Shim等(1997)研究发现,Rat 1a 成纤维细胞系在 4-HOTM生长基质里培养表达 Myc-ER融合蛋白,Myc-ER融合蛋白诱导LDHA的表达,加入蛋白质抑制剂CHX既没产生抑制作用也没有产生促进作用,此研究表明,Myc直接诱导LDHA表达,在此过程中不需要合成其他的蛋白。c-Myc也可抑制 miR-34a增加 LDHA的表达,从而促进肿瘤有氧糖酵解(Dang,2012)。Myc诱导LDHA的表达,重新编程肿瘤能量代谢促进肿瘤细胞增殖转移。
Src是一种非受体型酪氨酸激酶,属于酪氨酸激酶SRC家族(SFKs)中的成员,大多数 Src家族成员为致癌基因,异常激活的 SFKs可以促进恶性肿瘤细胞增殖、生存、迁移、入侵、血管生成和转移(Elsberger,2014; Kim et al.,2009; Zhang et al.,2012)。Src通过直接或间接的方式上调LDHA活性激活肿瘤有氧糖酵解。Jin等(2017)研究发现,Src磷酸化酪氨酸 10位点激活 LDHA,LDHA磷酸化激活使肿瘤细胞具有侵袭、转移、抗失巢凋亡等的特性。Nam等(2016)研究发现,c-Src结合CD44胞质尾区激活c-Src/Akt/LKB1/AMPKα/HIF-1α信号通路上调 LDHA 促进乳酸产生增加。
Ras基因家族包括三个成员:H-ras、K-ras、N-ras。Ras基因所编码的 Ras蛋白是偶联细胞表面受体与细胞内效应通路之间的传感器,其功能的实现取决于与 GDP或GTP的结合,Ras蛋白主要调节细胞的分化增殖,被称为细胞信号网络传递中的“分子开关”。Ying等(2012)研究发现,iKras p53L/+胰腺导管癌细胞系中抑制 KrasG12D表达使葡萄糖摄取和乳酸产生减少并且下调葡萄糖转运体(Glut1/Slc2a1)和糖酵解途径中的限速酶 HK1、HK2、Pfkl、Ldha表达,此研究提示:Kras可以增加 iKras p53L/+胰腺导管癌细胞糖酵解流。致癌基因 Ras作用于肿瘤代谢重编程主要是通过上调 HIF1α的表达实现,Ras诱导激活MAPK以及PI3K效应通路提高mTOR活性从而上调帽依赖HIF1α翻译(Johannessen et al.,2005; Pylayeva-Gupta et al.,2011)。Ras通过激活 MAPK和 PI3K信号通路上调HIF1α表达,增加葡萄糖摄取和糖酵解途径中酶活性实现肿瘤代谢重编程。
参与调控肿瘤细胞糖酵解的致癌基因除了 Myc、Src、Ras 等,其他致癌基因也共同参与调控肿瘤能量代谢重编程,已有研究发现,丝氨酸/苏氨酸激酶PIM与c-Myc共同协作促进细胞周期进程和肿瘤发生(Li et al.,; Wang et al.,2010; Zippo et al.,2007),PIM 显著性增加 c-Myc和PGC-1α的蛋白水平,抑制 AMPK活性,参与调节糖酵解的酶活性和线粒体生物发生(Beharry et al.,2011)。近期研究发现,沉默ETS-1降低葡萄糖转运体(GLUT1)的表达,减少葡萄糖的利用和乳酸的产生(Zhang et al.,2017)。肿瘤发生过程中多种致癌基因共同作用且发挥致癌作用的机制各不相同,成为彻底攻克肿瘤巨大的阻碍。
2.2 抑癌基因
抑癌基因(anti-oncogenes)是一大类可抑制细胞生长并能潜在抑制癌变作用的基因。抑癌基因的抗癌作用可能是控制细胞分化或者生长,主要涉及到以下机制:去磷酸化,与病毒蛋白质结合,参与细胞间粘着与联系、参与细胞信号转录等(江培洲 等,2001)。转录调节因子P53作为一种抑癌基因,其主要功能是维持线粒体氧化呼吸和糖酵解之间的平衡,肿瘤细胞代谢特点是线粒体氧化呼吸受到抑制,糖酵解功能过度激活,而研究发现,P53的重新激活可以逆转肿瘤细胞 Warburg 效应(Matoba et al.,2006;Zawacka-Pankau et al.,2011),其机制是激活的 P53诱导TIGAR、SCO2、Prakin、GLS2的表达,抑制糖酵解过程,促进有氧呼吸(Bensaad et al.,2006; Hu et al.,2010; Liu et al.,2016; Matoba et al.,2006)。P53也可负调控 PI3K-AktmTOR信号通路,Makinoshima等(2015)研究发现,将EGFR变异肺腺癌细胞暴露在PI3K和mTOR抑制剂中6 h乳酸堆积速率显著性降低。大多数肿瘤相关变异 P53不仅失去了肿瘤抑制功能,反而获得致癌功能,被定义为突变P53癌基因获得功能(GOF),Zhang等(2013)研究表明,变异P53蛋白GOF促进代谢重组,变异P53虽然不影响总GLUT1的表达,但是它通过激活RhoA/ROCK/ GLUT1通路使GLUT1大量转移到细胞膜增加葡萄糖摄取,促进肿瘤Warburg 效应发生。
抑癌基因 PTEN是具有蛋白和脂类磷酸酶活性的双特异性磷酸酯酶,研究发现,丢失PTEN之后下调E3连接酶APC/C-Cdh1的活性,增加了PFKFB3的稳定性以及磷酸果糖激酶(PFK)激活剂果糖-2,6-二磷酸的合成,敲除PTEN的小鼠胚胎成纤维细胞相较于野生型的小鼠胚胎成纤维细胞有更高的果糖-2,6-二磷酸浓度,此研究提示:PTEN丢失促进肿瘤有氧糖酵解发生(Cordero-Espinoza et al.,2013)。
2.3 缺氧诱导因子(HIFs)与有氧糖酵解
HIFs由氧气依赖 HIF-α亚基和氧气不依赖 HIF-β亚基组成的异二聚体蛋白,α亚基有三种同分异构体:HIF-1α、HIF-2α、HIF-3α,β亚基被称为芳基碳氢化合物核受体转运蛋白(ARNT),有两种同分异构体:HIF-1β、HIF-2β(Singh et al.,2017)。HIF-1α是由低氧环境诱导产生的转录因子并且在恶性实体瘤中高度表达。HIF-1α激活的最终结果是提高糖酵解活性和抑制线粒体功能导致肿瘤代谢方式改变。研究发现,西妥昔单抗下调 HIF-1α的表达,LDHA活性和表达受到抑制(Lu et al.,2013)。早在 1995年,Firth(1995)等通过分析小鼠 LDH-A启动子,发现氧气调控功能依靠3个区域共同合作完成,这3个区域分别是 HIF-1结合区域、CRE以及邻近 HIF-1结合区域,此研究表明:HIF-1与LDH-A启动子HIF-1结合区域结合诱导 LDH-A表达。HIF-1α也可上调丙酮酸脱氢酶(PDK)的活性,抑制线粒体氧化磷酸化功能。HIF-1通过与LDH-A启动子HIF-1结合区域结合,促进LDH-A转录,同时抑制线粒体有氧氧化,激活有氧糖酵解过程,丙酮酸、乳酸浓度增加以及 PKM2的表达反馈调节增加 HIF的稳定性(Dong et al.,2015; Semenza,2010)。
致癌基因以及调控因子 HIF共同调控提高肿瘤细胞葡萄糖摄取量和参与糖酵解的酶活性,如 LDH-A等,抑制线粒体氧化呼吸。抑癌基因功能被抑制甚至获得致癌功能,促使肿瘤细胞代谢类型转变为有氧糖酵解为肿瘤细胞增殖提供能量和大分子物质,乳酸大量产生酸化肿瘤微环境,为肿瘤细胞增殖和免疫逃逸提供“温室”环境(图2)。
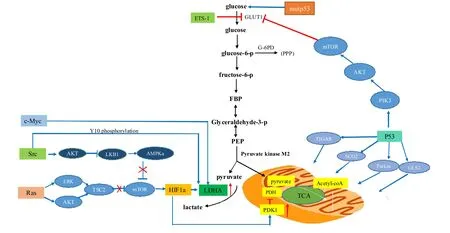
图2 肿瘤有氧糖酵解细胞信号调控Figure2. TheCell Signal Regulation of Aerobic Glycolysis in Tumor
3 有氧糖酵解诱导恶病质的主要途径
3.1 骨骼肌损耗
骨骼肌是人体组成的重要成分,参与人体重要的生理功能,例如:运动、呼吸等。骨骼肌稳态需要蛋白质合成与蛋白质降解这两个过程保持平衡,蛋白质过度降解和蛋白质合成降低导致骨骼肌损耗(skeletal muscle wasting)。骨骼肌损耗是肿瘤恶病质的主要特征之一(Tisdale,2009)。Luo等(2014)研究发现,患有结肠癌的动物肌肉中自噬诱导应激蛋白(HMGB1)表达增加,此蛋白的表达不仅使结肠癌细胞乳酸产生增加,而且还通过降低激活mTOR水平引起肌肉自噬以及自噬相关蛋白的表达增加。同时研究发现,促炎症循环因子聚集导致肌肉中葡萄糖摄取和糖酵解抑制,线粒体氧化磷酸化激活,活性氧和氧化压力的产生增加使蛋白质合成减少分解增加,骨骼肌分解释放的氨基酸用于肿瘤增殖过程所需蛋白质的合成以及通过糖异生途径为肿瘤代谢提供能量,促进肿瘤恶病质发生(Shyh-Chang,2017)。乳酸在炎症与肿瘤恶病质骨骼肌消耗之间起着重要的调控作用。研究发现,在 CaCo-2细胞培养基中加入促炎性细胞因子 TNF-α和 IL-17,使 LDHA表达上调,乳酸产生增加。而抑制 LDHA的表达改善肿瘤炎症状况(Manerba et al.,2017)。免疫细胞和肿瘤分泌的炎性细胞因子直接调控骨骼肌蛋白质稳态,TNF-α和 IL-1通过 NF-κB信号通路和 P38MAPK信号通路上调 E3连接酶的活性,促进骨骼肌蛋白质分解,抑制蛋白质合成(Glass,2010)。综上所述,肿瘤细胞产生的乳酸可能促进骨骼肌消耗,机制是乳酸酸化肿瘤微环境,加重炎症反应,促进骨骼肌蛋白质分解。
3.2 脂肪褐化
在肿瘤恶病质过程中,白色脂肪转变为褐色脂肪,这种现象被称为褐化或棕色脂肪样变性(WAT browning)。解偶联蛋白 1(UCP1)表达增加与脂肪褐化密切相关,UCP1主要在棕色脂肪中表达,其功能是参与棕色脂肪产热调节和能量代谢过程,UCP1过度表达促进脂肪褐化,其机制是UCP1使线粒体呼吸不产生 ATP只产生热量从而促进脂肪动员和能量消耗增加(Petruzzelli et al.,2014)。乳酸不仅是代谢产物更是一个重要的信号分子,研究发现,乳酸不依赖 HIF-1α和 PPARα信号通路而是通过激活 PPARγ信号上调 UCP1表达促进白色脂肪褐化,且在冷刺激条件下脂肪细胞单羧酸转运蛋白 1(MCT1)表达增加(Carriere et al.,2014)。乳酸调节脂肪褐化的机制可能是:乳酸产生增加,改变了细胞内的氧化还原状态,氧化应激增加,诱导UCP1表达,促进白色脂肪棕色化,同时脂肪细胞MCT1过度表达,摄取乳酸进入脂肪细胞线粒体氧化,减轻细胞的氧化应激。
3.3 肝脏-肿瘤 Cori循环
正常人体无氧做功产生乳酸,乳酸随着血液循环到肝脏,通过糖异生途径合成葡萄糖或肝糖原,这个过程称为乳酸循环(lactate cycle)或 Cori循环。超过一半的肿瘤病人都有代谢亢进症状,他们安静能量消耗(REE)远远高于正常人的安静能量消耗(REE)(Bosaeus et al.,2001)。Holroyde等(1975)研究发现,过度消瘦肿瘤病人 Cori循环活性为 90 mg/kg/hr,相对于正常人 Cori循环活性 18 mg/kg/hr,Cori循环活性显著增加,且肿瘤病人总卡路里消耗为 36 kcal/sq m/hr,正常人体的总卡路里消耗为 33 kcal/sq m/hr,此研究提示:患有肿瘤恶病质病人高能量消耗伴随着高速率乳酸糖异生。Cori循环是一个能量消耗的过程,转化2 mol乳酸需要6 molATP,但是葡萄糖转化为乳酸的过程中只产生2 molATP,肝脏与肿瘤之间的Cori循环作为一个无效能量消耗循环过度激活,这一无效腔循环消耗大量机体能量导致不可逆转的肿瘤恶病质发生。
肿瘤生长过程中,肿瘤细胞代谢类型发生改变。肿瘤细胞有氧糖酵解产生的乳酸进入肝脏糖异生生成葡萄糖,葡萄糖又在肿瘤中有氧糖酵解,形成肿瘤与肝脏之间的Cori循环,增加肿瘤患者的能量消耗。乳酸同时也可以改变脂肪细胞的氧化还原状态,诱导 UCP1表达增加,促进白色脂肪褐化,加速脂肪消耗。乳酸释放到肿瘤微环境中,可能加重微环境中的炎症状态,炎性细胞因子如TNFα、IL-1等表达增加促进骨骼肌蛋白质分解(图3)。
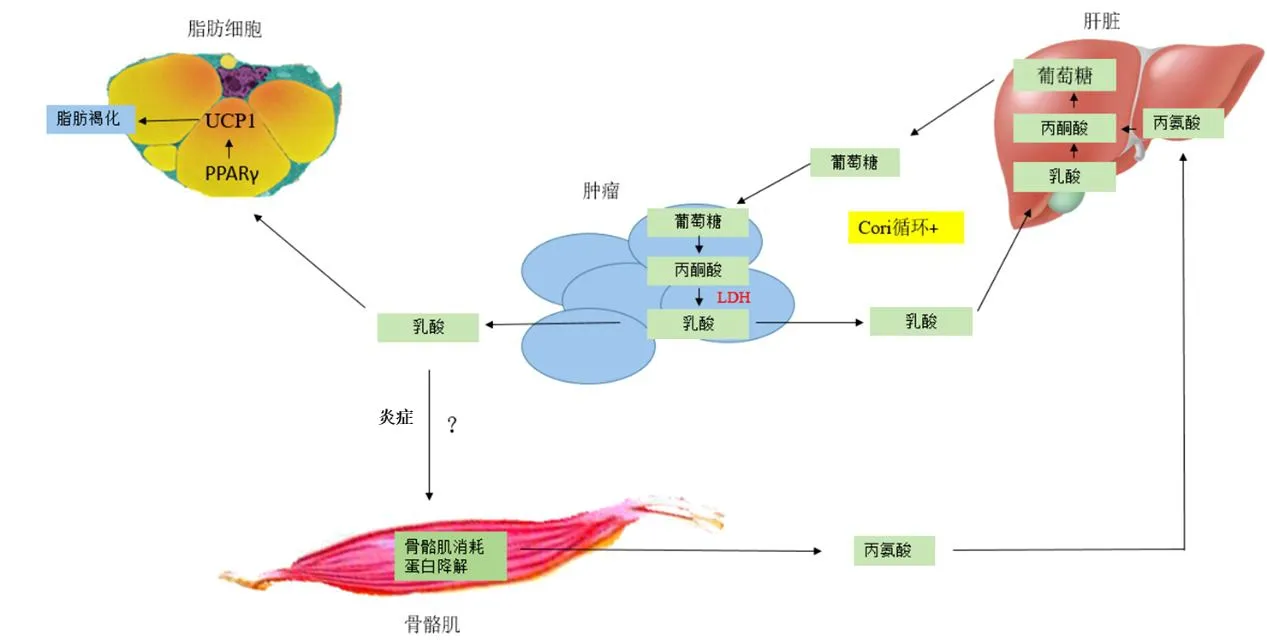
图3 肿瘤乳酸代谢诱导肿瘤恶病质途径Figure 3. The Pathway of Tumor Lactate Metabolism Inducing Tumor Cachexia
4 运动改善肿瘤恶病质的作用及机制
大量的流行病学证据表明,运动与结肠癌、子宫内膜癌和乳腺癌低患病率相关,运动对肺癌,胰腺癌、卵巢癌、前列腺癌、肾癌、胃癌有着明显的预防作用,运动降低患癌症患病率的机制仍不清楚,可能涉及的生物学途径包括胰岛素抵抗、生长因子、细胞因子、激素、免疫功能等(Leitzmann et al.,2015)。运动抗癌机制是复杂的、多靶点的。从表 1中我们可以发现,大多数研究认为运动具有抗肿瘤效应,但是也有少数研究发现,运动不但不能降低肿瘤发生率反而还提高肿瘤发生率,运动干预肿瘤的效果还存在一定的争议,并且不同的运动方式作用于肿瘤恶病质的效果及其机制各不相同。

表1 运动对肿瘤恶病质的防御作用及机制Table 1 The Protective Effects and Mechanisms of Exercise on Cancer Cachexia
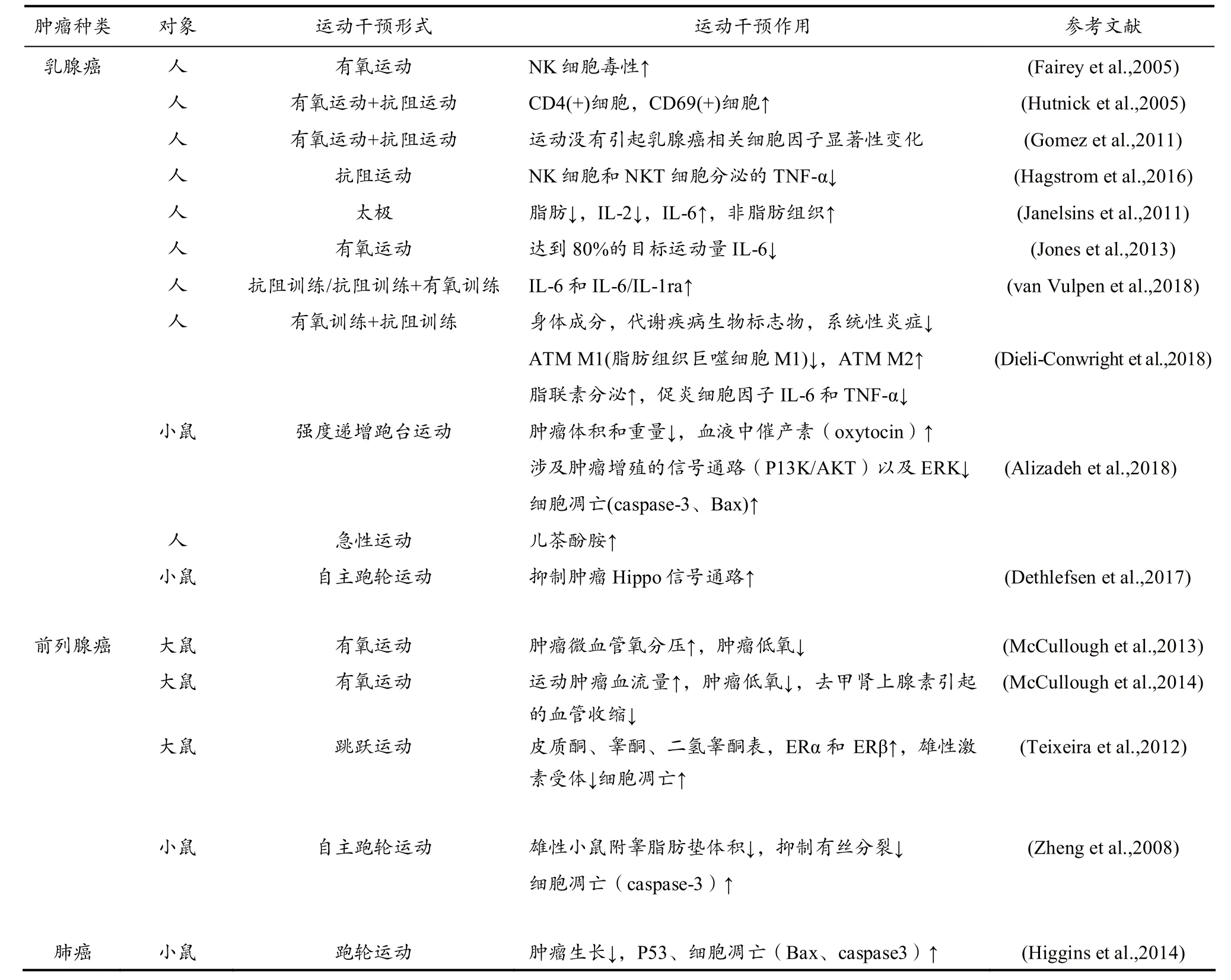
(续表1)
4.1 运动与骨骼肌损耗
人体在运动中骨骼肌蛋白质会发生一定程度的降解,特别是长时间耐力运动需要大量的能量供应,骨骼肌蛋白质降解释放的氨基酸为维持运动提供能量。Lemon等(1980)研究发现,长时间耐力运动时蛋白质分解增加,蛋白质分解代谢供能占总能量的 10.3%。朱荣等(2009)研究发现,一次长时间大强度运动使 MAFbx、MuRF1、C2mRNA表达以及26S蛋白酶体活性增加,骨骼肌UPP活性升高,收缩蛋白降解增加。4周的自主跑轮运动可以使小鼠比目鱼肌中自噬相关因子LC3-Ⅱ、p62、LC3、Atg7、Atg5表达增加(Lira et al.,2013)。而Pigna等(2016)研究发现,自主跑轮运动能够有效地预防结肠癌恶病质导致的小鼠肌肉质量和功能的丢失,提高 C26小鼠生存率,其机制是自主跑轮运动降低Atrogin1和MuRF1基因表达以及自噬相关因子 LC3bⅡ/LC3bⅠ、P62蛋白表达。另外,Hanson等(2013)也发现,力量训练显著性地增加接受雄激素阻断治疗(ADT)的前列腺癌病人肌肉质量和改善肌肉功能。除此之外,运动过程中骨骼肌分泌肌肉因子(Myokines)也起到抑制肿瘤发生的作用。研究发现,规律性低强度运动有效地减少结肠癌小鼠肿瘤异常隐窝病灶(ACF)的形成,促进结肠粘膜细胞凋亡以及裂解形式的caspase-3、caspase-8的表达,这种抗肿瘤效应是由运动过程中骨骼肌分泌的一种新肌肉因子富含半胱氨酸酸性分泌糖蛋白(SPARC)引起(Aoi et al.,2013)。肌肉因子鸢尾素也可以通过抑制NFκB以及激活caspase显著性地减少恶性乳腺癌 MDA-MA-231细胞数量、转移、生存能力(Gannon et al.,2015)。运动本身会引起骨骼肌蛋白质分解,肿瘤个体进行运动干预时反而抑制肿瘤恶病质导致的骨骼肌消耗,维持骨骼肌质量和功能,其原因可能是运动应激引起的骨骼肌蛋白质合成效应大于肿瘤恶病质导致骨骼肌消耗效应,其次相关研究发现,36 h禁食的成年人进行 50%VO2max自行车运动后股外侧肌 LC3bⅡ/LC3bⅠ出现显著性下降(Moller et al.,2015)。肿瘤与其他组织争夺葡萄糖等能源物质导致机体处于轻度低血糖状态,此时加以运动干预可能激发机体保护机制,防止骨骼肌蛋白质过度分解。
4.2 运动与脂肪褐化
白色脂肪褐化在肿瘤恶病质病理过程中扮演着重要的作用,研究发现,肿瘤恶病质病理过程中脂肪褐化发生促进脂肪和骨骼肌消耗(Holmes,2014)。Petruzzelli等(2014)对3周龄无恶病质症状皮肤癌小鼠使用β3肾上腺能受体(β3-AR)拮抗剂治疗 4周,结果表明,与无 β3-AR拮抗剂干预的皮肤癌小鼠相比,皮下白色脂肪UCP1表达水平降低,肿瘤恶病质改善。Kir等(2014)发现,甲状旁腺激素相关蛋白(Parathyroid hormone-like hormone,PTHrP)是调控肿瘤恶病质脂肪褐化的主要信号分子,Lewis肺癌小鼠注射 PTHrP中和抗体后,脂肪和骨骼肌没有出现显著性消耗。由此可见,抑制脂肪褐化已经成为肿瘤恶病质治疗的一个新的靶点。在正常生理状态下,机体为了维持长时间耐力运动进行体内脂肪分解供能,运动诱导存储能量的白色脂肪褐化为产热的米色脂肪增加热量输出。并且研究发现,运动与肿瘤共同代谢分子——乳酸被发现具有诱导白色脂肪褐化作用(Kim et al.,2009)。那么运动是否加剧肿瘤患者体内脂肪褐化和脂肪消耗,促进肿瘤恶病质的发生?此问题尚无准确回答。但是可以肯定的是肿瘤恶病质导致的脂肪褐化与炎症密切相关。高表达 IL-6结肠癌小鼠皮下脂肪UCP1蛋白含量增加,而敲除IL-6受体的 B6黑色素小鼠,白色脂肪萎缩显著性减少,皮下脂肪UCP1蛋白表达极显著性降低(Petruzzelli et al.,2014)。研究发现,体力活动不足与低度系统性炎症相关(Flynn et al.,2007; Daftarian et al.,1996; Petersen et al.,2005)。另外,Dieli-Conwright等(2018)研究发现,运动改善肥胖绝经乳腺癌患者身体系统性炎症,减少脂肪组织巨噬细胞 M1(ATM M1)以及降低IL-6和TNF-α的表达。耐力运动也可以提高 IL-10/TNF-α,改善肿瘤恶病质(Lira et al.,2009)。那么运动是否可以通过降低炎症因子的表达,抑制脂肪褐化发生改善肿瘤恶病质?
4.3 运动与Cori循环
肿瘤细胞代谢重编程以有氧糖酵解供能为主并且肿瘤与肝脏之间的Cori循环过度激活,肿瘤——肝脏的Cori循环虽与骨骼肌——肝脏的 Cori循环机制类似,但是对于机体能量代谢稳态的意义决然不同,正常人体骨骼肌与肝脏之间的 Cori循环有利于乳酸廓清并且为机体提供能量,而肿瘤与肝脏之间的 Cori循环消耗机体大量能量导致不可逆的肿瘤恶病质发生。Holroyde等(1984)研究发现,消瘦的转移性结肠癌病人中存在高速率的葡萄糖生成和 Cori循环的现象。Cori循环的增加消耗肿瘤病人能量大约是300 kcal/天(Eden et al.,1984)。Chlebowski等(1990)研究发现,磷酸烯醇式丙酮酸羧激酶(PEPCK)抑制剂硫酸肼提高非小细胞肺癌病人生存率。运动过程中 Cori循环活性增加,运动是否促进 Cori循环导致肿瘤恶病质发生?Brooks(1986)研究发现,在持续稳定速度的运动中产生的大多数乳酸都被骨骼肌和心肌氧化分解,只有少量乳酸糖异生生成葡萄糖,力竭运动恢复阶段骨骼肌呼吸速率降低,乳酸优先经过糖异生生成葡萄糖,但是实际上这部分葡萄糖几乎作为骨骼肌和心肌糖原的合成前体。同时Aveseh等(2015)研究发现,耐力运动抑制 ERRα减少MCT1伴侣 basigin以及 LDHA的表达,增加实体瘤的LDHB表达从而抑制肿瘤乳酸代谢。运动抗肿瘤的机制可能是:运动打破肿瘤异常的 Cori循环,运动过程中以及运动结束恢复阶段骨骼肌、心肌和脑与肿瘤抢夺能源物质,抑制肿瘤与肝脏之间Cori循环从而减少肿瘤能量消耗。
5 小结
运动过程中人体机能通过提高肺通气量、脂肪分解、骨骼肌蛋白质分解和 Cori循环活性等方式来满足运动过程中能量需求,其中乳酸是运动产生的最直接产物,乳酸堆积增加反映运动机体的代谢方式向糖酵解切换。肿瘤倾向于有氧糖酵解,与运动效应近似的是,肿瘤恶病质表现为骨骼肌损耗、脂肪消耗和褐化以及 Cori循环过度激活。尽管有积极证据表明运动的抗肿瘤效益,但是运动的抗肿瘤作用和机制将面临三大矛盾:运动是否加剧骨骼肌损耗?运动是否加剧脂肪消耗和褐化?运动是否加剧肿瘤患者Cori循环?运动引起的脂肪消耗、骨骼肌蛋白质分解和Cori循环增强与肿瘤恶病质导致的脂肪消耗、骨骼肌蛋白质分解和 Cori循环活性增强对于人体的意义完全不同,运动过程中参与运动的器官需要大量的能源物质,可能剥夺肿瘤的能源供给,运动后机体恢复带来积极效应也可能改善肿瘤恶病质,但是这些问题尚无明确回答。本文对上述问题提出的若干假设值得我们进一步研究探讨。
韩贻仁,1988.分子细胞生物学[M].北京:高等教育出版社.
江培洲,沈新明,黄华,2001.癌基因与抑癌基因的表达研究进展[J].国外医学(肿瘤学分册),28(2):89-92.
温宏升,阎飞,秦贤举,2016.癌症恶病质发病机制与治疗研究进展[J].医学综述,22(4):722-725.
吴一飞,李灼日,2008.原癌基因 c-myc与恶性肿瘤[J].医学临床研究,25 (9):1698-1700.
朱荣,2009.运动对骨骼肌泛素蛋白酶体途径活性的影响及机制[D].北京:北京体育大学.
ALIZADEH A M, HEYDARI Z, RAHIMI M, et al., 2018. Oxytocin mediates the beneficial effects of the exercise training on breast cancer[J]. Exp Physiol, 103(2): 222-235.
ANNIBALI D, WHITFIELD J R, FAVUZZI E, et al., 2014. Myc inhibition is effective against glioma and reveals a role for Myc in proficient mitosis[J]. Nat Commun, 5: 4632.
AOI W, NAITO Y, TAKAGI T, et al., 2013. A novel myokine,secreted protein acidic and rich in cysteine (SPARC), suppresses colon tumorigenesis via regular exercise[J]. Gut, 62(6): 882-889.
AVESEH M, NIKOOIE R, AMINAIE M, 2015. Exercise-induced changes in tumour LDH-B and MCT1 expression are modulated by oestrogen-related receptor alpha in breast cancer-bearing BALB/c mice[J]. J Physiol, 593(12): 2635-2648.
BEHARRY Z, MAHAJAN S, ZEMSKOVA M, et al., 2011. The Pim protein kinases regulate energy metabolism and cell growth[J]. Proc Natl Acad Sci U S A, 108(2): 528-533.
BENSAAD K, TSURUTA A, SELAK M A, et al., 2006. TIGAR, a p53-inducible regulator of glycolysis and apoptosis[J]. Cell, 126(1):107-120.
BOSAEUS I, DANERYD P, SVANBERG E, et al., 2001. Dietary intake and resting energy expenditure in relation to weight loss in unselected cancer patients[J]. Int J Cancer, 93(3): 380-383.
BROOKS G A, 1986. The lactate shuttle during exercise and recovery[J]. Med Sci Sports Exerc, 18(3): 360-368.
BROWN J C, RICKELS M R, TROXEL A B, et al., 2018. Doseresponse effects of exercise on insulin among colon cancer survivors[J]. Endocr Relat Cancer, 25(1): 11-19.
CARRIERE A, JEANSON Y, BERGER-MULLER S, et al., 2014.Browning of white adipose cells by intermediate metabolites: An adaptive mechanism to alleviate redox pressure[J]. Diabetes, 63(10):3253-3265.
CHEN J L, LUCAS J E, SCHROEDER T, et al., 2008. The genomic analysis of lactic acidosis and acidosis response in human cancers[J].PLoS Genet, 4(12): e1000293.
CHLEBOWSKI R T, BULCAVAGE L, GROSVENOR M, et al., 1990.Hydrazine sulfate influence on nutritional status and survival in nonsmall-cell lung cancer[J]. J Clin Oncol, 8(1): 9-15.
CORDERO-ESPINOZA L, HAGEN T, 2013. Increased concentrations of fructose 2,6-bisphosphate contribute to the Warburg effect in phosphatase and tensin homolog (PTEN)-deficient cells[J]. J Biol Chem, 288(50): 36020-36028.
DAFTARIAN P M, KUMAR A, KRYWORUCHKO M, et al., 1996.IL-10 production is enhanced in human T cells by IL-12 and IL-6 and in monocytes by tumor necrosis factor-alpha[J]. J Immunol,157(1): 12-20.
DANG C V, 2012. MYC on the path to cancer[J]. Cell, 149(1): 22-35.
DANHIER P, BANSKI P, PAYEN V L, et al., 2017. Cancer metabolism in space and time: Beyond the Warburg effect[J].Biochim Biophys Acta Bioenerg, 1858(8): 556-572.
DAS N W, ALVES C R, DE ALMEIDA N R, et al., 2016. Loss of strength capacity is associated with mortality, but resistance exercise training promotes only modest effects during cachexia progression[J].Life Sci, 163: 11-22.
DEBERARDINIS R J, LUM J J, HATZIVASSILIOU G, et al., 2008.The biology of cancer: Metabolic reprogramming fuels cell growth and proliferation[J]. Cell Metab, 7(1): 11-20.
DETHLEFSEN C, HANSEN L S, LILLELUND C, et al., 2017.Exercise-Induced catecholamines activate the hippo tumor suppressor pathway to reduce risks of breast cancer development[J].Cancer Res, 77(18): 4894-4904.
DEUSTER P A, MORRISON S D, AHRENS R A, 1985. Endurance exercise modifies cachexia of tumor growth in rats[J]. Med Sci Sports Exerc, 17(3): 385-392.
DIELI-CONWRIGHT C M, PARMENTIER J H, SAMI N, et al., 2018.Adipose tissue inflammation in breast cancer survivors: Effects of a 16-week combined aerobic and resistance exercise training intervention[J]. Breast Cancer Res Treat, 168(1): 147-157.
DONG T, YAN Y, CHAI H, et al., 2015. Pyruvate kinase M2 affects liver cancer cell behavior through up-regulation of HIF-1alpha and Bcl-xL in culture[J]. Biomed Pharmacother, 69: 277-284.
EDEN E, EDSTROM S, BENNEGARD K, et al., 1984. Glucose flux in relation to energy expenditure in malnourished patients with and without cancer during periods of fasting and feeding[J]. Cancer Res,44(4): 1718-1724.
ELSBERGER B, 2014. Translational evidence on the role of Src kinase and activated Src kinase in invasive breast cancer[J]. Crit Rev Oncol Hematol, 89(3): 343-351.
FAIREY A S, COURNEYA K S, FIELD C J, et al., 2005. Randomized controlled trial of exercise and blood immune function in postmenopausal breast cancer survivors[J]. J Appl Physiol (1985),98(4): 1534-1540.
FELSHER D W, BISHOP J M, 1999. Reversible tumorigenesis by MYC in hematopoietic lineages[J]. Mol Cell, 4(2): 199-207.
FIRTH J D, EBERT B L, RATCLIFFE P J, 1995. Hypoxic regulation of lactate dehydrogenase A. Interaction between hypoxia-inducible factor 1 and cAMP response elements[J]. J Biol Chem, 270(36):21021-21027.
FLYNN M G, MCFARLIN B K, MARKOFSKI M M, 2007. The antiinflammatory actions of exercise training.[J]. Am J Lifestyle Med,1(3): 220-235.
GANNON N P, VAUGHAN R A, GARCIA-SMITH R, et al., 2015.Effects of the exercise-inducible myokine irisin on malignant and non-malignant breast epithelial cell behavior in vitro[J]. Int J Cancer,136(4): E197-E202.
GATENBY R A, GILLIES R J, 2004. Why do cancers have high aerobic glycolysis?[J]. Nat Rev Cancer, 4(11): 891-899.
GLASS D J, 2010. Signaling pathways perturbing muscle mass[J]. Curr Opin Clin Nutr Metab Care, 13(3): 225-229.
GOMEZ A M, MARTINEZ C, FIUZA-LUCES C, et al., 2011.Exercise training and cytokines in breast cancer survivors[J]. Int J Sports Med, 32(6): 461-467.
HAGSTROM A D, MARSHALL P W, LONSDALE C, et al., 2016.The effect of resistance training on markers of immune function and inflammation in previously sedentary women recovering from breast cancer: A randomized controlled trial[J]. Breast Cancer Res Treat,155(3): 471-482.
HANAHAN D, WEINBERG R A, 2000. The hallmarks of cancer[J].Cell, 100(1): 57-70.
HANSON E D, SHEAFF A K, SOOD S, et al., 2013. Strength training induces muscle hypertrophy and functional gains in black prostate cancer patients despite androgen deprivation therapy[J]. J Gerontol A Biol Sci Med Sci, 68(4): 490-498.
HIGGINS K A, PARK D, LEE G Y, et al., 2014. Exercise-induced lung cancer regression: mechanistic findings from a mouse model[J].Cancer, 120(21): 3302-3310.
HOLMES D, 2014. Metabolism: WAT browning--key feature of cancer-associated cachexia[J]. Nat Rev Endocrinol, 10(10): 578.
HOLROYDE C P, GABUZDA T G, PUTNAM R C, et al., 1975.Altered glucose metabolism in metastatic carcinoma[J]. Cancer Res,35(12): 3710-3714.
HOLROYDE C P, SKUTCHES C L, BODEN G, et al., 1984. Glucose metabolism in cachectic patients with colorectal cancer[J]. Cancer Res, 44(12 Pt 1): 5910-5913.
HU W, ZHANG C, WU R, et al., 2010. Glutaminase 2, a novel p53 target gene regulating energy metabolism and antioxidant function[J].Proc Natl Acad Sci U S A, 107(16): 7455-7460.
HUTNICK N A, WILLIAMS N I, KRAEMER W J, et al., 2005.Exercise and lymphocyte activation following chemotherapy for breast cancer[J]. Med Sci Sports Exerc, 37(11): 1827-1835.
JANELSINS M C, DAVIS P G, WIDEMAN L, et al., 2011. Effects of Tai Chi Chuan on insulin and cytokine levels in a randomized controlled pilot study on breast cancer survivors[J]. Clin Breast Cancer, 11(3): 161-170.
JIN L, CHUN J, PAN C, et al., 2017. Phosphorylation-mediated activation of LDHA promotes cancer cell invasion and tumour metastasis[J]. Oncogene, 36(27): 3797-3806.
JOHANNESSEN C M, RECZEK E E, JAMES M F, et al., 2005. The NF1 tumor suppressor critically regulates TSC2 and mTOR[J]. Proc Natl Acad Sci U S A, 102(24): 8573-8578.
JONES S B, THOMAS G A, HESSELSWEET S D, et al., 2013. Effect of exercise on markers of inflammation in breast cancer survivors:The Yale exercise and survivorship study[J]. Cancer Prev Res (Phila),6(2): 109-118.
KIM L C, SONG L, HAURA E B, 2009. Src kinases as therapeutic targets for cancer[J]. Nat Rev Clin Oncol, 6(10): 587-595.
KIR S, WHITE J P, KLEINER S, et al., 2014. Tumour-derived PTH-related protein triggers adipose tissue browning and cancer cachexia[J]. Nature, 513(7516): 100.
KOEA J B, SHAW J H, 1992. The effect of tumor bulk on the metabolic response to cancer[J]. Ann Surg, 215(3): 282-288.
KOPPENOL W H, BOUNDS P L, DANG C V, 2011. Otto Warburg's contributions to current concepts of cancer metabolism[J]. Nat Rev Cancer, 11(5): 325-337.
LEE M K, KIM J Y, KIM D I, et al., 2017. Effect of home-based exercise intervention on fasting insulin and Adipocytokines in colorectal cancer survivors: A randomized controlled trial[J].Metabolism, 76: 23-31.
LEITZMANN M, POWERS H, ANDERSON A S, et al., 2015.European Code against Cancer 4th Edition: Physical activity and cancer[J]. Cancer Epidemiol, 39 Suppl 1: S46-S55.
LEMON P W, MULLIN J P, 1980. Effect of initial muscle glycogen levels on protein catabolism during exercise[J]. J Appl Physiol Respir Environ Exerc Physiol, 48(4): 624-629.
LI Y Y, POPIVANOVA B K, NAGAI Y, et al., 2006. Pim-3, a protooncogene with serine/threonine kinase activity, is aberrantly expressed in human pancreatic cancer and phosphorylates bad to block bad-mediated apoptosis in human pancreatic cancer cell lines[J]. Cancer Res, 66(13): 6741-6747.
LIRA F S, ROSA J C, ZANCHI N E, et al., 2009. Regulation of inflammation in the adipose tissue in cancer cachexia: effect of exercise[J]. Cell Biochem Funct, 27(2): 71-75.
LIRA V A, OKUTSU M, ZHANG M, et al., 2013. Autophagy is required for exercise training-induced skeletal muscle adaptation and improvement of physical performance[J]. FASEB J, 27(10): 4184-4193.
LIU K, LI F, HAN H, et al., 2016. Parkin regulates the activity of pyruvate kinase M2[J]. J Biol Chem, 291(19): 10307-10317.
LU H, LI X, LUO Z, et al., 2013. Cetuximab reverses the Warburg effect by inhibiting HIF-1-regulated LDH-A[J]. Mol Cancer Ther,12(10): 2187-2199.
LUO Y, YONEDA J, OHMORI H, et al., 2014. Cancer usurps skeletal muscle as an energy repository[J]. Cancer Res, 74(1): 330-340.
MAKINOSHIMA H, TAKITA M, SARUWATARI K, et al., 2015.Signaling through the phosphatidylinositol 3-kinase (PI3K)/mammalian target of rapamycin (mTOR) axis is responsible for aerobic glycolysis mediated by glucose transporter in epidermal growth factor receptor (EGFR)-mutated lung adenocarcinoma[J]. J Biol Chem, 290(28): 17495-17504.
MANERBA M, Di IANNI L, GOVONI M, et al., 2017. Lactate dehydrogenase inhibitors can reverse inflammation induced changes in colon cancer cells[J]. Eur J Pharm Sci, 96: 37-44.
MATOBA S, KANG J G, PATINO W D, et al., 2006. p53 regulates mitochondrial respiration[J]. Science, 312(5780): 1650-1653.
MATSUO K, SATO K, SUEMOTO K, et al., 2017. A mechanism underlying preventive effect of high-intensity training on colon cancer[J]. Med Sci Sports Exerc, 49(9): 1805-1816.
MCCULLOUGH D J, NGUYEN L M, SIEMANN D W, et al., 2013.Effects of exercise training on tumor hypoxia and vascular function in the rodent preclinical orthotopic prostate cancer model[J]. J Appl Physiol (1985), 115(12): 1846-1854.
MCCULLOUGH D J, STABLEY J N, SIEMANN D W, et al., 2014.Modulation of blood flow, hypoxia, and vascular function in orthotopic prostate tumors during exercise[J]. J Natl Cancer Inst, 106(4): u36.
MOLLER A B, VENDELBO M H, CHRISTENSEN B, et al., 2015.Physical exercise increases autophagic signaling through ULK1 in human skeletal muscle[J]. J Appl Physiol (1985), 118(8): 971-979.
NAM K, OH S, SHIN I, 2016. Ablation of CD44 induces glycolysis-tooxidative phosphorylation transition via modulation of the c-Src-Akt-LKB1-AMPKalpha pathway[J]. Biochem J, 473(19): 3013-3030.
PETERSEN A M, PEDERSEN B K, 2005. The anti-inflammatory effect of exercise[J]. J Appl Physiol (1985), 98(4): 1154-1162.
PETRUZZELLI M, SCHWEIGER M, SCHREIBER R, et al., 2014. A switch from white to brown fat increases energy expenditure in cancer-associated cachexia[J]. Cell Metab, 20(3): 433-447.
PIGNA E, BERARDI E, AULINO P, et al., 2016. Aerobic exercise and pharmacological treatments counteract cachexia by modulating autophagy in colon Cancer[J]. Sci Rep, 6: 26991.
PIGUET A C, SARAN U, SIMILLION C, et al., 2015. Regular exercise decreases liver tumors development in hepatocyte-specific PTEN-deficient mice independently of steatosis[J]. J Hepatol, 62(6):1296-1303.
PUPPA M J, WHITE J P, VELAZQUEZ K T, et al., 2012. The effect of exercise on IL-6-induced cachexia in the Apc ( Min/+) mouse[J]. J Cachexia Sarcopenia Muscle, 3(2): 117-137.
PYLAYEVA-GUPTA Y, GRABOCKA E, BAR-SAGI D, 2011. RAS oncogenes: Weaving a tumorigenic web[J]. Nat Rev Cancer, 11(11):761-774.
SARAN U, GUARINO M, RODRIGUEZ S, et al., 2018. Anti-tumoral effects of exercise on hepatocellular carcinoma growth[J]. Hepatol Commun, 2(5): 607-620.
SEMENZA G L, 2010. HIF-1: Upstream and downstream of cancer metabolism[J]. Curr Opin Genet Dev, 20(1): 51-56.
SHACHAF C M, KOPELMAN A M, ARVANITIS C, et al., 2004.MYC inactivation uncovers pluripotent differentiation and tumour dormancy in hepatocellular cancer[J]. Nature, 431(7012): 1112-1117.SHIM H, DOLDE C, LEWIS B C, et al., 1997. c-Myc transactivation of LDH-A: Implications for tumor metabolism and growth[J]. Proc Natl Acad Sci U S A, 94(13): 6658-6663.
SHYH-CHANG N, 2017. Metabolic changes during cancer cachexia pathogenesis[J]. Adv Exp Med Biol, 1026: 233-249.
SIMONNET H, ALAZARD N, PFEIFFER K, et al., 2002. Low mitochondrial respiratory chain content correlates with tumor aggressiveness in renal cell carcinoma[J]. Carcinogenesis, 23(5): 759-768.
SINGH D, ARORA R, KAUR P, et al., 2017. Overexpression of hypoxia-inducible factor and metabolic pathways: Possible targets of cancer[J]. Cell Biosci, 7: 62.
SONVEAUX P, VEGRAN F, SCHROEDER T, et al., 2008. Targeting lactate-fueled respiration selectively kills hypoxic tumor cells in mice[J]. J Clin Invest, 118(12): 3930-3942.
SOUCEK L, WHITFIELD J, MARTINS C P, et al., 2008.Modelling Myc inhibition as a cancer therapy[J]. Nature,455(7213): 679-683.
TEIXEIRA G R, FAVARO W J, PINHEIRO P F, et al., 2012. Physical exercise on the rat ventral prostate: Steroid hormone receptors,apoptosis and cell proliferation[J]. Scand J Med Sci Sports, 22(5):e86-e92.
TISDALE M J, 2009. Mechanisms of cancer cachexia[J]. Physiol Rev,89(2): 381-410.
VAN VULPEN J K, SCHMIDT M E, VELTHUIS M J, et al., 2018.Effects of physical exercise on markers of inflammation in breast cancer patients during adjuvant chemotherapy[J]. Breast Cancer Res Treat, 168(2): 421-431.
VANDER H M, CANTLEY L C, THOMPSON C B, 2009.Understanding the Warburg effect: The metabolic requirements of cell proliferation[J]. Science, 324(5930): 1029-1033.
VAUPEL P, OKUNIEFF P, NEURINGER L J, 1989. Blood flow,tissue oxygenation, pH distribution, and energy metabolism of murine mammary adenocarcinomas during growth[J]. Adv Exp Med Biol, 248: 835-845.
WANG J, KIM J, ROH M, et al., 2010. Pim1 kinase synergizes with c-MYC to induce advanced prostate carcinoma[J]. Oncogene, 29(17):2477-2487.
WARBURG O, 1956. On the origin of cancer cells[J]. Science,123(3191): 309-314.
YING H, KIMMELMAN A C, LYSSIOTIS C A, et al., 2012.Oncogenic Kras maintains pancreatic tumors through regulation of anabolic glucose metabolism[J]. Cell, 149(3): 656-670.
ZAWACKA-PANKAU J, GRINKEVICH V V, HUNTEN S, et al.,2011. Inhibition of glycolytic enzymes mediated by pharmacologically activated p53: Targeting Warburg effect to fight cancer[J]. J Biol Chem, 286(48): 41600-41615.
ZHANG C, LIU J, LIANG Y, et al., 2013. Tumour-associated mutant p53 drives the Warburg effect[J]. Nat Commun, 4: 2935.
ZHANG S, YU D, 2012. Targeting Src family kinases in anti-cancer therapies: Turning promise into triumph[J]. Trends Pharmacol Sci,33(3): 122-128.
ZHANG X, WU D, ALDAROUISH M, et al., 2017. ETS-1: A potential target of glycolysis for metabolic therapy by regulating glucose metabolism in pancreatic cancer[J]. Int J Oncol, 50(1): 232-240.
ZHENG X, CUI X X, HUANG M T, et al., 2008. Inhibitory effect of voluntary running wheel exercise on the growth of human pancreatic Panc-1 and prostate PC-3 xenograft tumors in immunodeficient mice[J]. Oncol Rep, 19(6): 1583-1588.
ZIPPO A, De ROBERTIS A, SERAFINI R, et al., 2007. PIM1-dependent phosphorylation of histone H3 at serine 10 is required for MYC-dependent transcriptional activation and oncogenic transformation[J]. Nat Cell Biol, 9(8): 932-944.
