有氧运动通过TLR4/miR-223/NLRP3信号通路轴介导CUMS抑郁小鼠海马炎症反应
2019-03-14屈红林陈嘉勤刘瑞莲汤长发陈伊琳
屈红林,谢 军,陈嘉勤,刘瑞莲,汤长发,陈伊琳,陈 伟,李 娣,彭 琪,陈 锐
(1.湖南师范大学 体育学院 湖南省体适能与运动康复重点实验室,湖南 长沙420012;2.宜春学院 体育科学研究所,江西 宜春336000)
抑郁症(Depression)是一种与脑内海马调控情绪与心境障碍密切相关的炎症性疾病,表现为长时间的情绪低落和典型的“三高三低”(高患病率、高致残率、高复发率和低检出率、低就诊率、低治愈率),严重者可导致自杀或扩大性自杀,已成为21世纪人类的主要杀手和困扰全球最为严重的健康问题(Solhaug et al.,2012)。前期研究发现,海马组织炎症作用在抑郁症的进程中起至关重要的作用(屈红林 等,2008,2018)。核苷酸结合寡聚化结构域样受体蛋白3(Nucleotide-binding oligomerization domain like protein 3,NLRP3)炎性体是介导人体固有免疫的重要蛋白,是炎性体组成的核心成分,在许多疾病的炎症反应过程中发挥重要作用。NLRP3可通过识别相关分子模式,结合配体被激活,诱导NLRP3炎性体的组装,促使pro-caspase1蛋白发生自身蛋白水解切割成具有生物活性的半胱氨酸天冬酰胺特异蛋白酶-1(Caspase-1),促使下游的(Interleukin,IL)IL-1β和IL-18前体成熟,生成具有生物活性的IL-1β和IL-18(吴雨卉 等,2018; Man et al.,2015),分泌至胞外,发挥炎性效应(He et al.,2015),参与多种炎症疾病的发病过程(张涛 等,2015; Xu et al.,2016)。TLR4参与抑郁症的炎症过程已经得到证实(Yan et al.,2011; Cheng et al.,2016),其可通过增加 NLRP3和 Pro-IL-1β的表达诱发炎性体(Latz et al.,2013)。然而,TLR4/NLRP3在海马组织中的作用及其与抑郁症的潜在关系是否参与抑郁症的发病过程,仍未得到充分的证实(甄凤亚 等,2017; Mcneela et al.,2010)。
miRNA是内源基因编码长度约为 18~24个核苷酸的非编码单链小RNA(Camkurt et al.,2017),主要在转录后基因表达的调控中发挥重要作用,被称为细胞过程的“主要调节因子”(Sun et al.,2010)。现已有多种miRNAs在抑郁症的研究中显示出生物标志物的多潜能性,其中,miR-223就是最主要的 miRNAs之一(Camkurt et al.,2015)。尽管TLR信号传导调控miRNA已经得到很好的证实,NLRP3可由TLR诱导,但miRNA是否参与到NLR蛋白及其炎性体的调控过程?Haneklaus等(2012)的研究发现,miR-223的过表达可通过靶向 NLRP3的 3’-非翻译区(UTR)的保守结合位点病毒阻止 NLRP3表达,转化为降低 NLRP3炎性体活性,限制炎性体激活,抑制炎性体中 IL-1β等的产生。Yang等(2015)的研究也验证了 miR-223可下调NLRP3,并通过Caspase-1和IL-1β抑制炎症反应,改善脑神经功能,并提出 miR-223有可能成为一种降低炎症反应的新靶点。Bauernfeind等(2012)考虑到miR-223作为NLRP3炎性体信息转录控制的关键调节因子,将 miR-223作为控制NLRP3炎性体活性的重要“变阻器”。Wang等(2014)的研究也显示,miR-223除了调控NLRP3等炎性相关靶点因子外,还靶向作用于NF-κB激活剂、TNF-a受体及配体以及干扰素调节因子(IRF4)等,靶向调节炎症反应。Camkurt等(2015)对50名抑郁症患者和41名健康人的研究显示,miR-223在抑郁症患者外周血中的表达显著高于正常人,呈显著性差异。以上研究虽然报道了miR-223通过下调 NLRP3参与炎症调控,抑制炎性因子的差异表达,在多数炎症疾病中发挥作用,但针对该调控机制在抑郁症患者方面的研究报道并不多见,尤其是在海马组织细胞中通过什么样的途径调节 NLRP3的表达,以及经miR-223调控后的稳定性等,知之甚少。
适当的有氧运动能够改善机体的抗炎能力,其功能涉及多种病理生理过程,如改善胰岛素抵抗(吴秀琴 等,2016;刘敏 等,2015),减轻动脉粥样硬化(吴卫东 等,2016),降低心肌组织抑炎因子(李红叶,2017),改善代谢综合征炎症反应(王卉 等,2017),抗骨性关节炎(高丕明 等,2015),促进阻塞性黄疸致肝损伤修复(郭音 等,2017)等。值得注意的是,新近的研究表明,有氧运动在各种神经退行性疾病,包括老年痴呆(含阿尔茨海默病)(唐茂婷 等,2017;李小龙,2016)、帕金森病(Afshari et al.,2017;Playford,2011;Subramanian,2017)、慢性脑缺血(陈伟 等,2017)、大鼠海马 Aβ沉淀(张宪亮,2016)、脑卒中(温如武 等,2018)等起着重要的抗炎效果。杜杰等(2017)证明,间歇和连续的有氧运动可在一定程度上抑制 IKKβ/NF-κB炎症通路的转导,调节炎症因子的分泌,改善机体炎症反应。周期性、中低强度的有氧运动有助于降低糖尿病患者炎症因子Chemerin水平(林小晶 等,2017)。戈含笑等(2017)的研究发现,有氧运动可通过调节血清皮质酮的表达降低海马内前炎性因子的释放,还可激活 CREB、BDNF及 ERK等信号蛋白的表达,提高神经营养作用,保护神经免受损伤,增加神经可塑性和神经发生来发挥抗抑郁作用。董秀娟等(2017)研究提示,跑台运动可通过下调 miR-483对IGF2表达增强的调控作用,有效促进海马神经元的存活,改善学习记忆功能。近期的一项研究表明,游泳运动通过诱导炎症/IDO通路的激活,抑制脑内的炎症反应改善抑郁症状(Liu et al.,2013)。Radomaizik等(2010)的研究发现,运动不仅会刺激中性粒细胞中的基因表达,还会通过miRNA调节蛋白质翻译和细胞功能影响细胞的稳态过程,尤其是运动会诱导 miR-223的表达水平增加,并负调节祖细胞增殖与粒细胞分化等过程,发挥抗炎作用。虽然这些研究表明,有氧运动可能通过调节海马组织中的炎性信号通道的抗炎和/或促炎作用在抑郁症的发病过程中发挥作用,但运动能否通过干预和调控miRNA与炎性细胞因子间的相互作用参与抑郁症的病理过程,尤其是 TLR4/miR-223/NLRP3信号通路轴在运动干预抑郁症方面发挥怎么样的调控作用,此类相关研究鲜见实验报道。本课题组首先对造模效果进行了评定,然后进行海马组织的 miRNA与mRNA的高通量测序及关联分析,结果显示,TLR4/NLRP3与 miR-223间存在一定的相关性,且这种关系与有氧运动的干预高度相关,为此,课题组以炎性信号通道TLR4/NLRP3与 miR-223间的相互关系拟定实验研究方案,并采用免疫组化、Western Blot和RT-qPCR等方法予以验证。
1 材料与方法
1.1 主要仪器与试剂
主要试剂:DAB显色试剂盒购于武汉博士德生物工程有限公司,生化试剂购于鋆 大生物科技(上海)有限公司、Trizol购于 Inventragtion,ELISA进口试剂盒、反转录试剂盒购于 TAKARA、兔抗多克隆抗体 IL-1β、IL-10、NF-κB、TLR4等购于 ABclonal,mRNA引物由生工生物工程(上海)股份有限公司设计合成、miR-223引物由Ribobio设计与合成、TLR4的抑制剂TAK-242购自MedChemExpress。
主要仪器:BM-Ⅱ型病理组织包埋机、YT-6C生物组织摊烤片机、LEICA RM2126轮转式切片机、DHG9000烘烤箱、Bio-Rad电泳仪和转移槽、Tanon Multi凝胶成像系统、CKX31奥林巴斯倒置显微镜、Microfuge低温高速离心机、T10 Basic高速组织匀浆机、ThermoFisher酶标仪、Biorad CFX96Touch PCR仪、Q5000超微量分光光度计等。
1.2 实验动物及CUMS抑郁小鼠模型构建
实验动物及分组:C57BL/6小鼠(20±3 g,雄性,8周龄)60只,由湖南斯莱克景达实验动物有限公司提供(许可证号:SCXK湘 2016-0002),所有小鼠饲养在标准的动物房(温度 22℃±1℃,湿度 55%±5%),自由饮水和进食,实验处理取材前12 h禁食过夜。将小鼠随机分为空白对照组(CG)、模型对照组(MG)、模型运动组(ME)、TLR4抑制剂组(TG)、TLR4抑制剂+运动组(TE),共5组,12只/组。
慢性不可预见性应激(CUMS)抑郁小鼠模型制备:除空白对照组外的其余小鼠,按照 13种慢性应激刺激因子(昼夜调整、光照性质改变、禁食、禁水、噪音、倾斜鼠笼、潮湿垫料、束缚、水平震荡、冰水游泳、高温游泳、轻夹鼠尾、间断闪光刺激),进行为期28天的慢性应激性刺激造模(洪灯 等,2011)。13种慢性应激刺激因子按照随机数字法生成28天的慢性应激性刺激方案,每天刺激1~2种,为防止小鼠产生适应反应,确保相邻两天实施不同的刺激。
1.3 TLR4抑制剂及其模型制备
借鉴文献资料,实验选取 TAK-242作为 TLR4的抑制剂。造模成功后的TG组和TE组小鼠借鉴夏晓爽等(2016)的实验剂量0.3 mg/kg体重进行腹腔注射,5次/周,共4周。
1.4 CUMS抑郁小鼠运动方案
造模后的ME组和TE组小鼠实施中等强度的有氧跑台运动刺激,借鉴 Bedford(1979)运动方案进行改良,即按照跑台坡度0°,速度为10 m/min,第1周进行递增负荷的适应性训练,按照每天递增10 min,共训练6天,第2周开始正式训练10 m/min,60 min/天,6 天/周,连续训练8周,所有的训练均安排在9:00—11:30进行。
1.5 CUMS抑郁小鼠神经行为学评定结果
为评价 CUMS抑郁造模与运动干预效果,本研究针对实验小鼠进行了强迫游泳、强迫悬尾、糖水偏好等神经行为学评定。
强迫游泳:将受试小鼠放入装有温水(25℃±1℃)的圆形烧杯,直径10 cm,水深10 cm,ANC酷睿HD1080P高清摄像头记录小鼠6 min内不动状态潜伏期和后4 min内不动状态持续时间。
强迫悬尾:采用悬尾箱、周壁及底部均为黑色,箱体顶部由25 W白炽灯照明,采用V11.60.00正版监控软件录像,记录小鼠6 min内不动状态潜伏期和后4 min内不动状态持续时间。
糖水偏好实验:实验前训练小鼠适应含糖饮水,测试前所有小鼠禁水过夜后(禁水时间10 h以上),每只小鼠随机放置事先称重过的纯水瓶1个和含有1%的蔗糖水水瓶1个,0.5 h后,调换两只水瓶的相对位置,记录单只小鼠在1 h内的糖水消耗量和纯水消耗量,按照糖水偏好率=糖水消耗/(糖水消耗+纯水消耗)×100%,计算单只小鼠糖水偏好率。
1.6 样本处理及ELISA指标检测
8周有氧运动结束当日,所有小鼠进行神经行为学评分。禁食过夜,次日每组随机选取6只实验小鼠,1%的戊巴比妥钠麻醉(50 mg/kg)后,快速开胸,2 ml的真空抗凝管自心脏抽取新鲜血液,冷冻离心提取上清液。严格按照试剂盒说明书ELISA法测定血清中IL-1β和IL-10的含量。
处死后的小鼠于冰上剥离头部毛发与皮肤,暴露颅骨,用眼科镊自枕骨大孔轻轻剥开颅骨,充分暴露脑组织,直镊小心向上剥开大脑左右皮层,暴露出整个海马组织,玻璃分针将海马组织与大脑皮层及周围的脑组织分开,取出海马组织,冰PBS液冲洗,滤纸吸掉多余水分,称重后于Trizol试剂中浸泡,-80℃冰箱冻存,用于RNA的提取。
1.7 病理改变与免疫组织学分析
8周的运动干预后,每组随机选取3只小鼠,进行在体脑固定灌注,待小鼠四肢僵硬,肝脏变白,脑组织变白变硬后,采用上述方法取全脑于 4%的多聚甲醛固定,石蜡包埋,沿冠状面切成6 μm厚的切片。尼氏染色观察小鼠海马尼氏体的病变。SABC法(avidin-biotin-peroxidase complex technique)按试剂说明书进行染色,以显示各因子的阳性表达。每个切片镜下(×400)随机选取5个视野,利用Simple PCI生物显微镜分析图像体系计算视野的阳性表达区域面积。
1.8 海马总RNA的提取
首先电动匀浆机在 Trizol中匀浆后,离心,室温下静置 10 min充分裂解,严格按照试剂盒说明书和总 RNA提取依次滴加试剂、离心,提取总 RNA。提取的总 RNA经Q5000超微量分光光度计测定其含量及RNA纯度。
1.9 海马组织miRNA与mRNA高通量测序的GO和KEGG功能富集关联分析
针对 miRNA与 mRNA测序分析设置相同比较组合的几组进行 miRNA-mRNA关联分析,从比较的转录组分析得出差异基因,miRNA分析中得到差异 miRNA及对应的靶基因,并进行miRNA和mRNA的整合分析,再根据miRNA与其靶基因间的对应关系,对其集合进行GO(Gene Ontology)与KEGG富集分析。因考虑到miRNA会抑制甚至沉默其作用的靶基因的表达,分别按照差异 miRNA与差异 mRNA、差异下调miRNA与差异上调mRNA、差异上调miRNA和差异下调mRNA 3种情况进行差异表达的miRNA的靶基因集合(或称为“候选靶基因”)GO与KEGG功能富集分析。
1.1 0 RNA逆转录和实时荧光定量PCR
按照说明书使用高容量的 cDNA逆转录试剂盒进行cDNA的合成。使用PrimeScript® RT Master Mix Perfect Real Time kit定量检测 NLRP3、TLR4、IL-1β、IL-10和 NF-κBmRNA的表达水平,One Step PrimeScript® miRNA cDNA Synthesis Kit试剂盒逆转录试剂盒和 SYBR Green PCR Master Mix Kit(Applied biosystems)PCR试剂盒逆转录与定量miR-223的水平。实时荧光定量PCR使用CFX Connect PCR系统(Bio Rad,USA)进行 40个循环的 PCR,GAPDH和U6作为内部参照。根据Gene Bank核酸数据库中神经组织各因子 cDNA 序列,NLRP3、TLR4、IL-1β、IL-10和 NF-κBmRNA基因引物均由上海生工生物工程技术服务有限公司设计合成,miR-223、U6亦按照 miRBase database数据库中的碱基由广州Ribobio生物科技有限公司提供(引物合成序列详见表 1)。PCR检测过程每样本设 3个重复,测试结果采用2-△△Ct法计算组织中基因表达水平。

表1 本研究引物序列表Table 1 The Primer Sequence of Target Genes
1.1 1 蛋白质印迹(Western Blot)
另外随机选取 3只小鼠,麻醉处死后按上述 1.6的方法取出海马组织,滤纸吸去其表面水分,称重,眼科剪剪碎后于高速组织匀浆机冰上匀浆,4℃12 000 g离心5 min,吸取上清液,酶标仪测定其蛋白浓度后,将100 μg/孔的蛋白质样品装入5%SDS聚丙烯酰胺凝胶中,转移到0.45 μm孔径的硝酸纤维素膜(NC膜)上,随后用溶于 PBS中的3%(W/V)脱脂牛奶的 TBST封闭 2 h。TLR4、IL-1β和IL-10等与4℃的TBST缓冲液中以1:1 000稀释过夜。然后TBST洗涤5次,每次5 min,并在室温下与显色剂缀合的抗兔IgG二抗(稀释倍数1:2 000~5 000)孵育1 h。βactin为内参。使用Tanon 3500凝胶成像系统通过测定色谱带强度(区域×OD)定量Western印迹条带。
1.1 2 统计分析
本研究数据应用SPSS 20.0软件进行统计学分析,以平均数±标准差(M±SD)表示,在进行所有数据的方差齐性的Bartlett检验后,进行单因素ANOVA方差分析,组间差异按照配对样本 t检验,P<0.05为显著性差异,P<0.01为非常显著性差异。
2 结果
2.1 CUMS抑郁造模及其效果评价
神经行为学评定结果显示,MG组小鼠的糖水偏好指数显著下降、强迫游泳与悬尾不动时间明显延长(表 2)。尼氏染色的结果显示,模型组小鼠海马神经元数目明显减少,锥体细胞排列紊乱且细胞形态皱缩不完整,核固缩并多见偏移,着色浅染,部分尼氏体溶解并消失,胞质呈苍白色(图 1)。ELISA测试结果显示,MG组小鼠血清指标的炎性相关因子如 IL-1β比对照组呈显著性升高(表 3),IL-10也显著性增加,说明 CUMS抑郁造模后的小鼠炎症反应较为明显。由此可以验证 CUMS抑郁造模方法成功诱导出小鼠的抑郁症状。
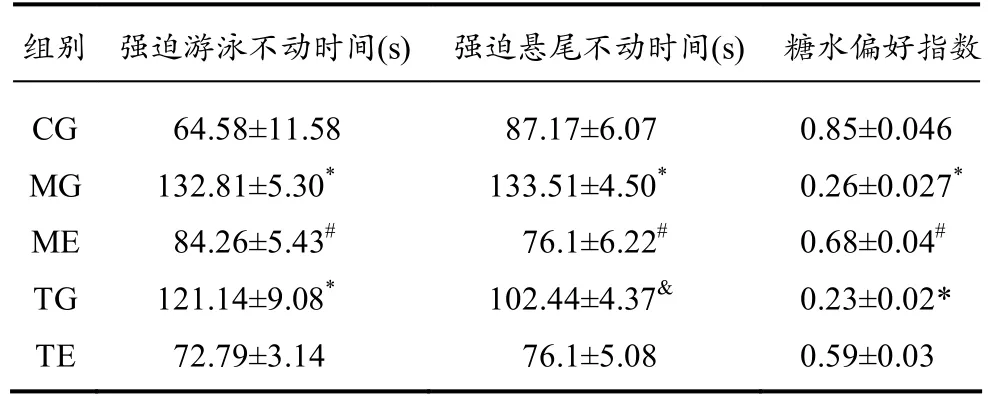
表2 CUMS抑郁小鼠神经行为学评定结果Table 2 The Results of NeurobehavioralAssessment of CUMS Depression Mice(n=8)

表3 有氧运动干预CUMS抑郁小鼠血清ELISA指标检测结果Table 3 The Results of Serum ELISA Indicators after AerobicTraining in CUMS Depression Mice(n=6, pg/mL)
2.2 CUMS抑郁小鼠高通量测序的GO与KEGG功能富集关联分析
依据miRNA与其靶基因间的对应关系,本研究对每组差异表达的miRNA的靶基因的集合分别进行GO和KEGG富集分析。基于 miRNA对 mRNA的转录作为转录后调控机制(图 2),miRNA会抑制甚至沉默其作用的靶基因。关联分析结果显示,miR-223的差异上调负调控 NLRP3的表达。
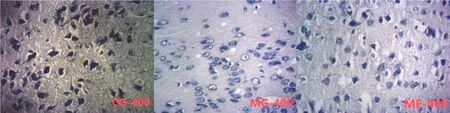
图1 有氧运动干预CUMS抑郁小鼠海马尼氏染色结果Figure 1. The Nissl Staining Results in Hippocampus of CUMS Depression Mice after Aerobic Training
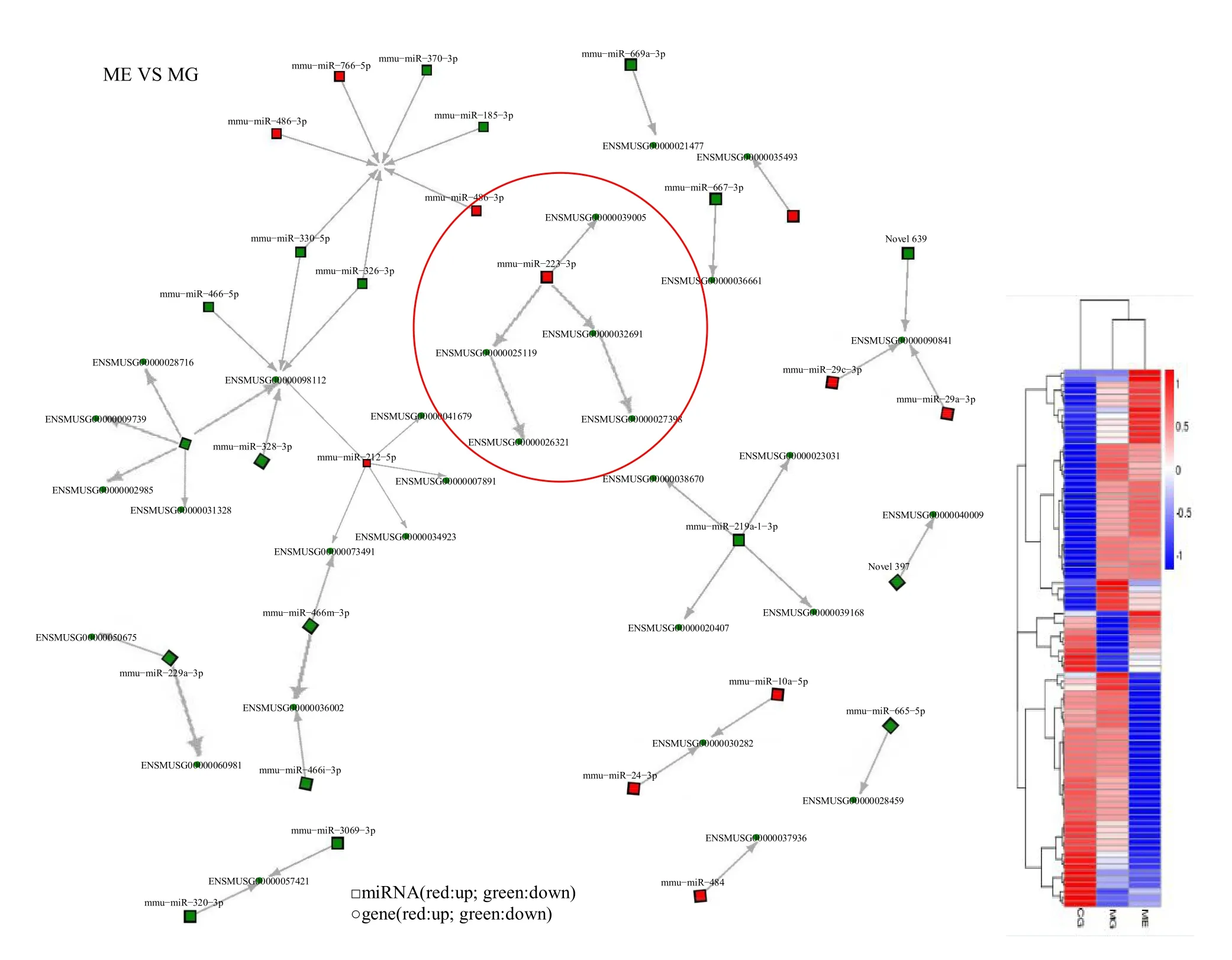
图2 Cytoscape分析miRNA-mRNA差异表达分析关系及差异靶基因集的聚类Figure 2. The miRNA-mRNA Differential Expression Analysis Relationship and the Clustering Map of Differential Target Gene Sets by Cytoscape Analysis
2.3 CUMS抑郁诱导小鼠 TLR4/miR-223/NLRP3信号通路轴的改变增加海马炎症
免疫组化检测结果显示(表 4),与 CG组相比,MG组小鼠海马组织的IL-1β、NF-κB与TLR4等促炎因子的量比CG组显著增高(P<0.01),抑炎因子IL-10也显著增高(P<0.05)。镜下观察,CG组神经细胞排列整齐,结构规整;MG组与之相比,炎性因子阳性细胞数较多,细胞排列松散,有明显的溶解破坏现象,结构不清晰,有的形成空泡(图3)。
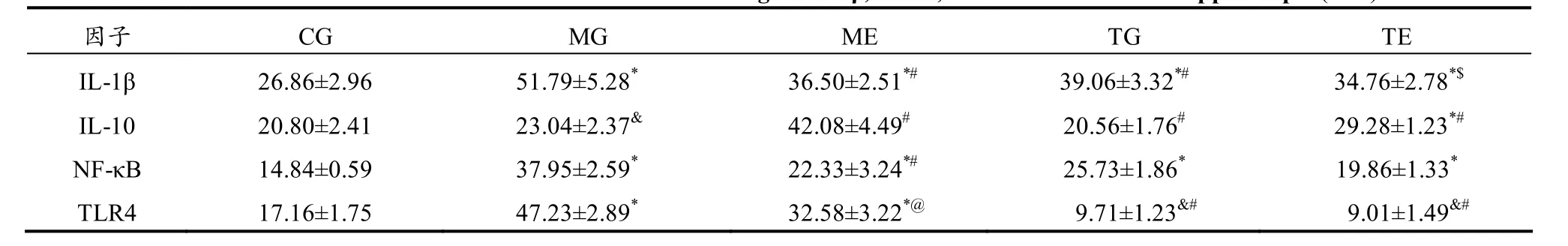
表4 CUMS抑郁小鼠造模前后海马组织IL-1β、IL-10、TLR4、NF-κB免疫组织化学染色阳性表达Table 4 The Results of Immunohistochemical Staining of IL-1β, IL-10, TLR4 and NF-κB in Hippocampus(n=6)
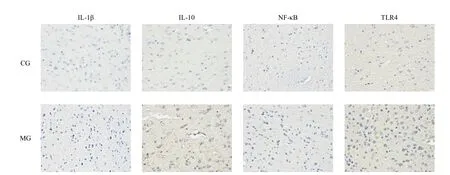
图3 CUMS抑郁小鼠免疫组化检测结果Figure 3. The Immunohistochemical Test Results of CUMS Depression Mice(×400)
利用 Western Blot和 RT-PCR方法进一步探讨有氧运动对 CUMS抑郁小鼠海马炎性相关因子表达的影响(耿元文 等,2018;林琴琴 等,2017)。结果显示,CUMS抑郁小鼠海马组织IL-1β、NF-κB和 TLR4的 mRNA均显著增加,预示 CUMS抑郁小鼠海马组织内的炎症反应较为明显。miR-223的RT-PCR检测结果也显示,MG组高于CG组呈显著性差异(图4)。
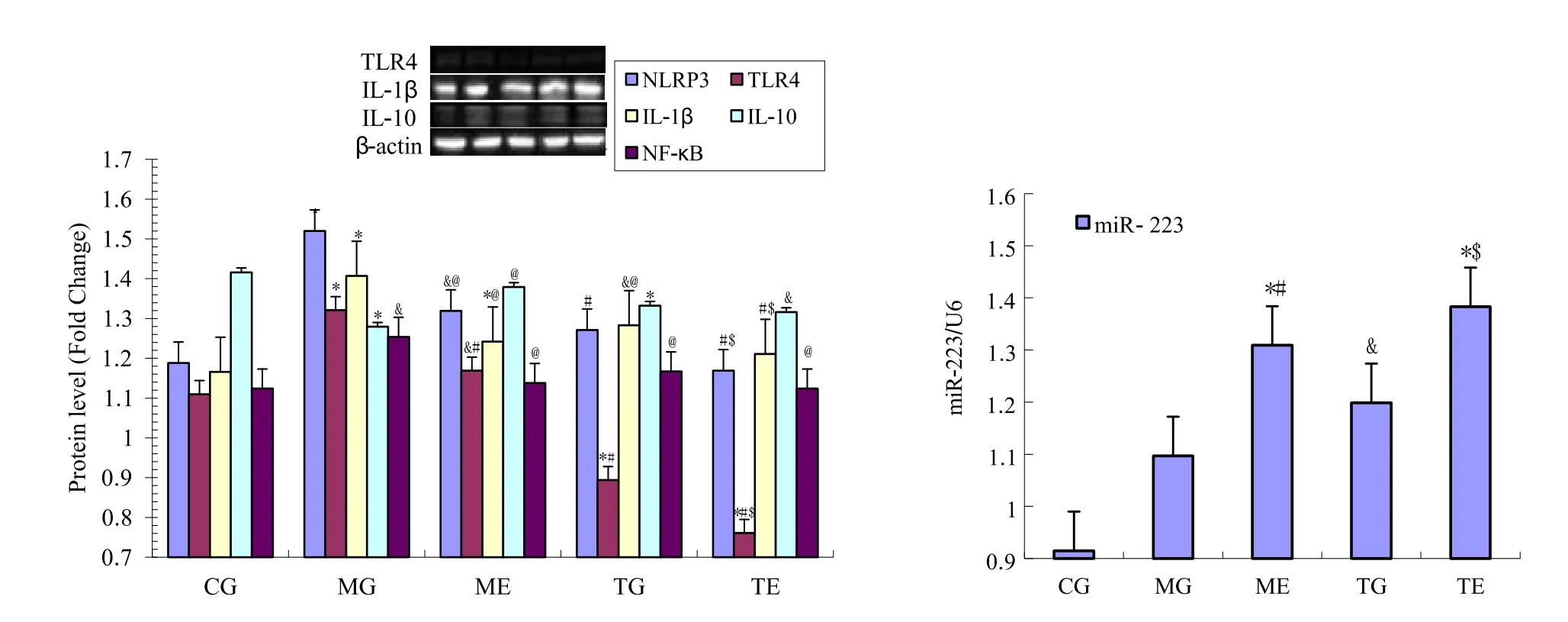
图4 各组小鼠海马NLRP3、TLR4、IL-1β、IL-10、NF-κB与miR-223基因表达Figure 4. The Gene Expression Maps of NLRP3, TLR4, IL-1β, IL-10, NF-κB and miR-223 in Hippocampus
2.4 有氧运动调控 TLR4/miR-223/NLRP3信号通路轴的表达拮抗抑郁小鼠海马炎症反应
2.4.1 有氧运动拮抗CUMS抑郁小鼠海马炎症效果
由表2的检测结果来看,对比MG组,ME组小鼠的强迫游泳和强迫悬尾不动时间得到显著改善,糖水偏好指数也有较大幅度的提高,ME组小鼠虽然也有少量神经元形态皱缩不完整,但锥体细胞排列紊乱得到改善,部分尼氏体更加饱满,核固缩现象明显减少,整体来看,有较大幅度的提高,完整的神经元数目显著增多。ELISA测试结果显示,与 MG组相比(表 3),ME组小鼠血清中的促炎因子TLR4、NF-κB和IL-1β下降,抑炎因子IL-10升高,均呈显著性差异。
免疫组化检测结果显示(表 4),ME组小鼠海马组织的IL-1β、NF-κB和TLR4等促炎因子的阳性表达区域明显减少,抑炎因子 IL-10的蛋白阳性表达区域增多。与 CG组小鼠相比,虽然炎性因子的表达未完全一致,但已表现出较好的改善趋势。镜下观察可见,ME组、TG组和 TE组,促炎因子表达量下调,抑炎因子表达量上调,且细胞排列比 MG组整齐,结构更趋于规整,在模型组中出现的空泡及溶解破坏现象也得以改善(图 5)。表明,有氧运动改善了抑郁小鼠海马组织细胞的炎症反应。

图5 有氧运动干预CUMS抑郁小鼠免疫组化检测结果Figure 5. The Immunohistochemical Test Results of CUMS Depression Miceafter Aerobic Training (×400)
2.4.2 有氧运动激活TLR4/miR-223/NLRP3信号通路轴的差异表达调控海马炎症反应
RT-PCR检测结果显示,MG组 NLRP3和TLR4等炎性因子均表达上调,而有氧运动可有效逆转,显著下调其mRNA表达。虽然MG组中抑炎因子IL-10 mRNA表达有所上调,但有氧运动可显著增加其表达,与之相比虽然不呈显著性差异,但其上调趋势明显。Western Blot的检测结果证实,经有氧运动干预的 CUMS小鼠海马中炎性因子IL-1β与NLRP3显著下降(P<0.05),TLR4呈显著性下降(P<0.01),NF-κB虽不呈显著性下降,但下降趋势明显,说明有氧运动能够降低 CUMS抑郁小鼠海马组织的炎性反应。miR-223的RT-PCR检测结果显示,ME组小鼠海马组织miR-223的表达水平显著高于CG组与MG组(P<0.01),ME组 NLRP3表达显著低于 MG组(P<0.05),这可能与miR-223特异性靶向作用NLRP3 mRNA的3’-UTR区,抑制NLRP3的翻译表达有关(Bauernfeind et al.,2012)。
2.5 TLR4抑制联合有氧运动激活抑郁小鼠TLR4/miR-223/NLRP3信号通路轴进而抑制海马炎症反应
TG组的测试结果显示,TLR4被抑制后的抑郁小鼠血清炎性因子TLR4与NF-κB较MG组有显著性降低,这可能与TLR4抑制剂能够有效地部分抑制小鼠机体TLR4的分泌有关。免疫组化检测结果显示,TG组小鼠海马组织的炎性细胞因子除 TLR4有较大幅度降低外,其余因子均高于CG组,低于 MG组,与此对比,TE组小鼠的促炎因子显著降低,抑炎因子IL-10明显升高。Western Blot检测也验证了这一结果,TG组小鼠炎性因子的表达情况低于 MG组,且 NLRP3的降低呈显著性,TLR4被抑制后再进行有氧运动康复训练能进一步降低促炎细胞因子的表达水平,说明有氧运动可加强 TLR4抑制剂抗 CUMS抑郁小鼠海马组织炎症作用。
3 讨论
3.1 CUMS抑郁小鼠激活海马 TLR4/miR-223/NLRP3信号通路轴诱发炎症
临床试验和动物实验研究结果显示,炎性因子 IL-1β、IL-18是导致抑郁症的关键因素(Dunn et al.,2005;Charles et al.,2006),Haapakoski等(2016)的研究指出,免疫系统被激活以及炎性细胞因子可能参与了部分抑郁症患者的发病。NLRP3在机体固有免疫系统中发挥重要作用,NLRP3的失衡可导致促炎细胞因子的过量生成,并通过下游信号转导通路,诱发一系列炎症瀑布反应,参与多种炎症疾病的发生与发展(Arend et al.,2008)。张懿(2016)研究结果显示,NLRP3可能成为免疫激活和抑郁症发生之间关键的调节分子,在抑郁症发病机制中扮演重要角色,其可通过调控 IL-1β的表达参与应激诱导的抑郁样行为的发生。本研究结果中,MG组小鼠 TLR4、NLRP3、IL-1β、NF-κB等炎性相关的因子的升高与miR-223的表达上调,可能与 TLR4前导基因的高表达有关,miR-223介导其转录后调控靶基因NLRP3的表达,即TLR4识别配体后,可激活下游包括NF-κB在内的炎性信号通路,miR-223可通过靶向识别 IKKα调控 TLR4/NF-κB信号通路(Li et al.,2010),进一步诱发 IL-1β、IL-18等炎性信号因子前体促使 NLRP3炎症体活化,伴随 NLRP3的活化,IL-1β与IL-18等炎症因子的前体转化成成熟的IL-1β和IL-18,并被释放到胞外,引起爆发式炎症,加重海马组织炎性损伤(图6a)。提示,CUMS抑郁小鼠海马组织炎症反应的发生可能与 TLR4/miR-223/NLRP3信号通路轴的调控有关。虽然 TLR4/miR-223/NLRP3信号通路轴在抑郁小鼠海马组织炎症的发生与发展中发挥重要作用,但有氧运动能否干预该信号通路轴的差异表达尚未确定。
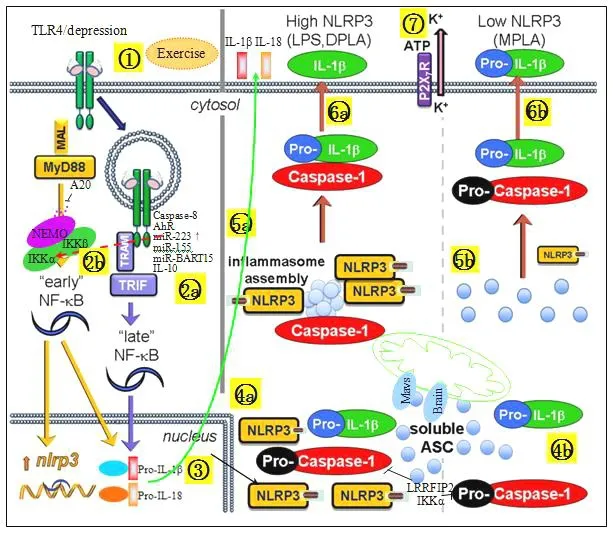
图6 TLR4/miR-223/NLRP3参与CUMS抑郁小鼠海马炎症反应Figure 6. The Mechanism of TLR4/miR-223/NLRP3 Involved in Hippocampus Inflammatory Response in CUMS Depression Mice
3.2 有氧运动干预抑郁小鼠海马 TLR4/miR-223/NLRP3信号通路轴进而拮抗炎症反应
有氧运动拮抗炎症反应已被证实,但有氧运动拮抗抑郁小鼠海马组织炎症的细胞分子和信号转导机制在很大程度上仍是未知的。本研究发现,TLR4/miR-223/NLRP3信号通路可能参与了有氧运动拮抗抑郁小鼠海马组织炎症反应的转归过程。在抑郁小鼠海马组织炎症反应中,TLR4可激活NF-κB信号通路(刘雯 等,2016),产生不成熟的IL-1β和 IL-18,使 NLRP3得以活化(Kayagaki et al.,2013);而有氧运动可以通过降低 TLR4的激活,诱导炎性因子NF-κB、IL-1β的转录水平的低表达,调控 miR-223的作用,miRNA-233在通过靶向识别IKKα调控TLR/NF-κB信号通路的同时,又负调控靶基因 NLRP3,抑制下游炎性因子影响抑郁炎症(Neudecker et al.,2017)。本研究发现,NLRP3、TLR4、IL-1β与NF-κB等促炎因子在CUMS抑郁小鼠海马组织中显著上调,有氧运动能有效降低炎性因子的表达,使炎症反应减弱(图 6b)。TLR4被抑制后,促炎因子的表达下调,同时,miR-223的活性增强,并降低炎性因子的差异表达,减轻抑郁小鼠海马神经炎症,有氧运动干预能够使这一效应增强。
为验证 miR-223与 TLR4、NLRP3之间的关系,本研究又对各组小鼠海马组织进行 mRNA和 miRNA的高通量测序,并对测序结果进行了关联分析。从分析结果来看,miR-223与 TLR4等诱导的炎性信号通路之间存在较为密切的调控机制,主要表现在TLR4激活后可通过NF-κB等转录子对 miR-223的表达进行调控,即通过抑制 miR-223结合并活化 STAT3基因介导抑郁小鼠海马组织促炎因子的产生,miR-223可同时通过负调控靶基因NLRP3与靶向识别IKKα调控TLR/NF-κB信号通路,使NLRP3在这一过程中表达逐渐增高。miR-223的低表达会增强促炎因子 IL-1β、NF-κB的活性,形成一个负反馈调节环,调控 TLR4触发的海马组织产生 IL-1β。NLRP3是 miR-223的靶基因,miR-223在单核细胞向巨核细胞分化过程中表达逐渐降低,而NLRP3的表达逐渐增高,相反,miR-223的高表达会致使 NLRP3蛋白减少并抑制炎性体产生IL-1β(魏永宝 等,2016)。在这一作用机制中,TLR4的转录是其诱导该通路轴的前导因子,由于 TLR4的低表达或被抑制,使miR-223的表达增强,进而抑制NLRP3的蛋白减少,降低炎性体产生促炎因子,这可能是 TLR4/miR-223/NLRP3轴在发挥作用。在此过程中,TLR4所扮演的角色是否发挥了激活miR-223的过程,以及TLR4被抑制是否影响到miR-223的差异表达。为此,该实验针对 CUMS抑郁小鼠实施了TAK-242的腹腔注射,来抑制TLR4的表达。此外,我们还发现,白介素1受体相关激酶(Interleukin-1 receptorassociated kinase 1,IRAK1)的磷酸化也可通过负调控NF-κB的活性抑制 NLRP3的表达,同时,IRAK1在快速炎症小体反应过程中可绕过NLRP3的翻译及翻译后修饰等的过程,直接作为TLR4与NLRP3间的桥梁启动炎症反应(Lin et al.,2014),这一反应过程也与TLR4的激活影响miR-223靶向识别IKKα的调控作用有关(图7)。
图7 有氧运动干预CUMS抑郁小鼠海马组织TLR4/miR-223/NLRP3信号通路轴的KEGGFigure 7. The KEGG Analysis Map of TLR4/miR-223/NLRP3 Signaling Pathway Axis in Hippocampus of CUMS Depression Mice after Aerobic Training
3.3 TLR4抑制联合有氧运动干预TLR4/miR-223/NLRP3信号通路轴进而拮抗海马炎症效果
本研究采用TLR4抑制剂TAK-242对CUMS抑郁小鼠进行刺激,RT-PCR检测各组小鼠海马组织的 miR-223及相关炎性因子 mRNA的差异表达。结果显示,TLR4被抑制后 miR-223在海马组织内的表达显著上调,且有氧运动有助于 miR-223的进一步表达,并有效抑制促炎细胞因子的高表达和增强抑炎因子的表达,起到良好的抗炎效果。这可能与 TAK-242通过抑制 TLR4的基因表达,激活miR-223活性增加,增强其靶向识别IKKα调控TLR4/NF-κB信号通路的作用(Wang et al.,2015),降低其下游的炎性因子的IL-1β、NLRP3等的表达。ME组与TE组小鼠对比结果显示,TLR4抑制后再进行有氧运动有助于降低炎性因子的表达,促进抑炎因子的释放,其效果优于单纯有氧运动的效果,同时,TLR4被抑制后,有氧运动依然能够增加IL-10的信号表达量,但相比于MG组与TG组而言,不呈显著性差异。令人诧异的是,与 MG组小鼠相比,ME组海马组织的炎性因子和抑炎因子的mRNA差异表达与TG组相关因子的差异表达趋势高度一致。由此推断,有氧运动干预能够降低 TLR4的因子表达,并进一步拮抗CUMS抑郁小鼠海马组织的炎性损伤。在 TG组小鼠中,miR-223的基因表达水平升高,较 MG组相比呈现显著性差异,说明 TLR4被抑制后确实能够增强 miR-223的表达。此外,针对TLR4被抑制后再实施有氧运动康复,其miR-223的值可持续增高,但与抑制剂组相比其结果不呈显著性差异,相比模型组呈显著性差异。提示,TLR4抑制剂能在一定程度上减轻抑郁小鼠的炎性反应,但抑制剂与有氧运动的联合干预能够有效降低抑郁小鼠海马组织的炎症。
本研究发现,有氧运动能显著增加 CUMS抑郁小鼠海马组织 miR-223和抑炎因子 IL-10的表达,降低 TLR4、IL-1β、NF-κB、NLRP3等的表达水平,且海马组织 miR-223表达水平与 TLR4呈显著性负相关。推测有氧运动能够通过抑制 TLR4的表达,调节 miR-223靶向识别 IKKα的能力,调控TLR4/NF-κB信号通路,阻碍其下游靶基因NLRP3的活性,降低 IL-1β等炎性细胞因子的表达水平。表明,有氧运动改善抑郁小鼠海马组织功能,发挥抗炎作用,可能与TLR4/miR-223/NLRP3信号通路轴的激活有关。
4 结论
有氧运动可显著降低 CUMS抑郁小鼠海马组织 TLR4的表达,诱导炎性因子IL-1β及NF-kB转录子的低表达,调控miR-223的高表达,激活TLR4/imRNA-223/NLRP3通路,靶向抑制NLRP3蛋白活性,抑制炎性因子的释放,减弱抑郁小鼠海马组织炎症,调控其抗炎效果。
有氧运动改善抑郁小鼠海马功能与提高抑郁小鼠海马组织miR-223的表达,激活TLR4/imRNA-223/NLRP3通路轴关系密切。
因此,有氧运动及其运动替代物有可能通过干预miRNAs的表达发挥对抑郁症海马组织的保护效应,可为抑郁症及脑神经疾病患者运动康复手段的筛选及干预提供新思路。
陈伟,陈嘉勤,毛海峰,等,2017. 有氧运动和黑果枸杞多糖对慢性脑缺血小鼠的干预及Notch通路相关因子的组织差异表达[J]. 中国动脉硬化杂志,25(8):783-790.
董秀娟,2017. 不同强度跑台运动对大鼠学习记忆功能的影响及microRNA-483与IGF2的调控机制研究[D].昆明:云南师范大学.
杜杰,2017.有氧运动通过抑制干仗 IKKβ/NF-κB信号通路改善胰岛素抵抗小鼠炎症反应[J]. 中国体育科技,53(6):101-107.
高丕明,罗小兵,虞亚明,等,2015. 女性膝骨关节炎患者有氧运动能力研究[J].中国运动医学杂志,35(11):1094-1097.
戈含笑,魏宏文,张有志,等,2017. 有氧运动对慢性应激大鼠脑海马区神经可塑性的影响[J].北京体育大学学报,45(5):39-45.
耿元文,林琴琴,马宏敏,等,2018. 间歇有氧运动激活心梗大鼠肾脏miR-21/TLR4/NF-κB通路抑制肾脏炎症反应[J].北京体育大学学报,41(1):70-74.
郭音,罗赤苗,陈嘉勤,等,2017. NF-κB信号通路在小鼠阻塞性黄疸及运动与黑果枸杞多糖干预中的差异表达[J]. 中国体育科技,53(4):119-124,137.
洪灯,齐亚灵,张彦慧,等,2011. 简单易操作的大鼠CUMS抑郁模型的构建方法[J].中国卫生产业,8(24):3-4.
李红叶,2017. 有氧运动对 MI后大鼠心肌组织抑炎因子的影响及调控研究[D].扬州:扬州大学.
李小龙,2016. 有氧运动改善阿尔茨海默病大鼠认知功能损害的综述免疫机制的研究[D]. 太原:太原理工大学.
林琴琴,耿元文,田振军,2017. 间歇有氧运动激活 miR-21/SIRT1/NF-κB通路改善心梗大鼠肾功能研究[J].体育科学,37(7):44-49.
林小晶,鲁林,王晓慧,2017. 炎症因子 chemerin在有氧运动改善动脉粥样硬化大鼠血脂和主动脉硬化中的作用[J]. 上海体育学院学报,41(4):49-56.
刘敏,冯连世,王晓慧,2015. 4周有氧运动对肥胖青少年胰岛素抵抗及炎症因子的影响[J]. 上海体育学院学报,39(3):87-89,94.
刘雯,郭文洁,徐强,等,2016. NLRP3炎症小体调控机制研究进展[J].药学学报,51(10):1505-1512.
屈红林,陈惠宇,2008. 运动引起应激与应激性疾病的研究进展[J].中国康复医学杂志,23(8):768-770.
屈红林,谢军,陈嘉勤,等,2018. 有氧运动激活 BDNF/miR-195/Bcl-2信号通路轴抑制CUMS抑郁小鼠海马神经细胞凋亡[J],天津体育学院学报,33(2):148-155.
唐茂婷,吴茜,张慧敏,等,2017. 有氧运动在老年痴呆患者中的研究进展[J].中国老年学杂志,37(21):5462-5464.
王卉,刘绍生,夏志,等,2017. 长期有氧运动对代谢综合征大鼠炎症及心肌组织过氧化物酶体增殖物激活受体α表达的影响[J]. 中国康复医学杂志,32(12):1351-1355.
魏永宝,杨金瑞,尹焯,等,2016. miR-223生物学功能及在肿瘤中作用[J].创伤与急诊电子杂志,4(3):166-184、151.
温如武,常虹,白帆,2018. 抗阻运动联合有氧运动用于脑卒中患者的疗效观察[J]. 中国医学工程,16(1):91-93.
吴卫东,岳静静,王国伟,等,2016. 有氧运动预防及治疗 ApoE-/-小鼠动脉粥样硬化过程中脂联素的抗炎症作用[J]. 中国康复医学杂志,31(11):1219-1224.
吴秀琴,刘丽霞,尹玉娇,等,2016. 有氧运动和茶多酚对 2型糖尿病大鼠胰岛素抵抗和血清炎症因子的影响[J].福建师范大学学报(自然科学版),32(5):106-112.
吴雨卉,孙经武,池天鹤,2018. NLRP3/IL-1β信号通路在大鼠动脉粥样硬化中的炎症机制研究[J]. 心脏杂志,30(2):141-145.
夏晓爽,2016. TLR4诱导自噬与动脉粥样硬化斑块稳定性的关系以及干预治疗的研究[D].天津:天津医科大学.
张涛,熊旭东,2015. 核苷酸结合寡聚化结构域样受体蛋白 3炎性体的调控机制[J]. 医学综述,21(2):199-201.
张宪亮,2016. 有氧运动及白藜芦醇对 Tg APP/PS1小鼠海马 Aβ沉积的影响[D]. 上海:华东师范大学.
张懿,2016. NLRP3炎性小体在抑郁样行为中的作用及分子机制[D].上海:第二军医大学.
甄凤亚,王岚,安翠霞,2017. Toll样受体 4与抑郁症[J].中华行为医学与脑科学杂志,26(8):760-764.
AFSHARI M, YANG A, BEGA D, 2017. Motivators and barriers to exercise in Parkinson's disease [J]. J Parkinson's Disease, 7(4):703-711.AREND WP, PALMER G, GABAY C. 2008. IL-1, IL-18, and IL-33 families of cytokines[J]. Immunological Reviews, 223:20-38.
BAUERNFEIND F, RIEGER A, SCHILDBERG FA, et al., 2012.NLRP3 inflammasome activity is negatively controlled bymiR-223[J]. J Immunol, 189(8);4175-4181.
BEDFORD TG, TIPTON CM, WILLSON NC, et al., 1979. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol. 47(6):1278-1283.
CAMKURT MA, ACAR Ş, COŞKUN S, et al., 2015. Comparison of plasma MicroRNA levels in drug naive, first episode depressed patients and healthy controls[J]. J Psychiatric Res,69: 67-71.
CAMKURT MA, GÜNEŞ S, COŞKUN S, et al., 2017.Peripheral Signatures of Psychiatric Disorders: MicroRNAs [J]. Clin Psychopharmacology Neurosci, 15(4): 313-319.
CHARLES L, CAPURON L, MILLERAH, 2006. Cytokines sing the blues: Inflammation and the pathogenesis of depression[J]. Trends Immunol, 27(1):24-31.
CHENG Y, PARDO M, ARMINI RS, et al., 2016. Stress-induced neuroinflammation is mediated by GSK3-dependent TLR4 signaling that promotes susceptibility to depression-like behavior[J]. Brain Behav Immunity, 53:207-222.
DUNN AJ, SWIERGIEL AH, DE BEAUREPAIRE R, 2005. Cytokines as mediators of depression: What can we learn from animal studies?[J] Neurosci Biobehavioral Rev, 29(4):891-909.
HAAPAKOSKI R, EBMEIER KP, ALENIUS H, et al., 2016. Innate and adaptive immunity in the development of depression: An update on current knowledge and technological advances[J]. Prog Neuropsychopharmacology Biolo Psychiatry, 66(3):63-72.
HANEKLAUS M, GERLIC M, KUROWSKA-STOLARSKA M, et al.,2012. Cutting edge: MiR-223 and EBV miR-BART15 Regulate the NLRP3 Inflammasome and IL-1β Production [J]. J Immunol,189(8):3795-3799.
HE WT, WAN H, HU L, et al., 2015. Gasdermin D is an executor of pyroptosis and required for interleukin-1 β secretion[J]. Cell Res,25(12):1285-1298.
KAYAGAKI N, WONG MT, STOWE IB, et al., 2013.Noncanonical inflammasome activation by intracellular LPS independent of TLR4[J]. Sci, 341(6151):1246-1249.
LATZ E, XIAO TS, STUTZ A, 2013. Activation and regulation of the inflammasomes [J]. Nature Rev Immunol.13(6):397–411.
LI T, MORGAN MJ, CHOKSI S, et al., 2010. MicroRNAs modulate the noncanonical transcription factor NF-kappaB pathway by regulating expression of the kinase IKKalpha during macrophage differentiation [J]. Nat Immunol, 11(9):799-805.
LIN KM, HU W, TROUTMAN TD, et al., 2014. IRAK-1 bypasses priming and directly links TLRs to rapid NLRP3 inflammasome activation [J]. Proc Nat Acad Sci USA, 111(8):775-780.
LIU W, SHENG H, XU Y, et al., 2013. Swimming exercise ameliorates depression-like behavior in chronically stressed rats:Relevant to proinflammatory cytokines and IDO activation[J]. B Brain Res, 242(2):110-116.
MCNEELA EA, BURKE A, NEILL DR, et al., 2010. Pneumolysin Activates the NLRP3 Inflammasome and Promotes Proinflammatory Cytokines Independently of TLR4[J]. Plos Pathogens, 6(11): e1001191.
MAN SM, KANNEGANTI TD, 2015. Converging roles of caspases in inflammasome activation, cell death and innate immunity[J]. Nat Rev Immunol, 16(1):7.
NEUDECKER V, HANEKLAUS M, JENSEN O, et al., 2017. Myeloidderived miR-223 regulates intestinal inflammation via repression of the NLRP3 inflammasome[J]. J Exp Med, 214(6):1737-1752.
PLAYFORD ED, 2011. Exercise and Parkinson’s disease[J]. J Neurol Neurosury Pshychiatry. 82(11):1185.
RADOMAIZIK S, ZALDIVAR F, OLIVER S, et al., 2010.Evidence for microRNA involvement in exercise-associated neutrophil gene expression changes[J]. J Appl Physiol,109(1):252-261.
SOLHAUG HI, ROMULD EB, ROMILD U, et al., 2012. Increased prevalence of depression in cohorts of the elderly: an 11-year followup in the generla population-the HUNT study [J]. Int Psychogeriatrics,24(1):151-158.
SUBRAMANIAN I, 2017. Complementary and alternative medicine and exercise in nonmotor symptoms of Parkinson's disease [J]. Int Rev Neurobiology, 134:1163-1188.
SUN W, JULIE LI YS, HUANG HD, et al., 2010.microRNA: A master regulator of cellular processes for bioengineering systems[J]. Annu Rev Biomed Engin, 12(1): 1-27.
WANG J, BAI XJ, SONG Q, et al., 2015.miR-223 inhibits lipid deposition and inflammation by suppressing Toll-like receptor4 signaling in macrophages [J]. Int J Mol Sci, 16:24965-24982.
WANG XH, HUANG W, YANG Y, et al., 2014. Loss of MiR-223 Duplex (5p and 3p) Aggravates Myocardial Depression and Mortality in Polymicrobial Sepsis[J]. Biochim et Biophys Acta,1842(5);701-711.
XU YJ, SHENG H, BAO QY, et al., 2016. NLRP3 inflammasome activation mediates estrogen deficiency-induced depression- and anxiety-like behavior and hippocampalinflammation in mice[J].Brain Behav Immunity, 56:175-186.
YAN H, LI L, LIU F, et al., 2011. Screening of the anti-inflammatory peptides against MD-2 and its depression on TLR4 activation stimulated by LPS[J]. Inflammation Res, 60:S150.YANG Z, ZHONG L, XIAN R, et al., 2015.MicroRNA-223 regulates
inflammation and brain injury via feedback to NLRP3 inflammasome after intracerebral hemorrhage[J]. Mol Immunol,65(2):267-276.
