结核分枝杆菌Rv1626的原核表达及其免疫功能研究
2019-03-09袁伟许礼发王晓春张京燕朱心怡
袁伟 许礼发 王晓春 张京燕 朱心怡

摘要:目的 拟靶向结核分枝杆菌(M.tb)感染后的分泌期抗原Rv1626,构建其原核表达质粒pPROEX-Rv1626并表达纯化,通过人群和动物实验评价其免疫原性。方法 构建重组载体pPROEX-Rv1626,以全血干扰素释放分析技术(WBIA)检测其是否能被山西省长治市M.tb感染者的T细胞特异性识别;同时免疫小鼠,检测其特异性诱导脾细胞分泌的IFN-γ、TNF-α和IL-2水平及抗体水平。结果 ①成功构建重组载体pPROEX-Rv1626,并成功诱导表达、纯化和鉴定;②rRv1626蛋白诱导M.tb感染者外周血中淋巴细胞产生的IFN-γ水平均显著高于健康者对照者(P<0.001),ATB患者外周血中淋巴细胞分泌IFN-γ水平显著高于LTBI人群(P<0.001);③BCG+Rv1626/DMT组产生的特异性相关抗体滴度显著高于Rv1626/DMT组及BCG组(P<0.01);Rv1626/DMT组和BCG+Rv1626/DMT组的IgG2a/IgG1比值显著高于DMT组和BCG组(F=33.69),且前两组IgG2a /IgG1>1,倾向于Th1型细胞免疫应答;④不同免疫组小鼠无论是PPD或rRv1626蛋白刺激,BCG+Rv1626/DMT组均分泌最高水平的IL-2、IFN-γ和TNF-α,其次为BCG组、Rv1626/DMT组,PBS组为最低。同时Rv1626/DMT组显著高于DMT组(P<0.01)。结论 rRv1626能被M.tb感染者T细胞所识别,免疫小鼠能诱导抗原特异性Th1型细胞免疫应答,可能与其提供的免疫保护力密切相关。
关键词:结核分枝杆菌;Rv1626;原核表达;免疫原性;结核病
中图分类号:R378.91+1 文献标识码:A DOI:10.3969/j.issn.1006-1959.2019.01.022
文章編号:1006-1959(2019)01-0065-04
Prokaryotic Expression and Immune Function of Mycobacterium Tuberculosis Rv1626
YUAN Wei1,XU Li-fa1,WANG Xiao-chun1,ZHANG Jing-yan2,ZHU Xin-yi3
(1.School of Medicine,Anhui University of Science and Technology,Huainan 232001,Anhui,China;
2.Department of Clinical Laboratory,Affiliated Heping Hospital,Changzhi Medical College,Changzhi 046000,Shanxi,China)
Abstract:Objective To target the secretory antigen Rv1626 after Mycobacterium tuberculosis (M.tb) infection, construct its prokaryotic expression plasmid pPROEX-Rv1626 and express it for purification. The immunogenicity was evaluated by human and animal experiments. Methods The recombinant vector pPROEX-Rv1626 was constructed and tested by whole blood interferon release assay (WBIA) to detect T cells specifically recognized by M.tb infected patients in Changzhi City, Shanxi Province. Simultaneous immunization of mice was used to detect their specific induction. The levels of IFN-γ, TNF-α and IL-2 secreted by spleen cells and antibody levels. Results ①The recombinant vector pPROEX-Rv1626 was successfully constructed and successfully expressed, purified and identified. ②rRv1626 protein induced IFN-γ levels in peripheral blood of M.tb infected patients was significantly higher than healthy controls (P<0.0001). At the same time, the level of IFN-γ secreted by lymphocytes in peripheral blood of ATB patients was significantly higher than that of LTBI (P<0.0005);③The specific antibody titers produced by BCG+Rv1626/DMT group were significantly higher than those of Rv1626/DMT group and BCG group (P<0.01).The ratio of IgG2a/IgG1 in Rv1626/DMT group and BCG+Rv1626/DMT group was significantly higher than that in DMT group and BCG group (F=33.69), and the former two groups of IgG2a/IgG1>1 tended to Th1 type cellular immune response; ④Different The mice in the immunized group were stimulated with PPD or rRv1626 protein, and the highest levels of IL-2, IFN-γ and TNF-α were secreted in the BCG+Rv1626/DMT group, followed by the BCG group and the Rv1626/DMT group, and the PBS group was the lowest. At the same time, the Rv1626/DMT group was significantly higher than the DMT group (P<0.005). Conclusion rRv1626 can be recognized by T cells infected by M.tb. Immunized mice can induce antigen-specific Th1-type cellular immune responses, which may be closely related to the immune protection provided by them.
Key words:Mycobacterium tuberculosis;Rv1626;Prokaryotic expression;Immunogenicity;Tuberculosis
结核病(TB)由结核分枝杆菌(Mycobacterium tuberculosis,M.tb)感染引发,与获得性免疫缺陷综合征(AIDS)、疟疾(malaria)并称为世界上三大主要的传染性疾病。全球约有1/4人群感染M.tb,2016年全球TB新发病例约为1040万,其中金砖五国占其总数的50%以上,中国的TB发病率和死亡率均在22个TB高负担的国家位居前列[1]。尽管卡介苗(BCG)在全球接种覆盖率超过90%,但对接种者的保护效应仅能持续约5~10年,这可能是由于世界各地BCG培养和免疫策略不同,进而导致基因型的改变[2]。由于BCG无法对成人TB提供足够的免疫保护力,尤其对M.tb潜伏感染人群(LTBI)效果有限,故亟需更高效的结核病预防和治疗性疫苗。本课题基于筛选和构建M.tb感染分泌期高表达抗原Rv1626,以体外人群和体内动物实验检测其免疫原性,旨在为新型结核疫苗的研究提供有效的候选靶抗原。
1 材料与方法
1.1实验材料 E.coli DH5α株、E.coli BL21(DE3)株购自Tiangen生物公司;SPF级C57BL/6小鼠购自安徽医科大学实验动物中心;Ni-NTA 蛋白纯化系统购自GE公司;人、鼠相关细胞因子ELISA kit检测试剂盒均购自深圳Dakewe公司。二甲基三十六烷基铵(DDA)、单磷酰脂质A(MPL)和海藻糖6,6'-二分枝菌酸(TDB)购自Sigma公司。
1.2方法
1.2.1引物设计 分析pPROEX载体上的多克隆位点及Rv1626全序列酶切位点,设计特异性引物(P1: TTCGGATCC ACCGGCCCCACCACCGACG,P2: ATCTCGAG GGTGTCTTTGGGTGTTCCGAGGGTT)。PCR扩增条件:95 ℃,5 min,94 ℃,50 s,65 ℃,50 s,72 ℃,40 s,30 cycles,72 ℃,10 min。
1.2.2质粒构建表达、纯化 以分子克隆法将Rv1626基因片段导入原核表达载体pPROEX中,构建重组载体pPRO-Rv1626,以BamHⅠ和XhoⅠ行双酶切鉴定。过夜培养后,经CaCl2和热休克法转入E.coli BL21(DE3)感受态细胞中,以终浓度为0.5 mmol/L的IPTG诱导表达,再以Ni-NTA纯化蛋白,4 ℃梯度透析36 h后以内毒素清除试剂盒除去内毒素(<0.1 EU/ml)。以15% SDS-PAGE及Western blotting分析鉴定蛋白,再以BCA试剂盒测定蛋白浓度。
1.2.3 IGRA检测不同人群外周血抗原特异性IFN-γ水平 委托山西长治医院检验科,病史采集、问卷调查及全身体检,随机选取感染者和健康者共40例,同时依据临床诊断标准对受试人群进行初筛。感染者(包括ATB和LTBIs):存在(或无)明显TB感染症状、有与TB患者接触史、痰涂片或痰培养阳性(或阴性)、胸部X光出现可疑阴影(或正常),以及结核菌素试验(TST)检测阳性(TST≥5 mm);健康对照者:无与TB感染者密切接触史、TST检测阴性(TST<5 mm)。
采集受试者的全血,以0.5 ml/孔加入无菌24孔板,并以5 μg/孔rRv1626蛋白进行刺激,置37 ℃温箱孵24 h。同时分别以等体积的PBS和PHA分别为阴性和阳性对照,收集血浆以人IFN-γ ELISA试剂盒检测各孔IFN-γ浓度,并得出各孔最终值=实际测得值-PBS刺激的本底值。
1.2.4实验动物分组及免疫方式 6周龄雌性C57BL/6小鼠共30只,分为PBS组、BCG組、佐剂DMT(DDA、TDB、MPL)组、Rv1626/DMT组和BCG+Rv1626/DMT组,6只/组。具体免疫方式如下:①PBS组:200 μl PBS /只;②BCG组:200 μl /只(含菌1.2×106 CFU)BCG免疫1次;③DMT组:100 μl DMT混合100 μl PBS /只;④Rv1626/DMT组:含40 μg rRv1626蛋白溶液100 μl混合100 μl DMT /只;⑤BCG+Rv1626/DMT组:先以200 μl/只(含菌1.2×106 CFU)BCG免疫1次,3周后以Rv1626/DMT(含40 μg rRv1626蛋白溶液100 μl混合100 μl DMT /只)增强免疫2次,间隔3周。注射方式:PBS组和BCG组分别为0周注射1次;DMT和Rv1626/DMT组免疫共3次,每3周注射1次;BCG+Rv1626/DMT组0周时先以BCG注射1次,3周后,以Rv1626/DMT增强2次,每3周1次。
1.2.5小鼠血清中抗原性特异性抗体水平检测 免疫9周后,对各组小鼠摘眶取血,收集各组小鼠血清,应用间接ELISA法检测抗原特异性IgG、IgG1、IgG2a滴度(以阳性结果最高稀释倍数的倒数表示),以IgG2a和IgG1实际测得的稀释倍数计算IgG2a:IgG1。
1.2.6 ELISA检测脾细胞培养上清中抗原特异性IFN-γ、TNF-α和IL-2 水平 无菌分离出小鼠脾细胞并定量,将100μl的2.5×106 /孔的脾细胞加入24孔板中,阳性对照组为PPD(10μg /孔);阴性对照组为RPMI1640培养基;实验组为Rv1626蛋白(10μg /孔)。37 ℃培养24~72 h后,离心并收集上清,用鼠ELISA试剂盒检测相应细胞因子分泌水平。
1.3统计学分析 以SPSS18.0进行数据分析,IGRA法检测不同人群IFN-γ浓度水平,采用非参数U检验,各组小鼠免疫原性相关指标比较采用单因素方差分析。P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义,P<0.001为统计学意义极显著。
2 结果
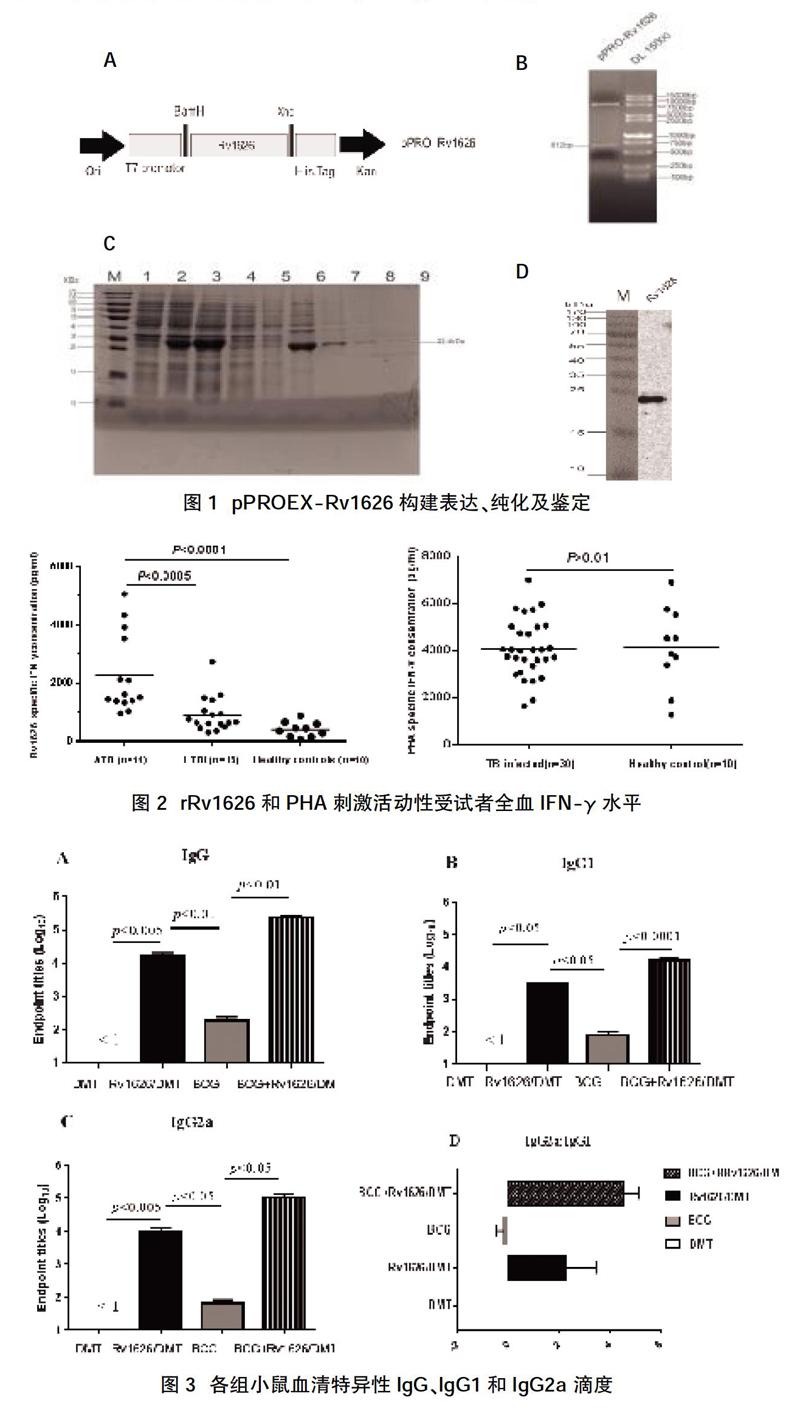
2.1 pPROEX-Rv1626原核表达载体的构建、表达纯化和免疫印迹分析 经PCR扩增出大小为612 bp的序列片段,插入pPROEX后,成功构建重组质粒pPROEX-Rv1626。经XhoⅠ、BamHⅠ双酶切及测序鉴定无误(见图1A、B)。rRv1626蛋白诱导表达并经Ni-NTA柱以变性条件纯化后,获得分子量为22.4 kD蛋白产物,与预期符合(见图1C、D);经Western blotting鉴定其成功表达。BCA试剂盒测定蛋白浓度为1.6 mg/ml,蛋白总表达量为4.5 mg。在Bio-Rad凝胶成像仪经图像分析测得蛋白纯度为92.2%。
2.2 rRv1626刺激受试者产生特异性IFN-γ水平比较 委托山西长治医学院附属医院检验科筛选出符合临床诊断标准的受试者共40例,其中健康对照者、ATB患者和LTBI受试者及分别为10例、14例和16例。rRv1626蛋白诱导M.tb感染者外周血中淋巴细胞产生的IFN-γ水平均显著高于健康者对照者(P<0.001),同时诱导ATB人群外周血中淋巴细胞分泌IFN-γ水平显著高于LTBI人群(P<0.001),见图2A。非特异性刺激物PHA诱导受试者外周血中淋巴细胞产生的IFN-γ水平无统计学差异(P>0.01),见图2B。
2.3 Rv1626/DMT免疫小鼠诱导高水平的特异性IgG抗体 TMD组产生的IgG抗体及其亚类无显著的特异性;BCG+Rv1626/DMT组产生的特异性相关抗体滴度显著高于Rv1626/DMT组及BCG组(P<0.01);Rv1626/DMT组和BCG+Rv1626/DMT组的IgG2a/IgG1比值显著高于DMT组和BCG组(F=33.69),且前两组IgG2a /IgG1>1,倾向于Th1型细胞免疫应答,见图3。
2.4 Rv1626/DMT免疫小鼠脾细胞分泌高水平特异性Th1型细胞因子 不同免疫组小鼠无论是PPD或rRv1626蛋白刺激,BCG+Rv1626/DMT组均分泌最高水平的IL-2、IFN-γ和TNF-α,其次为BCG组、Rv1626/DMT组,PBS组为最低。同时Rv1626/DMT组显著高于DMT组(P<0.01)。PPD刺激时,BCG组水平显著高于Rv1626/DMT组、rRv1626刺激时则反之(P<0.01);各组表达的IL-4水平均较低且无显著差异,见图4。
3 讨论
筛选M.tb感染后多个不同时期优势表达抗原,并以之为候选靶抗原构建TB亚单位疫苗,已成为当今新型结核疫苗研究的重要策略之一。目前,绝大多数的新型结核亚单位疫苗仍聚焦于复制期优势表达抗原,如Ag85A、Ag85B和Rv3619等被广泛用于TB疫苗研究中,且均证实具有较好的免疫保护效果[3]。近年来,已有12条疫苗进入临床试验阶段,涉及表达单个或多个靶抗原的不同形式的疫苗有7种,其中亚单位疫苗有4种,尤其以单表达分泌期优势抗原为重要研究靶点。本课题的重要意义在于通过人群和动物实验筛选出具有潜力的分泌期靶抗原。
Rv1626是M.tb感染复制期分泌的重要抗原[4]。Derrick SC等[5]在2013年使用结核分枝杆菌攻击小鼠模型测试了16种抗原,实验结果显示,Rv1626可显著降低实验感染动物的肺、脾脏的荷菌量,能诱导强烈的Th1型细胞免疫,刺激分泌IL-2、TNF-α、INF-γ等細胞因子。通过上调INF-γ激活巨噬细胞,增强其吞噬能力和加工提呈抗原能力,最终有效地杀死M.tb,以及升高IL-2水平以保护宿主抵抗M.tb的感染。可见Rv1626可能是潜在的免疫原性较强的靶抗原,可刺激机体分泌较高水平的抗原特异性Th1型细胞因子。
本研究首次构建并成功克隆表达原核质粒pPROEX-Rv1626,通过人群实验,证实Rv1626诱导ATB者产生的IFN-γ水平显著高于LTBI者,同时刺激ATB和LTBI受试者产生的特异性IFN-γ水平显著高于健康者,提示了Rv1626是可被M.tb 感染人群T细胞所识别的特异性抗原,是具有潜力的疫苗靶抗原。在免疫小鼠9周后以及以BCG初免、Rv1626增强免疫后,均诱导了较高水平的TNF-α、IL-2和IFN-γ,同时Rv1626/DMT组和BCG+Rv1626/DMT组小鼠血清IgG2a /IgG1>1,倾向于Th1型细胞免疫应答。
综上所述,本研究证实了Rv1626可被山西长治市M.tb感染人群T细胞特异性识别。在动物免疫原性实验中检测到实验组抗原特异性Th1型细胞因子水平低于BCG组,可能与Rv1626仅为单个靶抗原、刺激水平不够有关;这也在BCG+Rv1626/DMT组诱导的相关细胞因子水平均显著高于BCG组和Rv1626/DMT组得到了验证。rRv1626可被TB感染人群T细胞所识别、具有较好的免疫原性,为研制M.tb感染人群(尤其是LTBIs)的预防及治疗型疫苗提供了候选靶抗原。本课题研究筛选并构建了M.tb感染复制期优势表达抗原,并对其免疫原性进行了深入分析,为构建包含多阶段抗原的融合疫苗、有效提高其抗M.tb感染的保护性研究奠定了坚实的基础。
参考文献:
[1]Schmit KM,Wansaula Z,Pratt R,et al.Tuberculosis - United States,2016[J].Mmwr Morbidity & Mortality Weekly Report,2017,66(11):289-294.
[2]Singhal N,Bisht D,Joshi B.Immunoprophylaxis of tuberculosis: an update of emerging trends[J].Arch Immunol Ther Exp,2010,58(2):97-106.
[3]Evans TG,Schrager L,Thole J.Status of vaccine research and development of vaccines for tuberculosis[J].Vaccine,2016,34(26):2911-2914.
[4]Reyes PR,Parlane NA,Wedlock DN,et al.Immunogencity of antigens from Mycobacterium tuberculosis, self-assembled as particulate vaccines[J].International Journal of Medical Microbiology,2016,306(8):624-632.
[5]Derrick SC,Yabe IM,Yang A,et al.Immunogenicity and protective efficacy of novel Mycobacterium tuberculosis antigens[J].Vaccine,2013,31(41):4641-4646.
