多活性位点季鏻盐型功能化离子液体的二氧化碳捕集行为
2019-02-13高霞师田田叶翠平李文英
高霞,师田田,叶翠平,,李文英
(1.太原理工大学 环境科学与工程学院,山西 太原 030024;2.太原理工大学 煤科学与技术重点实验室,山西 太原 030024)
由CO2浓度升高造成全球暖化的问题,严重影响人们的生存和健康[1]。分离CO2方法主要有吸附法、膜分离法、低温冷凝法和溶剂吸收法等[2]。其中溶剂吸收法以其吸收速率快、选择性好、吸收容量高、操作简便等优点成为一种成熟的CO2分离方法[3]。但存在二次污染、设备腐蚀、溶剂挥发和能耗高等问题[4]。因此,开发一种绿色的CO2吸收剂已迫在眉睫。
离子液体以其高热稳定性、低挥发性、高的CO2选择性及阴阳离子可设计性等优点[5-6],已用于CO2捕集分离,但仍存在一定问题。张锁江等[7]以3-丙胺-三丁基鏻([aP4443])为阳离子,20种氨基酸为阴离子制备[aP4443][AA]双氨基型功能化离子液体,存在自身粘度大的问题,影响CO2的吸收效果。Wang等[8]以十四烷基三乙基鏻([P66614])为阳离子,咪唑([Im])为阴离子制备[P66614][Im],可以实现等摩尔CO2吸收(80 mg/g,20 ℃),但由于其摩尔质量较大,其吸收值远低于氨基固定化吸附剂(237 mg/g,35 ℃)[9]。现在关于离子液体捕集CO2的研究,较少考察烟气其他组分及CO2浓度对离子液体吸收CO2的影响[10-12]。
为了改善目前所采用的离子液体存在的吸收量低和粘度大等问题,本文选择热稳定性良好且摩尔质量小的三丁基鏻作阳离子,并在阳离子上接入强碱性的NH2作活性位点来吸收CO2;选择含氢少的氮杂环如1,2,4-三氮唑、2-羟基吡啶和2-氨基吡啶作阴离子来降低粘度,同时利用1,2,4-三氮唑的碱性及2-羟基吡啶和2-氨基吡啶的多位点作用,即电负性的氧和氮与吡啶环上的氮协同作用来吸收CO2。优选出具有最佳CO2吸收性能的离子液体,进一步考察温度、CO2浓度和烟气其他组分(氧气和水分)对其CO2捕集性能的影响。
1 实验部分
1.1 试剂与仪器
三丁基鏻、3-溴丙胺氢溴酸盐、1,2,4-三氮唑、2-氨基吡啶、2-羟基吡啶、乙腈、无水乙醇、正己烷、氢氧化钠、强碱性苯乙烯系阴离子交换树脂717、36%~37%盐酸均为分析纯。
TENSOR27型红外光谱(FTIR);HTG-1综合热分析仪。
1.2 多功能化离子液体[aP4443][AA]的合成
根据文献[3],采用两步法制备[aP4443][AA]功能型离子液体,合成路线如下。

①称取适量的三丁基鏻(过量)和3-溴丙胺氢溴酸盐,以乙腈作溶剂混合,在80 ℃,氮气氛围下搅拌冷凝回流48 h,负压旋转蒸发除去乙腈,在80 ℃下真空干燥24 h,得到粗产物。采用正己烷回流洗涤产物,直到无三丁基鏻残留为止,得中间体。②将Cl型阴离子交换树脂进行预处理,得到OH型阴离子交换树脂[13]。将中间体用乙醇溶解,与适量的OH型阴离子交换树脂混合搅拌,待溶液pH>8时,收集碱性滤液。③等分为三份,分别加入等摩尔的2-氨基吡啶、1,2,4-三氮唑和2-羟基吡啶与碱性溶液室温搅拌反应12 h。负压旋转蒸发除去乙醇,在80 ℃下真空干燥24 h,得到离了液体[aP4443][AA],[AA]=[Triz]、[2-Op]、[2-Np]。
1.3 离子液体对CO2的吸收
采用重量法测定纯离子液体对CO2的吸收行为。实验装置见图1,主要包括CO2、N2和O2气体钢瓶、水蒸气发生器、转子流量计、CO2吸收瓶、恒温水浴锅和尾气吸收瓶等。CO2浓度通过转子流量计控制N2和CO2的流量来配制。

图1 CO2 吸收实验装置图Fig.1 Schematic diagram of experimentalapparatus of CO2 capture
1.3.1 CO2吸收量 将圆底烧瓶置于水浴锅内,加热至90 ℃,通入100 mL/min N2吹扫30 min,密封,取出圆底烧瓶,擦干水后称取质量m2。待水浴温度降至30 ℃后,打开CO2气瓶,并调节流量为100 mL/min,待流量稳定后通入圆底烧瓶,等时间间隔(5 min)使用分析天平称取烧瓶质量mt,直至质量变化不超过0.1 mg时,认为达到吸收饱和,关闭CO2气瓶,停止实验。计算离子液体对二氧化碳的吸收量。

(1)
式中n——CO2的摩尔吸收量,mol CO2/mol ILs;
m2——吸收装置的初始质量,g;
mt——t时刻吸收装置的质量,g;
m1——离子液体的质量,g;
MILS——离子液体分子量。
1.3.2 水分对CO2吸收的影响 本实验借助不同温度下水的饱和蒸汽压为定值的理论,使用定流量的气体带出水蒸气[14]。将100 mL/min CO2气体通入到45 ℃(水蒸气含量为9.05%)恒温水中,带出湿润的CO2通入离子液体吸收CO2体系中,考察水分对离子液体吸收CO2的影响。
2 结果与讨论
2.1 季鏻盐功能化离子液体的红外光谱图及热稳定性
2.1.1 红外光谱 图2为[aP4443][Triz]、[aP4443][2-Op]、[aP4443][2-Np]的红外光谱图。
由图2可知,3 420,3 432,3 427 cm-1归属于NH2的反对称振动[15];2 962,2 959,2 963 cm-1归属于CH3的反对称振动[15];2 930,2 936,2 938 cm-1归属于CH2的反对称振动[14];2 870,2 864,2 875 cm-1归属于CH2的伸缩振动[14];720 cm-1归属于CH2的面内摇摆振动[14];1 450,1 463,1 456 cm-1归属于CH3和CH2反对称变形振动[16];1 387,1 386,1 405 cm-1归属于CH3的对称变形振动[14];1 100 cm-1归属于C—P的伸缩振动[17];1 624,1 637,1 641 cm-1归属于NH2变形振动[15-16];901,805,913,805,907,781 cm-1归属于NH2的弯曲振动[18],以上初步证明合成的离子液体具有设计的阳离子结构。1 235,1 145 cm-1归属于1,2,4三氮唑骨架C—N伸缩振动[14];1 598,1 521 cm-1归属于氨基吡啶环骨架振动[19-20];1 231 cm-1归属于与吡啶环相连的NH2的C—N振动[19-20];1 574,1 515 cm-1归属于羟基吡啶环的骨架振动;1 237 cm-1归属于与吡啶环相连的C—O振动[21],以上初步证明合成的离子液体具有设计的阴离子结构。

图2 [aP4443][Triz]、[aP4443][2-Op]、[aP4443][2-Np]红外图谱Fig.2 FTIR spectra of [aP4443][Triz],[aP4443][2-Op],[aP4443][2-Np]
2.1.2 热稳定性 图3为三种离子液体的TGA曲线。
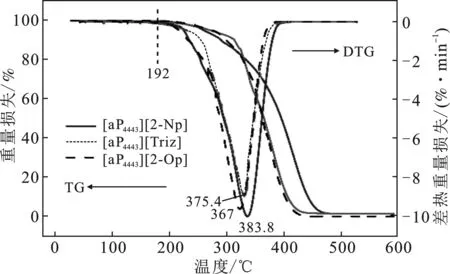
图3 合成离子液体的TG和DTG曲线Fig.3 TG and DTG curves of the synthesized ILs
由图3可知,合成的三种离子液体的热分解温度在200 ℃左右,三种离子液体的热稳定性顺序为[aP4443][2-Op](207 ℃)>[aP4443][2-Np](200 ℃)>[aP4443][Triz](192 ℃)。相同阳离子条件下([aP4443]+),阴离子为[Triz]-时的热稳定性较其他两种阴离子低8~15 ℃,推测可能是组成[aP4443][Triz]的阴阳离子间的相互作用力较弱,如静电力,使热稳定性降低[22]。由上可知,三者开始分解的温度均超过190 ℃,热稳定性良好。
2.2 离子液体对CO2的吸收性能
三种离子液体在30 ℃常压条件下,对纯CO2的吸收量随时间的变化见图4。

图4 离子液体在30 ℃,常压下对纯CO2的摩尔吸收曲线Fig.4 Pure CO2 molar absorption curves of ILs at 30 ℃
由图4可知,[aP4443][2-Np]在60 min后达到吸收饱和,[aP4443][2-Op]和[aP4443][Triz]分别在40 min和50 min后达到吸收饱和。离子液体吸收CO2的快慢主要决定于气相和液相间的传质速率,[aP4443][2-Np]的粘度较其他两种离子液体大,所以达到吸收饱和的时间长。[aP4443][Triz]、[aP4443][2-Np]和[aP4443][2-Op]对纯CO2的饱和吸收量分别为1.32,1.88,1.57 mol CO2/mol ILs。这可归因于[Triz]-对CO2的吸收活性位点只有一个,而[2-Op]-和[2-Np]-可以通过协同促进作用吸收CO2,因此[aP4443][Triz]的饱和吸收量较小。[aP4443][2-Np]的阴离子上还有一个NH2基团,其碱性高于[aP4443][2-Op],所以,[aP4443][2-Np]的CO2饱和吸收量最大,且优于文献报道值(表1)。因此,后续研究中,选择[aP4443][2-Np]进行研究。

表1 不同功能化ILs对CO2吸收饱和容量Table 1 Comparison of CO2 absorption capacityinto functionalized ILs
2.2.1 温度对[aP4443][2-Np]吸收CO2性能的影响 烟气经过脱硫后温度低于80 ℃,选取40,50,60,70 ℃四个温度点,来考察温度对离子液体[aP4443][2-Np]吸收CO2性能的影响。图5为[aP4443][2-Np]在常压、气体流量为100 mL/min条件下的CO2吸收变化曲线。

图5 常压、不同温度下[aP4443][2-Np]对纯CO2的摩尔吸收曲线Fig.5 Pure CO2 molar absorption curves of [aP4443][2-Np]atatmospheric pressure and different temperatures
由图5可知,随着温度升高,[aP4443][2-Np]的CO2饱和吸收量逐渐降低,离子液体对CO2的吸收是可逆的,CO2与阴阳离子上的活性位点形成NHCOO-和NCOO-,随着温度升高,已形成的氨基甲酸基团会发生分解,已吸收的CO2被释放,导致CO2的饱和吸收量减少。但随着温度升高,达到吸收饱和的时间逐渐缩短,当温度升至60 ℃和70 ℃时,在40 min内可以达到吸收饱和。离子液体对CO2吸收的快慢主要取决于CO2的扩散速率,温度升高,会降低离子液体的粘度,利于气相和液相的传质过程。
2.2.2 CO2浓度对[aP4443][2-Np]吸收CO2性能的影响 电厂烟气中CO2分压不高,通常含量低于15%。因此,实验考察了常压、50 ℃,气体总流量为100 mL/min条件下[aP4443][2-Np]对10%,12%和15%的CO2/N2的吸收性能,结果见图6。

图6 [aP4443][2-Np]在常压下,50 ℃下对不同浓度CO2摩尔吸收曲线Fig.6 Different concentration of CO2 molar absorptioncurves of pure ILs at atmospheric pressure,50 ℃
由图6可知,与纯离子液体在50 ℃对100% CO2的饱和吸收量比较(图5)可知,当CO2浓度降低时,[aP4443][2-Np]对CO2饱和吸收量呈现降低的趋势。CO2浓度低时,单位时间内与离子液体活性位点接触的CO2数量减少,达到吸收饱和的时间逐渐增加。因此,CO2含量降低,不利于[aP4443][2-Np]对CO2的吸收。
2.2.3 模拟烟气中水分和氧气对[aP4443][2-Np]吸收CO2性能的影响 图7是50 ℃,常压下,烟气其他组分水分和氧气存在时,[aP4443][2-Np]对CO2吸收量。

图7 常压、50 ℃下水分和氧气对[aP4443][2-Np]吸收CO2的影响Fig.7 Effect of water vapor and O2 on the absorption ofCO2 by [aP4443][2-Np] at atmospheric pressure,50 ℃
由图7可知,水分和氧气的存在会抑制离子液体[aP4443][2-Np]对CO2的吸收。当单因素水分存在时,[aP4443][2-Np]对CO2的饱和吸收量由1.56 mol CO2/mol ILs降到1.40 mol CO2/mol ILs,降低了10.2%。这是由于离子液体属于极性溶剂,对水的吸收能力较强,水分会与CO2产生竞争吸收,从而减少CO2与活性位点的接触[25]。此外,水分子会与[aP4443][2-Np]中的氨基形成氢键网络结构,阻碍CO2的进入[26]。由于水分可以降低离子液体的粘度,促进气液间的传质,因此有水分存在时,达到吸收饱和的时间从45 min缩短到35 min。当只有氧气和CO2(5%O2/95%CO2)存在时,CO2的饱和吸收量由1.56 mol CO2/mol ILs降到1.52 mol CO2/mol ILs,降低了2.5%。O2对离子液体吸收CO2的影响主要是氧化离子液体中的官能团,如将氨基氧化为酰亚胺和氨基化合物,对CO2失去吸收作用,同时不能通过升温去除钝化[27]。一般认为,氧化降解一般发生在100 ℃以上,而实验选取温度为50 ℃,[aP4443][2-Np]阴阳离子中虽然均含有氨基功能团,但发生氧化降解的可能性较小。其中,CO2的饱和吸收量微小降低可归因于O2的存在会稀释CO2气体,导致CO2在单位时间与离子液体上的活性位点接触量减少。当氧气和水分同时存在时(9%H2O/5%O2/86%CO2),CO2饱和吸收量从1.56 mol CO2/mol ILs降低到1.30 mol CO2/mol ILs,较单纯水分或者O2存在时,CO2吸收量降低更明显,相比干燥CO2吸收量降低了16.7%,这一方面可归因于水分占据离子液体上的活性位点,同时由于CO2在混合气中占比降低,单位时间与活性位点的接触量减少,二种因素同时作用,加大了[aP4443][2-Np]对CO2吸收的影响。
3 结论
(1)实验制备的三种季鏻盐型功能化离子液体热稳定性良好,且均表现出较好的CO2吸收性能。CO2的吸收能力由高到低为[aP4443][2-Np]>[aP4443][2-Op]>[aP4443][Triz]。在30 ℃、常压条件下,[aP4443][2-Np]的CO2饱和吸收量可达到1.88 mol CO2/mol ILs。
(2)温度、浓度和烟气中其他成分对[aP4443]-[2-Np]的CO2捕集过程均有影响。升高温度和有水存在时,可以促进传质过程,但吸收量下降;CO2浓度降低,达到吸收饱和的时间增加,且吸收量下降,O2存在时,影响不显著。
