p57KIP2、p53、C-erbB-2在子宫内膜样癌中的表达及与临床病理特征的关系
2019-02-12张春英罗祖强周正平陈春兵
张春英,罗祖强,周正平,陈春兵,袁 丹
(1.遵义医科大学 病理学教研室,贵州 遵义 563099;2.遵义医科大学 电镜室,贵州 遵义 563099;3.贵州省第二人民医院 妇产科,贵州 贵阳 550001)
子宫内膜癌是女性中第四大恶性肿瘤,尽管医疗技术的进步改善了患者的存活率,但其死亡率仍在增加,并且趋向于影响年轻女性[1]。子宫内膜癌最常见的组织学类型是子宫内膜样癌(Endometrial adenocarcinoma,EA)。研究发现,EA的发病因素,除了与女性内分泌调控因素有关,还与细胞周期失控、癌基因和抑癌基因表达水平的异常密切相关,然而,其具体病因还不十分清楚。
p57KIP2、表皮生长因子受体2(C-erbB-2)与肿瘤的发生、发展、转移等密切相关,p53的突变或异常表达是诱导肿瘤的重要机制[2]。关于联合检测p53、C-erbB-2在人类其他恶性肿瘤中的表达研究较多,在EA中表达的研究较少,且联合检测p57KIP2、p53、C-erbB-2在EA中表达的研究,目前在国内外尚未见报道。本研究拟选用存档的EA组织100例,另选取正常子宫内膜(增生期、分泌期各30例)作为对照,采用免疫组织化学Envision法检测p57KIP2、p53 及C-erbB-2蛋白在EA中的表达及与临床病理特征的相关性,从而为临床判断患者的生物学行为提供一定的实验数据。
1 资料与方法
1.1 标本来源 标本来源于2014年1月至2017年12月遵义医科大学附属医院病理科和贵州省第二人民医院病理科确诊为EA的存档石蜡包埋组织,从中选取未行放疗、化疗及内分泌等治疗的标本组织100例。病理检查结果均由2名具有丰富临床工作经验的病理医师进行最后确诊。患者年龄32~80岁,中位年龄50.20岁。根据2014年WHO女性生殖系统肿瘤进行分级[3]:组织学Ⅰ级(39例)、Ⅱ级(40例)、Ⅲ级(21例)。盆腔淋巴结肿大48例,其中转移(18例)和无转移(30例);子宫肌层浸润深度:深肌层浸润(浸润深度≥1/2)(30例)和无或伴浅肌层浸润(浸润深度<1/2)(70例)。根据2014年FIGO病理分期[4]:Ⅰ~Ⅱ期76例,Ⅲ~Ⅳ期24例。随机选取门诊诊刮或因卵巢囊肿等病变进行子宫切除的正常子宫内膜(增生期、分泌期各30例)作为对照组。
1.2 试剂 鼠抗人p57KIP2单克隆抗体(工作浓度1∶75)、鼠抗人C-erbB-2单克隆抗体(工作浓度1∶100)、鼠抗人p53单克隆抗体(工作浓度1∶150)以及免疫组化试剂盒均购自福州迈新生物技术开发有限公司。
1.3 方法 将存档组织石蜡包埋,切片4μm厚,行Envision法染色。根据说明书步骤进行操作。组织均采用高压进行抗原修复。用PBS代替一抗作为空白对照,公司提供的阳性组织作阳性对照。
1.4 结果判断 以出现黄色或棕褐色颗粒为阳性表达,p57KIP2、p53蛋白阳性表达主要位于细胞核,C-erbB-2蛋白位于细胞膜。每张切片任意选取10个高倍视野,计数1 000个细胞,根据阳性细胞数所占的百分比进行判断:阳性细胞数≥10%为阳性(+),低于此百分比则为阴性(-)[5]。
1.5 统计学方法 采用SPSS 20.0统计软件分析。资料均为分类资料采用χ2检验,关联强度用Spearman Correlation关联系数描述。当P≤0.05,表示结果有统计学意义,两两比较的检验水准调整为0.017。
2 结果
2.1 p57KIP2、p53与C-erbB-2蛋白在EA及增生期、分泌期组织中的表达 p57KIP2蛋白在EA组织中阳性表达率为30%,在增生期组织中阳性表达率为3.3%,分泌期组织中阳性表达率为93.3%,3组总体差异比较有统计学意义(P<0.05);增生期中的阳性率低于分泌期中的阳性率(χ2=48.654,P<0.001),增生期中的阳性率低于EA组织中的阳性率(χ2=9.037,P=0.003),分泌期中的阳性率高于EA组织中的阳性率(χ2=37.460,P<0.001)。
p53蛋白在EA组织中阳性表达率为59%,在增生期组织中阳性表达率为3.3%,分泌期组织中不表达,3组总体差异比较有统计学意义(P<0.05);在增生期中的阳性率高于分泌期中的阳性率(χ2=1.017,P=0.313),增生期中的阳性率低于EA组织中的阳性率(χ2=28.774,P<0.001),分泌期中的阳性率低于EA组织中的阳性率(χ2=32.408,P<0.001)。
C-erbB-2蛋白在EA组织中阳性表达率为50%,在增生期中阳性表达率为6.7%,分泌期中阳性表达率为3.3%,3组总体差异比较有统计学意义(P<0.05);增生期中的阳性率高于分泌期中的阳性率(χ2<0.001,P>0.999),增生期中的阳性率低于EA组织中的阳性率(χ2= 18.056,P<0.001),分泌期中的阳性率低于EA组织中的阳性率(χ2=21.080,P<0.001,见表1、图1)
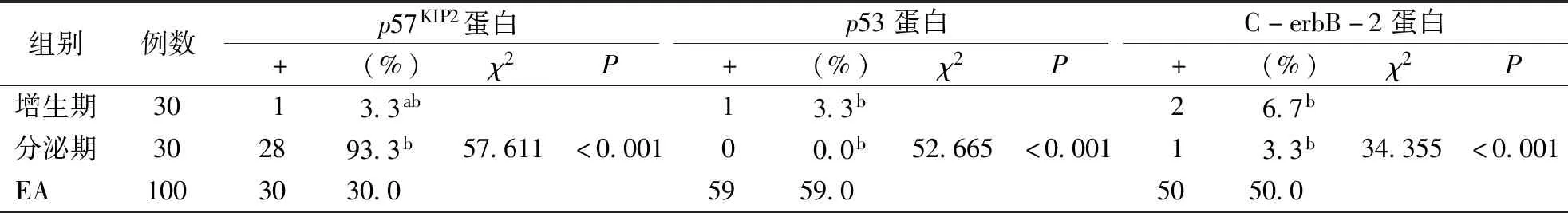
表1 p57KIP2蛋白、p53蛋白和C-erbB-2蛋白在不同子宫内膜组织中的表达
a:与分泌期比较,P≤0.017;b:与EA比较,P≤0.017。

A:p57KIP2蛋白阳性表达;B:p53蛋白阳性表达;C:C-erbB-2蛋白阳性表达;×400。图1 p57KIP2、p53与C-erbB-2在EA组织中阳性表达
2.2 p57KIP2、p53与C-erbB-2蛋白表达与EA临床病理特征的关系 在EA组织中,p57KIP2、p53、C-erbB-2蛋白与组织学分级总体比较,差异均有统计学意义(P<0.05);p57KIP2蛋白在Ⅰ级中表达最高,在Ⅲ级中表达最低,但仅在Ⅰ级和Ⅲ级、Ⅱ级和Ⅲ级中比较有统计学意义(P≤0.017);p53和C-erbB-2蛋白在Ⅲ级中表达最高,在Ⅰ级中表达最低,但p53蛋白在组织学分级间两两比较均无统计学意义(P>0.017);C-erbB-2蛋白仅在Ⅰ级和Ⅱ级、Ⅰ级和Ⅲ级中比较,差异有统计学意义(P≤0.017);p57KIP2蛋白在无或浅肌层中的阳性表达高于深肌层(P<0.05);p53和C-erbB-2在深肌层中的阳性表达高于无或浅肌层中(P<0.05);手术分期中,p57KIP2在Ⅰ~Ⅱ期的阳性表达高于Ⅲ~Ⅳ期(P<0.05);C-erbB-2在Ⅲ~Ⅳ期中的阳性表达高于Ⅰ~Ⅱ期(P<0.05),p53蛋白的表达与手术分期无统计学意义(P>0.05);三者均与年龄和是否有盆腔淋巴转移无关(P>0.05,见表2)。
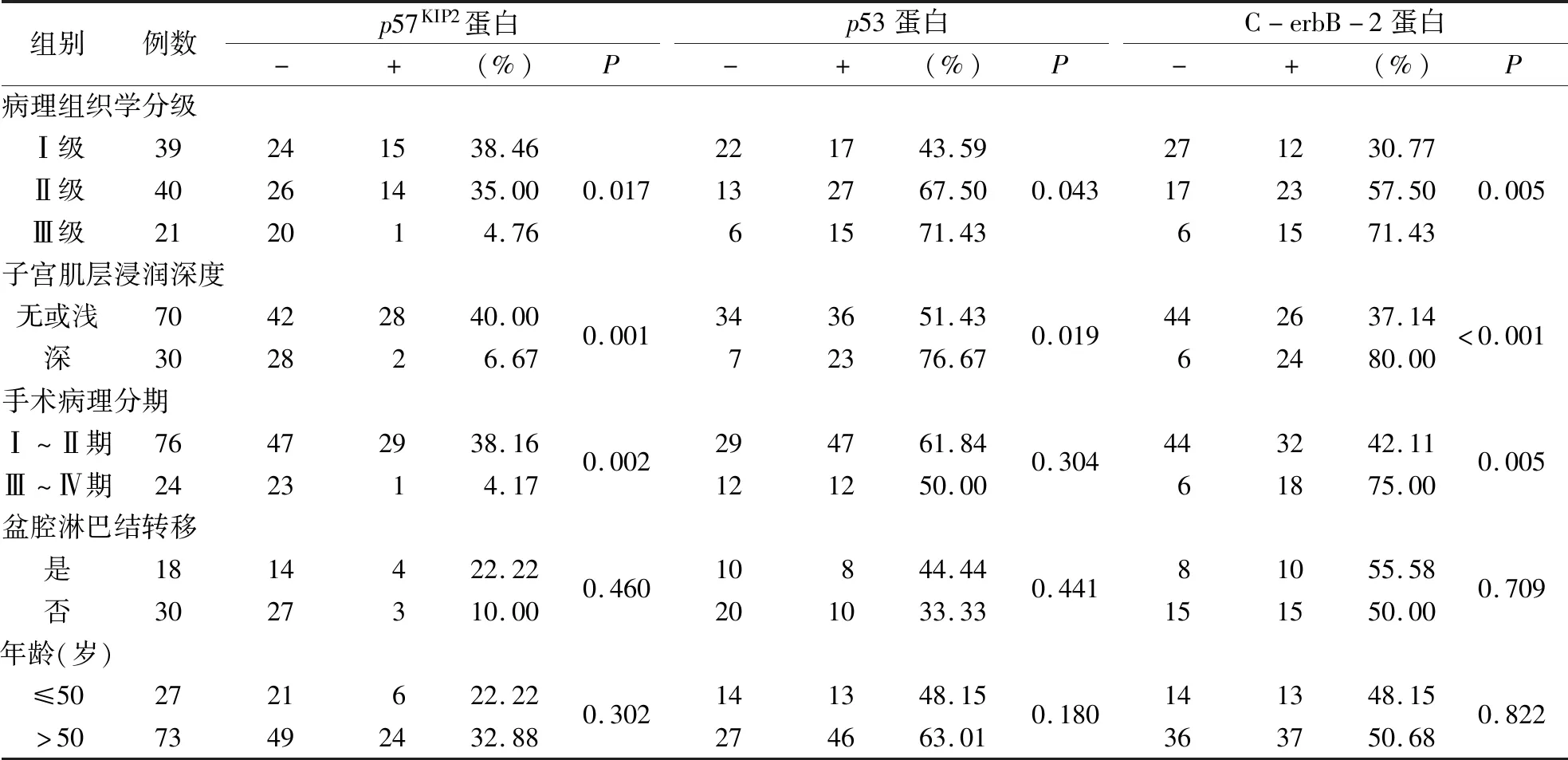
表2 p57KIP2、p53与C-erbB-2蛋白表达与EA临床病理特征的关系
2.3 p57KIP2、p53与C-erbB-2蛋白在EA中表达的相关性分析 p57KIP2与p53蛋白之间的表达无关联(P>0.05)、p57KIP2与C-erbB-2蛋白之间的表达无关联(P>0.05);p53和C-erbB-2蛋白之间的表达呈正相关(P<0.05,见表3~5) 。

表3 p57KIP2与 p53 蛋白在EA中的表达的相关性分析(n=100)

表4 p57KIP2与C-erbB-2在EA中的表达的相关性分析(n=100)

表5 p53与C-erbB-2蛋白在EA中的表达的相关性分析(n=100)
3 讨论
p57KIP2是新近发现的细胞周期蛋白依赖性激酶抑制剂CIP/KIP家族成员,通过阻断G1期进展,发挥抗肿瘤作用,它的低表达或缺乏,促进了恶性肿瘤的发生[6-7]。在肝癌、乳腺癌、前列腺癌等多种癌症中都存在p57KIP2表达的下调或缺乏[8-10]。Kim等[11]研究显示,p57KIP2在分泌期子宫内膜中显著增加,在增生期中最低,而张苗等[12]研究认为,p57KIP2在增生期组织中高表达,在EA组织中低表达。本研究结果显示,p57KIP2在分泌期子宫内膜中阳性表达最高,在增生期中阳性表达最低,在EA组织中的阳性表达介于分泌期、增生期组织中的表达,与Kim等研究相似,但与张苗等研究不一致,可能与张苗未选用分泌期组织,且样本量较少有关。p57KIP2的这种变化,可能与女性激素的诱导有关,表明了p57KIP2主要参与细胞的分化而非增殖。本研究在分析p57KIP2与EA临床病理特征的关系中显示:EA组织学分级越高、手术分期越晚、肌层浸润越深,p57KIP2表达越低,表明了随着p57KIP2的衰减,对内膜细胞增殖的抑制作用也逐渐减弱,导致其向分化更差、分期更晚的方向发展。提示在EA的发生发展过程中可能有p57KIP2的参与,它的高表达可能提示低病理组织学分级和手术分期,且不易发生深肌层浸润。
促凋亡基因p53,参与细胞周期的调节与凋亡,直接或间接控制细胞周期相关基因和凋亡基因的表达,发挥抗肿瘤作用。但p53易发生突变,在所有人类肿瘤中发现了超过50%的基因变异[13]。突变的p53转变为癌基因获得新的致癌特性,导致细胞增殖异常和癌变[14]。有研究显示:在突变型p53的影响下,子宫内膜可跳过增生改变迅速发展成癌[15]。p53的突变和异常蛋白的表达常发生在内膜癌晚期,据此我们可以对内膜癌的恶性情况作出一定的评估[16]。子宫内膜息肉显示异常p53的患者更可能患有子宫内膜癌[2]。C-erbB-2是一种致癌基因,编码185-kPa蛋白,通过上调血管通透因子和血管内皮生长因子抑制细胞凋亡,形成肿瘤血管,通过根除身体组织的抗侵袭屏障来增加肿瘤侵袭性,参与了肿瘤的发病机制[17]。C-erbB-2及其蛋白质产物(P185)在多种肿瘤组织中如乳腺癌、胃癌和卵巢癌等都存在高表达和扩增[18-20],其过表达加速了癌细胞的扩散。本研究显示:p53、C-erbB-2在EA组织中表达最高,在分泌期子宫内膜组织中表达最低,且两种蛋白的阳性表达随着病理组织学分级、手术分期和癌组织浸入子宫肌层深度的增加呈递增式的表达,提示p53、C-erbB-2与EA的发展密切相关,两种蛋白表达越高,EA预后越差。p53蛋白在组织学分级中两两比较无统计学意义,提示可能需进一步扩大样本量再进行观察比较。
然而一种肿瘤的发生更多表现为多基因联合作用的结果。p57KIP2、p53和C-erbB-2之间可相互作用、相互影响,产生联结效应,共同参与肿瘤的发生机制。p57KIP2的缺乏导致T细胞发育受阻,其缺失和p53的过度活化,加速了淋巴瘤的发展[21]。在食管鳞状细胞癌中,p57KIP2和p53存在显著的负相关,p57KIP2的低表达和p53的高表达提示患者预后不良[22]。p53和C-erbB-2在滋养细胞肿瘤组织中表达越高预后可能越差,根据其表达情况可预判滋养细胞肿瘤的生物学行为[23];在结直肠癌患者中,同样也存在p53和C-erbB-2的表达,二者表达越高,预后越差[24]。本研究中,我们还发现,p53、C-erbB-2蛋白在EA中表达呈正相关,且在EA组织中的阳性表达远远高于在增生期、分泌期等正常子宫内膜组织中的表达,意味着两种蛋白可能在子宫内膜组织的恶性转化过程中发挥了共同的促进作用。
肿瘤的复发和转移严重威胁着人类的健康,对肿瘤患者预后的判断及治疗极其重要。然而,在评估肿瘤预后方面,分析多因素指标比单一指标更具有指导意义。我们的研究结果发现,p57KIP2、p53和C-erbB-2可能共同参与了EA的发生发展。在EA组织中,p57KIP2表达越低、C-erbB-2和p53表达越高,意味着患者有较高的组织学分级、肌层浸润较深、手术分期较晚,预示EA患者可能有更差的预后。因此,通过联合检测EA患者癌组织中p57KIP2、p53与C-erbB-2蛋白的表达情况,对于指导临床评估EA患者的治疗和预后有较为积极的指导意义。
