响应面法优化贝莱斯芽孢杆菌CY30发酵培养基的研究
2019-01-11刘芳廖先清周荣华陈伟饶犇黄大野
刘芳 廖先清 周荣华 陈伟 饶犇 黄大野


摘要:为了对贝莱斯芽孢杆菌(Bacillus velezensis)CY30的发酵培养基进行优化以提高芽孢产量,应用Plackett-Burman设计法对影响贝莱斯芽孢杆菌CY30芽孢形成的关键因子进行筛选,通过最陡爬坡路径法确定主要影响因素的响应中心点,并进一步采用中心组合设计和响应面分析法确定最优培养基。结果表明,该菌株芽孢产量的关键影响因素为甘薯粉和酵母膏的浓度。通过响应面分析法的拟合和推算得到,甘薯粉和酵母膏浓度分别为37.35 g/L和15.29 g/L时,模型预测发酵最佳产量为91.2亿CFU/mL,验证值为97.5亿CFU/mL,预测值与验证值之间吻合较好,比优化前实际产量(63.8亿CFU/mL)提高了53%。
关键词:贝莱斯芽孢杆菌(Bacillus velezensis)CY30;发酵培养基;优化;芽孢数;响应面法
中图分类号:Q939.92 文献标识码:A
文章编号:0439-8114(2019)23-0091-04
DOI:10.14088/j.cnki.issn0439-8114.2019.23.021 开放科学(资源服务)标识码(OSID):
Study on optimization of fermentation medium of Bacillus velezensis CY30
by using response-surface method
LIU Fang,LIAO Xian-qing,ZHOU Rong-hua,CHEN Wei,RAO Ben,HUANG Da-ye
(Hubei Biopesticide Engineering Research Centre,Wuhan 430064,China)
Abstract: To optimize the fermentation medium of Bacillus velezensis CY30 for enhancing the spore counts in the fermentation broth, the key factors among the media components were investigated by using Plackett-Burman(PB) design. The central axises of these factors were determined by using steepest-ascent method. The optimized medium for Bacillus velezensis CY30 was determined by central combination design and response surface method. The results demonstrated that the key factors influcening the spore counts in fermentation broth were sweet potato powder and yeast extract. The optimized medium was obtained through response surface analysis was 37.52 g/L of sweet potato powder, 15.29 g/L of yeast extract. The estimated maximum spore counts was 9.12 billion CFU/mL, while the real spore counts was 9.75 billion CFU/mL in shake-flask fermentation. The spore counts of the fermentation broth with optimized medium was 53% higher than that before the optimization(6.38 billion CFU/mL).
Key words: Bacillus vezelensis CY30; fermentation medium; optimization; spore count; response-surface method
芽孢桿菌(Bacillus)广泛存在于自然界,是重要的农作物病虫害生物防治因子,并广泛开发为活体微生物农药,用于农作物病虫害的防治[1]。作为芽孢杆菌属中的一种,贝莱斯芽孢杆菌(Bacillus velezensis)最早由Ruiz-Garcia等[2]从采自西班牙贝莱斯河的水样中分离获得,可产生表面活性剂。后续研究者从不同的生态环境中分离到贝莱斯芽孢杆菌,并发现其对多种植物病原真菌、黄单胞菌及马铃薯疮痂病菌等具有抑菌活性[3]。贝莱斯芽孢杆菌还可用作絮凝剂、食品发酵剂,并用于表面活性剂的生产[3]。笔者所在研究团队在前期的研究中从茶树根际土壤中分离到贝莱斯芽孢杆菌CY30菌株,其对多种植物病原真菌具有较强的抑菌活性,并对茶轮斑病具有一定的防效,表明其具有一定的开发价值。通过对贝莱斯芽孢杆菌CY30发酵培养基的优化,提升该菌株的发酵水平,可加快该菌株的产业化进程。
不同的微生物对营养的需求各不相同,在微生物工业化生产之前,必须要对其发酵培养基及培养条件进行优化。微生物发酵培养基的优化方法种类众多,其中以响应面法能够快速有效地确定发酵培养基的组成及培养条件。本研究以自主分离获得的贝莱斯芽孢杆菌CY30菌株为研究对象,对其培养基配方进行Plackett-Burman试验,筛选显著的影响因子,然后通过中心组合设计和响应面分析,获得最优培养基组合,以期为该菌株的扩大生产及产业化发展提供支撑。
1 材料与方法
1.1 供试菌株
贝莱斯芽孢杆菌CY30菌株由湖北省生物农药工程研究中心从湖北省恩施土家族苗族自治州鹤峰县茶园根际土壤分离得到并保存于武汉大学中国典型培养物保藏中心,菌种保藏编号为CCTCC M2018710。
1.2 供试培养基
供试培养基的组成:①LB琼脂培养基。胰蛋白胨10 g,氯化钠5 g,酵母提取物5 g,琼脂粉20 g,去离子水1 L,pH 7.0。②种子培养基。LB液体培养基,500 mL 三角瓶装液量为100 mL。③初始发酵培养基。淀粉15 g,豆粕20 g,碳酸钙1.0 g,硫酸镁0.3 g,磷酸二氢钾0.1 g, 去离子水1 L,pH 7.5,500 mL三角瓶装液量为50 mL。
1.3 摇瓶培养
斜面菌种30 ℃活化后接种一环入LB液体培养基中,在温度30 ℃、摇床转速180 r/min条件下培养16 h,按2%(V/V)接种量再接入到发酵培养基中摇床培养到芽孢脱落分离20%时停止。
1.4 芽孢数的测定
培养结束后发酵液芽孢数采用稀释涂布平板计数法测定,稀释液涂布LB平板前置于80 ℃水浴20 min。
1.5 试验方法
1.5.1 Plackett-Burman设计 采用Minitab的Plackett-Burman两水平法对培养基成分进行考察,筛选影响生物量和芽孢产量的重要因素,确定最佳配方。
1.5.2 最陡爬坡试验 根据Plackett-Burman试验得出的拟合方程安排最陡爬坡试验来确定因素取值中心点。拟合方程中各变量系数确定爬坡方向和变化步长,另外步长确定亦与试验条件相关。
1.5.3 中心组合设计和响应面分析 对Plackett-Burman试验确定的因素以最陡爬坡试验得到的中心点,根据中心组合设计原理安排响应面试验获得重要因素的最佳配方水平。根据中心组合设计结果来拟合数据,得到描述响应值和自变量之间关系的二阶模型,即:
式中,Y是產物能力测量值,X为因素,b0是截距,bi、bj是关键因素i、j线性效果的系数,bii是关键因素的二次效应的系数,bij是关键因素间交互作用的系数。
根据拟合的数学模型以及方差分析的结果可以评价每个因子及其交互作用对过程的影响程度,利用响应面图和等高线图直观地描绘其结果,同时利用拟合的数学方程求解最优结果。
1.5.4 培养基优化结果的验证试验 用优化后的培养基组分配制发酵培养基,摇瓶发酵结束后测定发酵液的芽孢数。
1.5.5 200 L罐发酵 用优化后的培养基组分配制发酵培养基,投料体积120 L,消泡剂0.2%,灭菌前pH 7.5,1×105 Pa灭菌30 min。待温度降至32 ℃时接入1%(V/V)的种子液,通气比1∶(0.5~1.2),罐压0.5×105 Pa,培养温度30~32 ℃,搅拌常开。发酵过程中取样镜检,芽孢脱落分离20%时结束发酵,发酵液在5 000 r/min条离心10 min,弃部分上清液,得到3倍浓缩液,浓缩液真空冷冻干燥得到冻干粉,测定发酵液和冻干粉的芽孢数。
2 结果与分析
2.1 Plackett-Burman试验设计
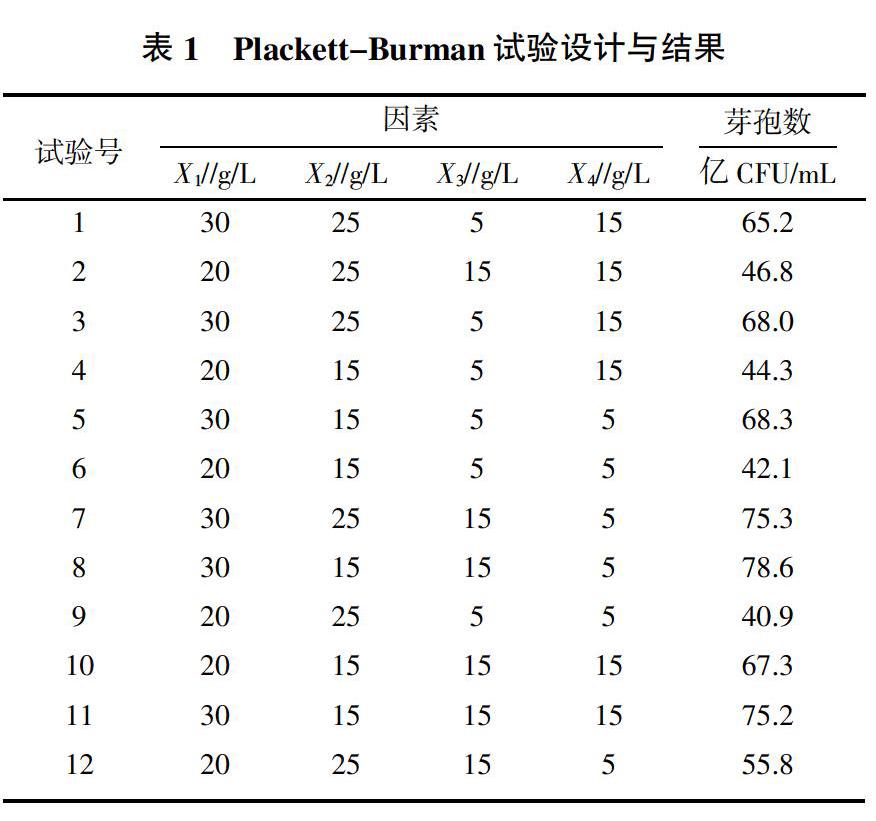
根据前期单因素试验结果,确定以甘薯粉为碳源(X1),以花生粕(X2)、酵母膏(X3)、工业蛋白胨(X4)为氮源,共4种因素一起进行Plackett-Burman设计试验,设计方案和试验结果见表1。
由检验结果(表2)t可知,甘薯粉和酵母膏对CY30的生长和芽孢形成有显著影响,可信度在90.70%以上,且两者对芽孢形成的影响是正效应。
由表2得到的回归方程如下:
Y=60.650+11.117X1-1.983X2+5.850X3+0.483X4
方程拟合的相关性R2=96.74%,表明此方程能很好地模拟和解释Plackett-Burman的试验结果。
2.2 最速爬坡试验
找到对产物发酵影响最大的因素后,需要进一步地对这些因素进行分析。最常用的分析方法就是响应面分析,但该方法是一种局部的分析方法,是在一定范围内根据试验求得最优解。所以在进行响应面分析试验前首先应当通过试验找到最优值附近的区域,在此区域内再进行响应面试验。
利用最速上升法试验可以实现这样的目的,最速上升法以前述Plackett-Burman设计试验得到的一次方程为基础,以相应因素的系数比为基准进行步移,直到步移至最高点,然后以最高点附近的范围作为响应面优化的相应范围。从Plackett-Burman设计试验所得方程中甘薯粉和酵母膏的系数(X1为11.117,X3为5.850)可算得这两个因素步移的步长比为1∶0.526,即当甘薯粉步移1个单位(5 g/L)时,酵母膏步移0.526个单位(2.63 g/L)。以Plackett-Burman设计中的中心点(甘薯粉为25 g/L;酵母膏为10.00 g/L)作为步移的起点,试验设计与结果如表3所示。由表3可知,开始时CY30芽孢产量随着甘薯粉与酵母膏的升高而增加,在步移进行至第三步时达到最高点,之后CY30芽孢产量开始下降。步移最高点时甘薯粉与酵母膏的浓度分别为35 g/L和15.26 g/L,这一点被用作下一步响应面分析的中心点。
2.3 中心组合设计试验及响应面分析
由Plackett-Burman试验可知,影响CY30芽孢产量的两个重要因素分别是甘薯粉与酵母膏。根据中心优化组合方法,设计了2因素5水平的响应面分析(RSA),试验设计见表4,共13组试验。
以甘薯粉和酵母膏为自变量,以CY30菌株产生的芽孢数(Y)为响应值,根据分析结果得到的二次多项式回归方程为:
Y=-84.660+4.817X1+2.842X2-1.455X12+2.120
X22-3.025X1X2
利用Minitab软件对回归模型进行响应面分析,考察所拟合响应面的形状,得到各响应面立体分析图和相应等高图,见图1和图2。由图及软件分析可知该模型具有最大值,利用Minitab软件响应优化器进行计算可得,最大值处X1=37.35 g/L,X2=15.29 g/L,在此条件下理论预测得到CY30菌株产生的芽孢数为91.2亿CFU/mL。
2.4 最佳培养基的验证
为了确定试验结果的可靠性,对上述优化培养基进行了验证试验,共做3组平行试验,CY30芽孢杆菌的芽孢数为97.5亿CFU/mL,与预测值十分接近,比优化前实际产量(63.8亿CFU/mL)提高了53%。
2.5 200 L罐发酵
发酵周期36 h,发酵28 h时取样镜检,芽孢形成率为98%,菌体大小整齐;放罐时取样镜检,约20%芽孢脱落,芽孢整齐。发酵液芽孢数为120亿CFU/mL,较摇瓶发酵提升了30%以上。利用200 L发酵罐发酵液制备的冻干菌粉的芽孢数为31.2亿CFU/g。
3 讨论
芽孢数是芽孢杆菌生防菌剂的一个重要质量指标,而芽孢的产生受到培养基的组成及培养条件的影响。本研究表明,影响芽孢杆菌 CY30菌株产生芽孢的关键因素为甘薯粉与酵母膏,通过优化获得CY30菌株最佳培养基配方为甘薯粉37.35 g/L、花生粕15.00 g/L、酵母膏15.29 g/L、工业蛋白胨15.00 g/L、碳酸钙1.00 g/L、硫酸镁0.30 g/L、磷酸二氢钾0.10 g/L、pH 7.5。甄新武等[4]的研究表明,芽孢杆菌Z-27菌株的优化培养基为玉米粉2.0%、豆饼粉1.5%、 MnSO4·H2O 0.07%,在最适条件下的发酵水平约为20亿芽孢/mL。李姝江等[5]通过优化获得了芽孢杆菌 ZJ-20菌株的发酵培养基和培养条件,在最适条件下的发酵水平为7.69×109芽孢/mL。杨可等[6]利用响应面法对芽孢杆菌TCS001菌株的发酵培养基进行了优化,获得了优化培养基组成为蛋白胨10.0 g/L、葡萄糖12.5 g/L、牛肉浸膏4.0 g/L、酵母粉1.0 g/L,大幅提升了發酵液对黄瓜灰霉病菌病斑的抑制率。本研究所得培养基组成与他们的研究存在明显的差异,表明不同来源的芽孢杆菌菌株的营养需求不相同,而且发酵水平也存在较大差异。
对植物病原菌具有拮抗活性的芽孢杆菌菌株通过产生脂肽[7]、挥发性抑菌物质[8]、葡聚酶[9]或抑菌蛋白[10]等来抑制病原菌的生长。本研究仅针对芽孢数来对发酵培养基进行优化,获得了高产芽孢的培养基优化配方。但培养条件,包括转速、溶氧、pH及发酵温度对芽孢的形成及抑菌活性物质的产生影响也较大。下一步还要结合CY30菌株所产生的抑菌活性物质对培养基及培养条件作进一步的优化,为该菌株的工业化生产提供技术支撑。
参考文献:
[1] 王 春,汪 琨,崔志峰.芽孢杆菌活体微生物农药研究现状及应用[J].浙江农业科学,2013(7):830-834.
[2] RUIZ-GARCIA C,BEJAR V,MATINEZ-CHECA F,et al. Bacillus velezensis sp. nov.,a surfactant-producing bacterium isolated from the river Velez in Malaga,southern Spain[J].Intl J Syst Evol Microbiol,2005,55(1):191-195.
[3] 张彩文,程 坤,张 欣,等.贝莱斯芽胞杆菌(Bacillus velezensis)分类学及功能研究进展[J].食品与发酵工业,2019,45(17):258-265.
[4] 甄新武,乔均俭.BP神经网络结合正交试验法优化Bacillus velezensis Z-27菌株培养基组分[J].湖北农业科学,2013,52(3):3109-3112.
[5] 李姝江,王淋敏,谯天敏,等.利用响应面法优化贝莱斯芽孢杆菌ZJ20发酵参数[J].西北农林大学学报(自然科学版),2019,47(2):1-9.
[6] 杨 可,司 文,林 海,等.利用响应面分析法优化贝莱斯芽孢杆菌TCS001的发酵条件[J].农药学学报,2019,21(4):444-452.
[7] LUO C,CHEN Y,LIU X,et al. Engineered biosynthesis of cyclic lipopeptide locillomycins in surrogate hot Bacillus velezensis FZB42 and derivative strains enhance antibacterial activity[J].Appl Microbiol Biotechnol,2019,103(11):4467-4481.
[8] LIM S M,YOON M Y,CHOI G J,et al. Diffusible and volatile antifungal compounds produced by an antagonistic Bacillus velezensis G341 against various phytopathogenic fungi[J].Plant Pathol J,2017,33(5):488-498.
[9] XU T,ZHU T H,LI S J. β-1,3-1,4-glucanase from Bacillus velezensis ZJ20 exerts antifungal effect on plant pathogenic fungi[J].World J Microbiol Biotechno,2016,32(2):26-34.
[10] 杨胜清,张 帆,马贵龙.贝莱斯芽孢杆菌S6拮抗物质分离纯化及抑菌机理[J].农药,2017,56(9):645-649.
