慢病毒介导miR-34a表达对视网膜母细胞瘤自噬的影响及机制研究△
2019-01-10苏杰马春梅邵宏超杨馥宇刘岩葛嫣然
苏杰 马春梅 邵宏超 杨馥宇 刘岩 葛嫣然
自噬是一个吞噬自身细胞质蛋白或细胞器,并将其包裹进囊泡,与溶酶体形成自噬溶酶体,对包被物进行降解的过程[1-2]。自噬调控机制的异常可导致多种疾病的发生发展,甚至诱发癌变[3-4]。研究指出,高迁移率族蛋白1(high mobility group protein 1,HMGB1)与肿瘤的发生发展密切相关,并有证据表明其与视网膜母细胞瘤的浸润及自噬相关[5]。miR-34a已被证实与肝癌相关,能降低肝癌细胞的恶性行为,可作为潜在的抗肿瘤治疗靶点[6]。但对于miR-34a如何调节人视网膜母细胞瘤细胞自噬鲜有报道。因此本研究通过测定HMGB1及miR-34a的表达,探讨HMGB1与miR-34a调节人视网膜母细胞瘤细胞自噬的作用机制。
1材料与方法
1.1主要试剂及仪器人视网膜母细胞瘤Y79细胞系(深圳豪地华拓生物),胎牛血清、Opti-MEMⅠ培养液、RPMI-1640培养基(美国Gibco公司),慢病毒载体系统(中国吉凯基因公司),miR-34a、HMGB1慢病毒包装系统(广州复能基因公司),Trizol裂解液(美国Thermo公司),磷酸化绿色荧光蛋白-LC3质粒由广州华韵生物科技有限公司设计合成;高纯度质粒提取试剂盒(美国Sigma公司),miR-34a的RT-PCR试剂盒(上海哈灵生物科技有限公司);Attune NxT流式细胞仪(美国Thermo公司),荧光倒置显微镜(德国Lavisin Biotec公司),Multiskan Go酶标仪(美国Thermo公司),CM-120透射电子显微镜(荷兰飞利浦公司)。
1.2方法
1.2.1细胞培养与分组Y79细胞株细胞悬浮生长,呈团片状,孵育细胞覆盖达到培养瓶的80%以上时传代。吸弃旧培养液,取生长状态良好的Y79细胞,使用PBS缓冲液漂洗1次,用含体积分数10%胎牛血清的RPMI-1640培养基培养,置于37 ℃、体积分数5%CO2培养箱中恒温培养,培养至细胞间隙变宽。使用3 mL无菌巴氏管轻柔吹打细胞,离心,去上清,加入新的培养液置入培养箱中培养。每3 d传代1次。分组:取处于对数期的Y79细胞,制备单细胞悬液,将转染miR-34a的慢病毒载体、转染HMGB1载体及共转染miR-34a+HMGB1的慢病毒载体及培养液接种至Y79细胞。按照接种载体分组,将Y79细胞株分为4组,分别为转染miR-34a组、转染HMGB1组、共转染miR-34a+HMGB1组及阴性对照组。
1.2.2miR-34a慢病毒载体的构建及cDNA转染获取的人miR-34a序列,从Genbank中查阅HMGB1的cDNA序列,设计合成miR-34a及HMGB1前体引物,采用PCR方法扩增含miR-34a及HMGB1前体片段,并克隆至慢病毒载体系统。将带有miR-34a及HMGB1前体的片段转染Y79细胞,24 h后收集细胞。将4×105mL-1细胞加注于96孔板中,用不含抗生素的培养基培养至细胞融合度为90%~95%,在Opti-MEMⅠ中加入0.9 μg DNA,在另外培养孔中加入2.0 μL 胎牛血清,室温下孵育5 min,将两种试剂混合均匀后共孵育20 min后移至细胞培养板,并置于37 ℃、体积分数为5% CO2的环境中孵育24 h。总反应体系:逆转录条件设为42 ℃,20 min;98 ℃,5 min;4 ℃,5 min,最后将cDNA储存于-20 ℃冰箱。
1.2.3细胞总RNA的提取及RT-PCR检测miR-34a的表达人视网膜母细胞瘤总RNA提取,加入Trizol溶液裂解人视网膜母细胞瘤RNA,应用核酸蛋白仪和琼脂糖电泳对提取的RNA进行分析。取总RNA 4 μL,80 ℃水浴5 min,加入反转录反应液,44 ℃孵育72 min终止,留取产物待用。本研究所使用siRNA序列为miR-34a:上游引物5’-CAACAGAAGGCTCGAGCCTCCTGCATCCTTCTTC-3’,下游引物5’-ATTCTGATCAGGATCCTGGAGCTCACTTTCCCAG-3’;以GAPDH为对照:上游引物5’-TAAAGGAACCAGAATCCTGGTCCGGTGT-3’,下游引物5’-CTC-GTTGTCATCTGGCAGGACCGTGTTA-3’。扩增参数,95 ℃ 9.8 min,60 ℃ 48 s,73 ℃延伸50 s,72 ℃最终延伸10 min,10 ℃保存。基因表达分析采用2-△△Ct法测定相对含量,将GAPDH设为内参,取Ct值。△Ct=Ct目的基因-CtGAPDH;△△Ct=△Ct实验组-△Ct对照组。
1.2.4Caspase3活性检测取处于对数期的Y79细胞接种于96孔板培养基中,每孔加5×103个细胞,孵育72 h后,利用Capase3检测试剂盒检测Caspase3活性,以酶标仪于波长405 nm处的吸光度(absorbance,A)值表示活性变化,每份样品检测6次,取平均值。
1.2.5流式细胞仪定量分析自噬的单丹磺酰尸胺阳性细胞率取4组对数期Y79细胞,密度为4×105mL-1接种于6孔板,用含miR-34a的RPMI-1640培养液培养48 h后,用含50 μmol·L-1单丹磺酰尸胺(monodansyl cadaverin,MDC)的新鲜RPMI-1640培养液培养,于37 ℃、体积分数5%CO2环境中孵育15 min,PBS洗涤两次后加500 μL PBS上机,上机前使细胞混匀悬浮呈单个细胞,插入流式细胞仪,488 nm激发波长,测定MDC阳性细胞染色的荧光强度。
1.2.6透射电孔子显微镜下观察自噬超微结构取对数生长期Y79细胞,调整细胞浓度,阴性对照组使用RPMI-1640培养液,其余3组使用miR-34a RPMI-1640培养液培养72 h后收集细胞,PBS洗涤2次,1000 r·min-1离心5 min,后将细胞收集于离心管中,加入戊二醛液,1000 r·min-1离心10 min,静止30 min,送电镜室,经脱水、浸透、固化、切片,30 g·L-1醋酸铀-枸橼酸铅双染色后采用CM-120透射电子显微镜观察并拍片。
1.3统计学分析采用SPSS 19.0统计学软件进行统计学分析。服从正态分布的计量资料采用均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t分析。以P<0.05为差异有统计学意义。
2结果
2.1miR-34a转染及效果miR-34a转染Y79细胞72 h后,荧光显微镜下观察到细胞出现绿色荧光,转染率达到87%,且细胞状态良好。转染72 h后,RT-PCR测定各组miR-34a及HMGB1的mRNA水平。转染miR-34a组的miR-34a表达水平(2.04±0.46)明显高于阴性对照组(1.03±0.21),差异有统计学意义(P<0.05);而共转染miR-34a+HMGB1组HMGB1(0.42±0.08)的表达明显低于转染HMGB1组(1.08±0.16),差异有统计学意义(P<0.05)。见图1。

图1转染72 h后荧光显微镜下观察(×200)。A:阴性对照组明视野;B:阴性对照组荧光显色;C:转染miR-34a组明视野;D:转染miR-34a组荧光显色;E:转染HMBG1组明视野;F:转染HMBG1组荧光显色;G:共转染miR-34a+HMBG1组明视野;H:共转染miR-34a+HMBG1组荧光显色
2.2Caspase3活性检测结果细胞培养72 h,利用Caspase3 试剂盒检测四组Caspase3活性,四组Caspase3活性比较差异有统计学意义(F=12.983,P=0.002)。结果显示,转染miR-34a 组Caspase3阳性细胞个数[(10.75±2.87)个·mm-2]明显高于阴性对照组[(3.48±0.74)个·mm-2],转染HMGB1组Caspase3阳性细胞个数[(2.46±0.94)个·mm-2]明显低于共转染miR-34a+HMGB1组[(6.21±1.74)个·mm-2],差异均有统计学意义(均为P<0.05)。
2.3荧光显微镜下Y79细胞MDC染色情况不同处理组细胞在RPMI-1640培养液处理Y79细胞72 h后,MDC染色增强,荧光颗粒呈点状分布在自噬泡附近区域,由图2中染色可见,转染miR-34a组可见MDC阳性颗粒明显增多,共转染miR-34a+HMGB1组次之,阴性对照组可见极少量MDC阳性荧光颗粒,转染HMGB1组阳性颗粒最少(图2)。
2.4流式细胞仪检测MDC阳性率流式细胞仪检测不同处理组Y79细胞MDC阳性率,四组72 h后Y79细胞阳性率比较差异有统计学意义(χ2=102.480,P<0.05),miR-34a组MDC阳性率(56.94%)明显高于阴性对照组(2.15%),差异有统计学意义(P<0.05);共转染miR-34a+HMGB1组MDC阳性率(43.11%)明显高于转染HMGB1组(10.32%),差异有统计学意义(P<0.05)。见图3。
2.5透射电子显微镜下观察各组细胞自噬超微结构透射电子显微镜下观察不同处理组自噬在Y79细胞内的超微结构改变,可见阴性对照组72 h瘤细胞形态基本无改变,共转染miR-34a+HMGB1组可见双层膜结构,转染miR-34a组可见自噬溶酶体结构(图4)。
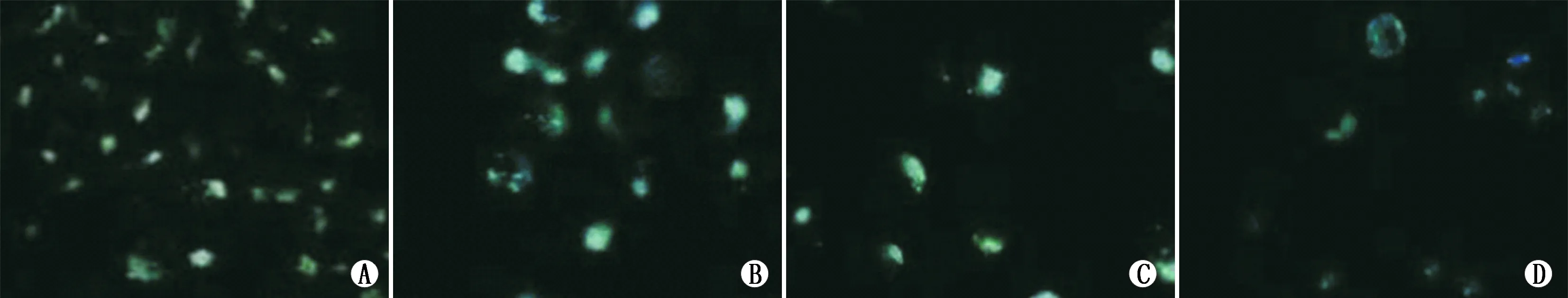
图2Y79细胞MDC染色情况。A:转染miR-34a组;B:共转染miR-34a+HMGB1组;C:阴性对照组;D:转染HMGB1组

图3流式细胞仪检测各组MDC阳性率。A:阴性对照组;B:转染HMGB1组;C:共转染miR-34a+HMGB1组;D:转染miR-34a组

图4透射电子显微镜观察不同处理组自噬超微结构(×400)。A:阴性对照组;B:共转染miR-34a+HMGB1组;C:转染miR-34a组(红色箭头:自噬溶酶体;白色箭头:残留的消化底物)
3讨论
视网膜母细胞瘤是常见的眼内恶性肿瘤,目前临床主要的治疗方法有眼球摘除、化疗及放疗,然而以上治疗方式对患者影响较大,对患者的生活造成极大的不便[7-8]。基因治疗作为一种新的治疗方式目前尚处于研究探索阶段[9],miR-34家族是一类高度保守的miRNA,主要有miR-34a、miR-34b、miR-34c三种。其中miR-34a主要在脑内表达,季青山等[10]研究表明,在肿瘤细胞中miR-34a的表达量明显下降。有研究指出,miR-34a是p53介导的抗肿瘤过程中重要环节,p53可激活miR-34a发挥抗肿瘤作用,而miR-34a可通过正反馈上调p53增强抗肿瘤作用[11]。HMGB1具有稳定染色质及调控基因转录的功能,动物实验表明,敲除HMGB1后,幼鼠很快死亡[12]。并有报道指出,在多种肿瘤中都发现HMGB1与肿瘤的发展及浸润存在联系,抑制HMGB1通路可有效抑制细胞增殖及侵袭[13]。近年来研究发现,自噬在肿瘤治疗中可发挥重要作用,自噬能清除细胞内的致癌物质及受损的细胞,稳定细胞内环境、清除细胞垃圾,促进细胞生长及代谢[14-15]。既往研究指出,细胞自噬功能的异常与肿瘤的发生发展具有密切联系,肿瘤细胞的自噬能力低于正常组织细胞[16],这提示,细胞自噬能力的降低可能对肿瘤的发展有利。miR-34a正反馈作用与细胞自噬作用均具有抗肿瘤作用,目前国内外已有利用两种途径抑制肿瘤细胞增殖的研究[17-18],但两者对视网膜母细胞瘤的研究较少,且miR-34a对自噬功能是否具有调节作用的报道也较少。因此,本研究通过miR-34a及HMGB1转染视网膜母细胞瘤,观察其对自噬的影响并探讨其机制。
本研究结果显示:RT-PCR检测miR-34a的转染率,转染miR-34a后,miR-34a的表达明显升高,高于其他三组,差异有统计学意义,共转染miR-34a+HMGB1后,miR-34a表达下降。Caspase3是一种蛋白酶,其是细胞凋亡过程中最重要的剪切酶,同时也是CTL细胞杀伤的重要组成部分[19]。Caspase3活性检测显示:转染miR-34a组Caspase3活性最高,转染HMGB1组活性最低,而共转染miR-34a+HMGB1后Caspase3活性呈上升趋势,提示转染HMGB1后可降低Caspase3的活性,增强肿瘤的浸润及发展。通过本研究结果可以得出,转染miR-34a可提高机体对肿瘤的抑制作用,miR-34a可能通过抑制HMGB1的表达提高抗肿瘤活性。
MDC是一种可在分子水平检测自噬发生情况的方法,其在细胞内可被细胞中酸性成分结合并聚集在自噬囊膜周围,因此可根据MDC的荧光强度及荧光颗粒的数量分析自噬的活化情况[20-21]。本研究中,通过荧光显微镜及流式细胞仪检测MDC,结果显示,转染miR-34a组可见MDC阳性颗粒明显增多,共转染miR-34a+HMGB1组次之,阴性对照组可见极少量MDC阳性荧光颗粒,转染HMGB1组最少。流式细胞仪检测结果表明,转染miR-34a组MDC阳性率明显高于其余三组,转染HMGB1组MDC阳性率最低,共转染组居中。这提示,miR-34a可提高细胞自噬能力,其在体内发挥作用的途径可能通过抑制HMGB1的表达来实现。通过透射电子显微镜发现,阴性对照组自噬泡未见明显改变,共转染miR-34a+HMGB1组自噬泡的出现早于Y79细胞核的改变并出现双层膜结构,miR-34a转染组出现自噬溶酶体囊膜,说明miR-34a可以诱导视网膜母细胞瘤发生自噬,该结果与Wu等[20]研究结果一致,同样与本研究流式细胞仪检测结果相符。
综上所述,本研究结果表明通过上调miR-34a能够降低视母细胞瘤的增殖,并通过观察HMGB1转染情况,推测miR-34a在体内可能通过抑制HMGB1的表达提高细胞的自噬能力,从而提高抗肿瘤作用,也为我们以后制定抗肿瘤方案提供有力的理论基础。
