土霉素对10种经济作物的生态毒理效应
2019-01-03姚洪伟商照聪舒耀皋
姚洪伟 商照聪 舒耀皋


摘要:通过测定土霉素对10种经济作物(小白菜、甘蓝、洋葱、大白菜、生菜、菜豆、玉米、豇豆、黄瓜和白萝卜)的种子发芽率、根伸长、芽伸长和生物量的影响,以期为土壤-植物系统中土霉素污染的生态环境风险评价提供依据。结果表明,在9.38~293.15 mg/L的质量浓度范围内,10种种子的发芽率与土霉素浓度之间剂量-效应关系不明显;土霉素对10种试验种子的根伸长抑制率、芽伸长抑制率和生物量抑制率之间存在显著的剂量-效应关系,指标敏感性表现为根伸长>芽伸长>生物量>发芽率;以半最大效应浓度(EC50)为判断依据,对所选植物种子的根伸长抑制效应表现为菜豆>白萝卜>玉米>甘蓝>豇豆>洋葱>小白菜>生菜>大白菜>黄瓜;根伸长抑制率可作为土霉素对种子毒性的敏感性指标,能反映种子被四环素类抗生素污染的状况。
关键词:土霉素;经济作物;种子;根伸长;芽伸长;生物量;回归方程
中图分类号: X171.5文献标志码: A
文章编号:1002-1302(2019)21-0313-05
收稿日期:2018-07-31
基金项目:上海市国资委企业技术创新和能级提升项目(编号:2016006)。
作者简介:姚洪伟(1987—),女,山东菏泽人,硕士,工程师,研究方向为环境安全评价研究。E-mail:yaohanyhw2@163.com。
通信作者:舒耀皋,硕士,高级工程师,研究方向为环境安全评价研究。E-mail:syg@ghs.cn。
近年来,水源水和饮用水中逐渐检测出了新兴痕量污染物——药品和个人护理用品(PPCPs)[1-2]。国外已有研究表明,多种PPCPs对人类及其他生物具有生殖、神经、肝肾毒性等毒理学效应或具有致癌可能性[3]。土霉素是一种典型的PPCPs药物,具有广谱抗病原微生物作用,在全世界被广泛使用。我国是土霉素生产和使用大国,2003年土霉素产量就达到1万t,占世界总产量的65%[4]。土霉素的大量使用使其在自然环境中的残留日趋严重[5],代谢产物可能过量蓄积并储存于动物的细胞和组织器官中,人们通过食摄取可能会引起体内病变[6]。Wollenberger等研究表明,环境中残留的土霉素对水生动物具有不良的生态毒理效应[7]。
土壤(或沉积物)是抗生素等污染物质的最终归宿之地,进入环境中的抗生素将在土壤(或沉积物)中积累,必定对土壤生态系统产生一定的影响[8]。目前,土霉素的生态毒理研究还主要集中在水体、沉积物、污泥中的分布特征以及土霉素对各种生物影响的剂量关系上,涉及的生物主要有鱼、蚯蚓、老鼠等,对于其在土壤-植物系统中的毒性效应研究还很少[9-10]。土壤作为陆地生态系统的重要组成部分,研究植物-土霉素的相互作用对于毒理学和植物学具有重要的现实意义。
2017年6—10月,在上海化工研究院有限公司环境安全评价实验室完成试验。本研究以土霉素为目标污染物,选用与人们日常生活密切相关的10种经济作物种子,参照标准测试方法[11-13],考察土霉素对植物种子的发芽和根伸长的抑制效应,以期为土壤-植物系统中土霉素污染的生态环境风险评价提供依据,并为土霉素污染耕地的植物生态修复提供数据支持。
1材料与方法
1.1试验材料
1.1.1土霉素
土霉素为分析纯,纯度在99%以上,购自内蒙古格林特制药有限责任公司。
1.1.2试验用种子
根据《化学品测试方法生物系统效应卷》[12]和《国家环境保护局化学品测试准则》[13]推荐,共选用10种经济作物种子,种子来源等情况见表1。
试验时挑选大小一致、颗粒饱满、粒径相同、未破损的种子进行试验。
1.1.3试验用基质
选用惰性材料石英砂(粒徑为40~100 μm)作为试验基质,试验前用7.5 mol/L硝酸清洗,并用NaOH溶液以及蒸馏水漂洗,清洗后石英砂的pH值为中性。
1.1.4仪器设备
LC-20AD型高效液相色谱仪,购自日本岛津仪器公司;ME204E型电子天平、ME2002E型电子天平,购自METTLER TOLEDO;RXZ-1500B型人工气候箱,购自宁波江南仪器厂;A1000型培养箱,购自加拿大CONVIRON;Multi 3420型便携式水质分析仪,购自德国WTW;90-1B型强力磁力搅拌器,购自上海梅颖浦仪器仪表制造有限公司;300 mm型钢直尺,购自宁波长城精工实业有限公司;HD2010W型电动搅拌器,购自上海司乐仪器有限公司;温湿度记录仪,购自ZOGLAB;移液器,购自艾本德中国有限公司;直径为150 mm的玻璃培养皿、烧杯、量筒等,均购自海门市华凯实验玻璃仪器厂。
1.2试验方法
通过预试验确定10种种子发芽率和根伸长的半最大效应浓度(EC50),以此为依据开展正式试验。对每种植物的试验,设置6个按几何级数设置的不同处理质量浓度,其处理质量浓度比率在1.5~2.0之间,设定质量浓度分别为9.38、18.75、 37.50、7500、150.00、293.15 mg/L 并设置1个空白对照组(用去离子水替代土霉素溶液)。每个培养皿加入500 g石英砂和130 mL 试验溶液,混匀,放入10粒种子。对照组加入去离子水,每1处理浓度组和对照组各设置3次重复,每个重复用10粒种子。将培养皿放入人工气候箱中,人工气候箱温度设定为25 ℃,湿度为75%,并保持黑暗。
在使用前,测定各试验溶液质量浓度并测定其pH值。试验过程中观察种子的发芽和生长情况。当对照组种子发芽率在65%以上,根伸长长度为20 mm时,结束试验。
1.2.1土霉素质量浓度测定
用岛津LC-20AD型高效液相色谱仪测定水溶液中的土霉素含量,液相色谱测定条件如下:选择Waters Atlantis T3柱,4.6×150 mm,5 μm色谱柱;检测器:二极管阵列检测器(DAD);进样量为5 μL,柱温为30 ℃,流动相采用38%甲醇:72%水(含0.1%甲酸),流速为1.0 mL/min,检测波长为268 nm,运行时间为5 min。该色谱条件下,土霉素的保留时间为3.15 min。按外标法以每个浓度的平均峰面积对照样品质量浓度进行回归,得回归线性方程为y=7 654.23x,r2=0.991 4。
1.2.2指标测定
试验期间,每24 h记录1次发芽种子数并补充溶液保持湿度,7 d时调查菜豆、玉米、豇豆、黄瓜和白萝卜的发芽率和生长情况,14 d时调查小白菜、甘蓝、洋葱、大白菜和生菜的发芽率和生长情况,其中生长情况为测量各发芽种子的根伸长、芽伸长和生物量。
1.3数据处理与分析
数据以3次重复的平均值表示,利用SPSS 17.0软件进行数据分析,采用概率单位方法对试验数据进行统计,得到10种植物的发芽率、根伸长抑制率、芽伸长抑制率和生物量抑制率的EC50及其95%置信区间。
2结果与分析
2.1土霉素化学分析
称取0.020 1 g土霉素,用甲醇和水(两者体积比为1 ∶1,含0.1% 甲酸)的混合溶液定容至50 mL,得质量浓度为400 mg/L 的储备液。将储备液稀释成质量浓度为4、8、16、40、80、160 mg/L的溶液,重复进样2次。按外标法以每个浓度的平均峰面积对照样品浓度进行回归,得回归线性方程为y=7 654.23x,r2=0.991 4。
将4 mg/L测出的信号与基线噪音信号高度进行比较,得出S/N=195.32,进样体积为5 μL,以3倍基线噪音得出仪器对该样品的最小检测限(LOD)为0.061 mg/L;以10倍基线噪音得出相应最低定量限(LOQ)为0.20 mg/L。
试验开始时测定试验溶液的质量浓度,实测质量浓度分别为9.38、18.75、37.50、75.00、150.00、293.15 mg/L,实测质量浓度均在设定质量浓度的80%~120%之间,因此质量浓度以实测质量浓度计。
2.2土霉素对10种种子发芽率、根伸长、芽伸长和生物量的影响
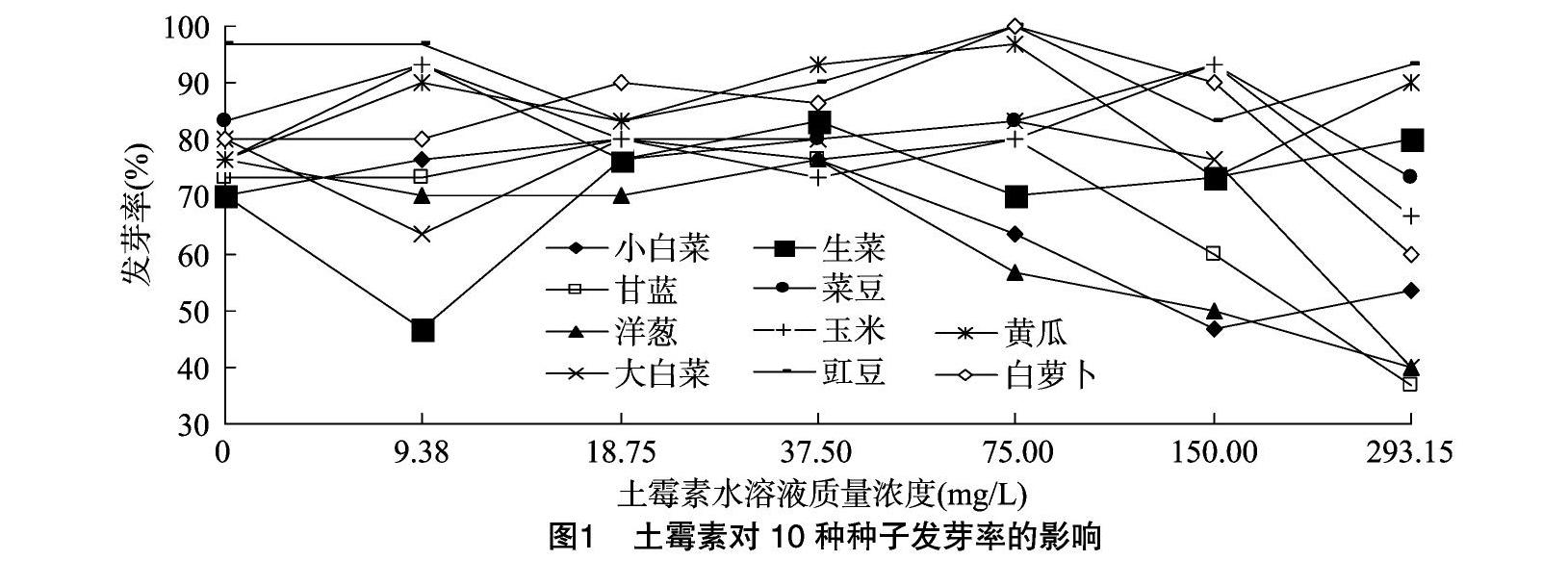
2.2.1土霉素对10种种子发芽率的影响
发芽率在一定程度上反映了土霉素对该植物种子的毒性大小。被土霉素处理过的种子发芽率越低,说明该种子对土霉素的耐受性越弱,毒性越大,反之耐受性越强,毒性越小。从图1可以看出,经不同质量浓度土霉素处理后,10种种子的发芽率与对照组相比均无明显差异。
2.2.2土霉素对10种种子根伸长的影响
通过图2可以看出,当土霉素污染水平为0~9.38mg/L时,对小白菜、甘蓝、大白菜、玉米、豇豆等种子的根伸长均有促进作用,0~18.75 mg/L 时对生菜和黄瓜种子根伸长生长均有促进作用,当土霉素的质量浓度为37.50 mg/L时开始出现抑制作用,随着土霉素质量浓度的增加抑制作用增强,293.15 mg/L时对生菜、黄瓜等种子的根伸长生长抑制率分别为75.00%、6000%。对洋葱、菜豆、白萝卜等种子的根伸长生长均有抑制作用,且与对照相比有显著差异(P<0.05),随着土霉素污染水平的增加,抑制作用逐渐增强,当土霉素的质量浓度为293.15 mg/L时对洋葱、菜豆、白萝卜等种子的根伸长生长抑制率分别为7300%、78.13%、81.60%。
2.2.3土霉素对10种种子芽伸长的影响
由图3可知,当土霉素污染水平为0~9.38 mg/L时,对洋葱、菜豆、黄瓜等种子的芽伸长均有促进作用,18.75 mg/L时开始出现抑制作用,293.15 mg/L 時对三者的抑制率分别为44.52%、7346%、82.60%。对小白菜、甘蓝、大白菜、生菜、玉米、豇豆、白萝卜等芽伸长的抑制率随着土霉素质量浓度的增加逐渐增强,293.15 mg/L时抑制率分别为63.80% 、68.58%、69.41、37.56%、58.25%、81.11%、53.92%。
2.2.4土霉素对根伸长和芽伸长抑制率的回归方程和EC50结果
土霉素对根伸长和芽伸长的抑制效应通过SPSS 17.0进行统计分析,得到回归方程和EC50。
通过表2可以看出,土霉素对10种种子根伸长的毒性效应不同,以根伸长EC50为判断依据,对所选植物种子的抑制效应表现为菜豆>白萝卜>玉米>甘蓝>豇豆>洋葱>小白菜> 生菜>大白菜>黄瓜。
土霉素对10种种子芽伸长的毒性效应不同,以芽伸长EC50为判断依据,对所选植物种子的抑制效应表现为大白菜>甘蓝>豇豆>黄瓜>菜豆>白萝卜>小白菜>洋葱>玉米>生菜。
2.2.5土霉素对10种种子生物量的影响
由图4可以看出,土霉素对10种种子生物量的毒性效应不同,低质量浓度土霉素对小白菜、甘蓝、菜豆、玉米、豇豆、黄瓜等种子的生物量均有促进作用,高质量浓度有抑制作用,且随着浓度的增加,抑制作用增强。 其中土霉素污染水平为150.00 mg/L以下时对玉米种子的生物量有促进作用,9.38 mg/L时促进率达103.39%,293.15 mg/L时开始有抑制效应,抑制率为1239%;当土霉素污染水平为0~37.50 mg/L时,对小白菜、黄瓜等种子的生物量均有促进作用。随着土霉素质量浓度的增加,对洋葱、大白菜、生菜、白萝卜等种子的生物量的抑制作用逐渐增大。
土霉素对10种种子生物量的影响,物种间存在显著差异(P<0.05),但试验处理间的差异不显著。如小白菜,在1875、37.50、75.00 mg/L质量浓度下与对照无显著差异,在150.00、293.15 mg/L质量浓度下与对照差异显著(P<0.05);甘蓝、生菜和菜豆的生物量在土霉素各质量浓度污染水平下均无显著性差异。
3讨论与结论
3.1讨论
田智宇等采用水培和土培的方法研究土霉素药渣对典型植物发芽影响时发现,土霉素废渣或土霉素碱溶液中的土霉素质量分数<25 mg/kg时,黄瓜种子的发芽率与对照相比均无显著差异[14];陈博阳等研究土霉素对玉米种子发芽的影响显示,30 mg/L土霉素对玉米发芽均有显著促进作用[15],本研究结果与之不同,原因为30 mg/L质量浓度较低,处于对种子发芽的促进阶段,未达到土霉素对种子产生毒害的阈值。可能是由于种子发芽过程主要受胚内养分供应,并受到种皮对种子的保护,从而受外界物质影响较小[16],另外由于抗生素等新型污染物的毒性不如工业化学品那样剧烈,导致土霉素污染对种子发芽的毒害作用被部分掩盖,因此,种子发芽率不适宜作为土霉素污染对植物种子生态毒理学的敏感指标[17]。
林匡飞等研究硒对小麦种子发芽与根伸长抑制效应,发现按EC25比较,根长抑制率>根干质量抑制率>茎叶长抑制率>发芽抑制率,且对根生长抑制最为敏感,认为根伸长抑制率可作为土壤污染的生物指示物[18]。Bradel等研究发现,四环素可以通过抑制植原体的活性而影响幼芽分枝[19]。这些都有可能成为土霉素污染胁迫下植物幼苗生长受限制的原因。
土霉素对10种种子芽伸长与根伸长的影响整体趋势相一致,但抑制率大小不同,对根的生长抑制率稍大于芽伸长。相对于对芽伸长的抑制结果,土霉素對植物种子的根伸长抑制程度较为明显。Cheng等研究表明,有机化合物在相同质量浓度下对植物幼苗根长的抑制效应大于其他参数[20]。这是由于种子萌发时向周围环境吸水膨胀的同时,受到土霉素不同强度的胁迫,引起决定种子萌芽力的下降,导致种子萌芽率低,生长迟缓。
土霉素对种子发芽和生长的影响还与作物种类有关。本研究中,菜豆种子对土霉素的耐性最差,18.75 mg/L时,土霉素对菜豆根长的抑制率已经达到了47.32%,相同浓度的土霉素对白萝卜根长和芽伸长的抑制率均大于玉米种子,因此,土霉素对作物种子发芽和根长抑制作用的强弱与作物种类相关,但与作物种子粒径大小关系不确定,这同侯俊杰等研究茶皂素对种子发芽、根长的影响结论[21]相一致。
Migliore等研究发现,恩诺沙星对黄瓜、生菜、白萝卜的生长有促进效应,即在低浓度时促进植物生长,而在高浓度时抑制植物的生长[22-24]。林琳等研究土壤四环素污染胁迫下小白菜、大白菜幼苗的生长试验,结果表明,土壤四环素污染对小白菜、大白菜幼苗的生长毒性表现为根长﹥ 鲜质量﹥茎长[25]。本研究结果基本与Migliore、林琳等的研究结果[22-25]相一致。
综上所述,经土霉素不同质量浓度处理后,对于供试的10种植物种子来说虽然发芽率没有明显变化,但发芽势和种子表现出来的活力却有较明显的不同,这可能是因为植物在发芽过程中,环境中的抗生素残留将会对种子萌发尤其是发芽后的生长产生影响。
种子发芽和根伸长毒性是主要的高等植物毒理试验方法,这些试验方法可通过植物种子在污染条件下种子发芽情况、根系生长状况、芽生长情况和整体生物量来诊断化学物质对植物胚胎发育影响的程度。一般认为,化学品对种子的影响存在一个较低浓度下促进效应和高浓度下的抑制效应。本试验的结果在设定的土霉素处理范围内,各种子发芽、根伸长、芽伸长和生物量的变化趋势符合上述规律。
3.2结论
本研究以土霉素为目标污染物,选用与人们日常生活密切相关的10种经济作物种子,考察土霉素对植物种子的发芽和根伸长的抑制效应,试验结果表明,(1)与对照组对比,土霉素在9.38、18.75、37.50、75.00、150.00、293.15 mg/L质量浓度下对10种种子的发芽率影响不显著。
(2)土霉素对各种植物种子的发芽率、根伸长、芽伸长和生物量的毒性效应存在差别,在试验质量浓度范围内,土霉素毒性与种子的发芽率、根伸长抑制率、芽伸长抑制率和生物量抑制率之间存在明显的剂量-效应关系,指标敏感性表现为根伸长>芽伸长>生物量>发芽率。
(3)以EC50为判断依据,土霉素对10种种子根伸长的毒性效应表现为菜豆>白萝卜>玉米>甘蓝>豇豆>洋葱>小白菜> 生菜>大白菜>黄瓜;对芽伸长的毒性效应表现为大白菜>甘蓝>豇豆>黄瓜>菜豆>白萝卜>小白菜>洋葱>玉米>生菜。
(4)土霉素对植物种子的根伸长抑制程度较为明显,因此根伸长可以作为评价土霉素生态毒性效应的一个较为敏感的指标。在被土霉素污染的耕地中,在其他条件如温度、气候等均满足的情况下,作物种类耕种的选择应综合考虑土霉素对根伸长和芽伸长的胁迫效应。
参考文献:
[1]Kasprzyk-Hordern B,Dinsdale R M,Guwy A J. The occurrence of pharmaceuticals,personal care products,endocrine disruptors and illicit drugs in surface water in South Wales,UK[J]. Water Research,2008,42(13):3498-3518.
[2]葛林科,任红蕾,鲁建江,等. 我国环境中新兴污染物抗生素及其抗性基因的分布特征[J]. 环境化学,2015,34(5):875-883.
[3]Roosens L,Covaci A,Neels H. Concentrations of synthetic musk compounds in personal care and sanitation products and human exposure profiles through dermal application[J]. Chemosphere,2007,69(10):1540-1547.
[4]An Q C,Zhang X,Chen K L. Detection of tetracyclines residue in animal tissues by ELISA:preparation of anti-OTC antibodies[J]. Animal Husbandry and Veterinary Medicine,2004,36(9):8-9.
[5]Arikan O A,Rice C,Codling E. Occurrence of antibiotics and hormones in a major agricultural watershed[J]. Desalination,2008,226(1/2/3):121-133.
[6]Jiang X S,Wang J P,Ying Y B,et al. Recent advances in biosensors for food safety detection[J]. Transactions of the Chinese Society of Agricultural Engineering,2007,23(5):272-277.
[7]Wollenberger L,Halling-Srensen B,Kusk K O. Acute and chronic toxicity of veterinary antibiotics to Daphnia magna[J]. Chemosphere,2000,40(7):723-730.
[8]Jjemba P K. The potential impact of veterinary and human therapeutic agents in manure and biosolids on plants grown on arable land:a review[J]. Agriculture,Ecosystems and Environment,2002,93(1/2/3):267-278.
[9]杜亞琼,王子成,李霞. 土霉素胁迫下拟南芥基因组DNA甲基化的MSAP分析[J]. 生态学报,2011,31(10):2846-2853.
[10]安婧,周启星,刘维涛. 土霉素对小麦种子发芽与幼苗生长发育的生态毒性[J]. 环境科学,2009,30(10):3022-3027.
[11]OPPTS. Ecological Effects Test Guidelines. OPPTS 850.4200 Seed germination/root elongation toxicity test[S]. Washington D C:US EPA,1996.
[12]环境保护部化学品登记中心《化学品测试方法》编委会.化学品测试方法生物系统效应卷[M]. 北京:中国环境出版社,2013:459-463.
[13]阎雷生. 国家环境保护局化学品测试准则[M]. 北京:化学工业出版社,1990.
[14]田智宇,曹卫宇,邹晓岱. 土霉素废渣对典型植物发芽影响研究[J]. 化肥工业,2016,43(6):82-86.
[15]陈博阳,余彬彬,钱晓晴,等. 锌和土霉素胁迫对玉米种子发芽和幼苗抗氧化酶活性的影响[J]. 江苏农业学报,2017,33(1):13-18.
[16]Araujo A,Monteiro R T. Plant bioassays to assess toxicity of textile sludge compost[J]. Scientia Agricola,2005,62(3):286-290.
[17]陈苏,孙丽娜,孙铁珩,等. 人工合成麝香对小麦种子发芽的生态毒性[J]. 环境科学,2011,32(5):1477-1481.
[18]林匡飞,徐小清,郑利,等. Se对小麦种子发芽与根伸长抑制的生态毒理效应[J]. 农业环境科学学报,2004,23(5):885-889.
[19]Bradel-Tretheway B,Preil W,Jeske H. Remission of the free-branching pattern of Euphorbia pulcherrima by tetracycline treatment[J]. Journal of Phytopathology,2000,148(11/12):587-590.
[20]Cheng Y,Zhou Q X. Ecological toxicity of reactive X-3B red dye and cadmium acting on wheat (Triticum aestivum)[J]. Journal of Environmental Sciences,2002,14(1):136-140.
[21]侯俊杰,李宁宁,吕辉雄,等. 茶皂素对种子发芽、根长及土壤酶活性的影响[J]. 农业环境科学学报,2015,34(4):660-665.
[22]Migliore L,Cozzolino S,Fiori M. Phytotoxicity to and uptake of enrofloxacin in crop plants[J]. Chemosphere,2003,52(7):1233-1244.
[23]Migliore L,Civitareale C,Cozzolino S,et al. Laboratory models to evaluate phytotoxicity of sulphadimethoxine on terrestrial plants[J]. Chemosphere,1998,37(14/15):2957-2961.
[24]Migliore L,Cozzolino S,Fiori M. Phytotoxicity to and uptake of flumequine used in intensive aquaculture on the aquatic weed,Lythrum salicaria L.[J]. Chemosphere,2000,40(7):741-750.
[25]林琳,安婧,周启星. 土壤四环素污染对小大白菜幼苗生长发育的生态毒性[J]. 环境科学,2011,32(8):2430-2435.
